新辅助化疗联合间歇性肿瘤细胞减灭术治疗卵巢癌的疗效
2020-09-05方堃覃庆锋通讯作者
方堃 覃庆锋(通讯作者)
(贵州省人民医院 贵州 贵阳 550002)
卵巢癌目前是女性生殖系统恶性肿瘤中预后最差的,其病死率在女性生殖器官恶性肿瘤中排名第一位。目前暂无有效的卵巢癌筛查方式,且其早期临床症状不明显,据国际妇产科联盟(FIGO)的统计,约2/3 的患者发现卵巢癌时已达晚期(Ⅲ~Ⅳ期)[1]。对于AOC 的治疗也在不断探索之中,之前标准治疗方式为先进行初始肿瘤细胞减灭术(primary debulking surgery,PDS),术后进行化疗。但因直接行PDS 对于部分AOC患者常难以达到满意的肿瘤细胞减灭,复杂、高风险、大范围的手术操作对妇科肿瘤医生也是极大的考验。2019 年美国国立综合癌症网络(NCCN)指南中对晚期卵巢癌(advanced ovarian cancer,AOC),指出AOC 的手术原则是尽量行满意的肿瘤细胞减灭术[2],能否达到满意的减瘤性手术成为影响患者治疗后总生存期(overall survival,OS)和无进展生存期(progressionfree survival,PFS)的重要独立因素[3]。目前为了改善手术条件,提高减瘤效果,探索出了新辅助化疗(neoadjuvant chemotherapy,NACT)与间歇性肿瘤细胞减灭术(interval debulking surgery,IDS)的联合应用治疗AOC 的新治疗方法[4]。本文比较了PDS 与NACT+IDS 治疗模式的疗效。
1.资料与方法
1.1 一般资料
选取2014 年1 月—2018 年12 月在贵州省人民医院妇科病区治疗的晚期卵巢癌患者121 例,均为上皮性恶性肿瘤。分为实验组即NACT+IDS(新辅助化疗联合间歇性肿瘤细胞减灭术)组67 例,对照组即PDS(初始肿瘤细胞减灭术)组54 例。
1.2 分组
在治疗开始之前由妇科肿瘤专科医生评估患者。完善影像学检查(如经阴道超声、MRI、CT 或PET-CT 等),实验室相关检查如肿瘤标志物(如CEA、CA125、AFP、CA199、HE4)。随机分为对照组和实验组。实验组41 ~68 岁,平均(52.8±10.2)岁;分期分别为:Ⅲa 期2 例,Ⅲb 期5 例,Ⅲc 期51 例,Ⅳ期9 例。对照组年龄35 ~69 岁,平均(55.1±9.8)岁;分期分别为:Ⅲa 期1 例,Ⅲb 期2 例,Ⅲc 期35 例,Ⅳ期16 例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。(所有病例均按 2014 年FIGO 卵巢恶性肿瘤标准进行分期。)
1.3 治疗方法
实验组为NACT+IDS 组(新辅助化疗联合间歇性肿瘤细胞减灭术)67 例,即术前先行2 ~3 个DL(多西他赛75mg/m2+洛铂30mg/m2)的化疗疗程,病情好转后行间歇性肿瘤细胞减灭术,包括全子宫切除术、双侧附件切除术、大网膜切除术、盆腔淋巴结清扫术、腹主动脉旁淋巴结清扫术(必要时)、转移病灶切除术、阑尾切除术(必要时)等,术后再次给予DL 全身化疗6 个疗程,每3 周1 次。对照组为PDS 组(初始肿瘤细胞减灭术)54 例,先进行肿瘤细胞减灭手术,术后再进行6 个DL 全身化疗,每3周1 次。化疗期间,定期监测患者的血常规及肝肾功能、电解质,严密观察并及时处理所有并发症[4]。
1.4 观察指标
两组患者围手术期相关情况:手术时间(分钟)、术中失血量(毫升)、术后住院时间(天)、术后相关情况。术后全部病例均随访至截止时间、或发现疾病复发、患者死亡。随访时间至少12个月。完成以上治疗之后的第1年每三个月随访1次,第2 年后每六个月随访1 次。随访的内容包含:肿瘤标记物、妇科检查、妇科及腹部彩超、盆腹腔及胸部CT 等。随访的方法是包括电话及来院复查。根据WHO推荐的实体瘤客观化疗评估标准:完全缓解(CR):肿瘤灶完全消失。部分缓解(PR):肿瘤灶体积减少大于50%。改善(IP):肿瘤灶体积减少25%~50%,且未出现新病灶。稳定(SD):肿瘤灶体积减少小于25%,未出现新病灶。进展(PD):肿瘤灶体积增加25%,且出现新病灶,疾病控制率=CR+PR+IP[5]。
1.5 数据统计方法
所有数据采用SPSS18.0 统计软件进行统计并分析,计量资料以(±s)表示,采用t检验比较,计数资料以率(%)或构成比表示。P<0.05 为差异有统计学意义。
2.结果
2.1 两组患者出血量及手术和住院时间,实验组患者手术时间、术中出血量及住院时间低于对照组,两组对比有显著差异,见表1。
表1 两组患者出血量及住院和手术时间比较(±s)
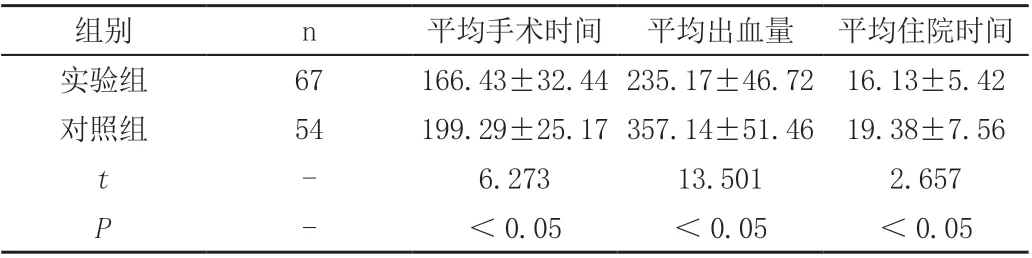
表1 两组患者出血量及住院和手术时间比较(±s)
组别 n 平均手术时间 平均出血量 平均住院时间实验组 67 166.43±32.44 235.17±46.72 16.13±5.42对照组 54 199.29±25.17 357.14±51.46 19.38±7.56 t-6.273 13.501 2.657 P-<0.05 <0.05 <0.05
2.2 手术满意情况比较实验组与对照组术中肿瘤残留直径相比,两组之间无明显统计学差异(P>0.05),见表2。
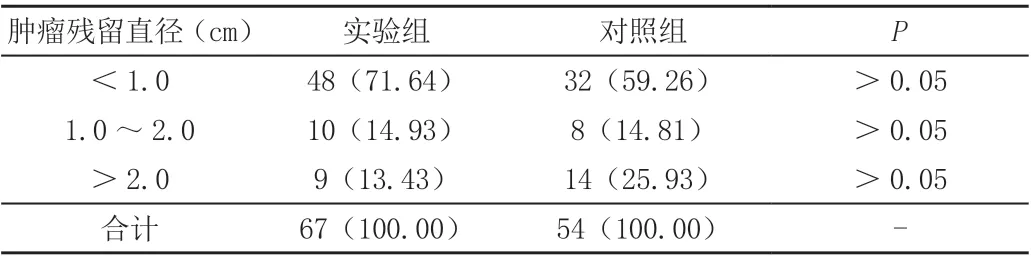
表2 两组肿瘤残留大小比较[n(%)]
2.3 两组患者随访期间治疗效果情况实验组患者近期疾病控制率与对照组相比无统计学差异,见表3。

表3 两组患者近期治疗效果[n(%)]
2.4 两组患者并发症发生情况,具体情况实验组患者并发症发生率与对照组无明显统计学差异,见表4。

表4 两组患者并发症发生情况
可见,NACT+IDS组出血量、手术时间及住院时间小于PDS组,P<0.05,有统计学意义,手术并发症,此文献涉及切口感染、肠漏、盆腔手术范围感染率,实验组与对照组无明显统计学意义。对于化疗副反应,NACT+IDS 组中有9 例患者曾出现I、II 度骨髓抑制,主要表现为粒系细胞减少,经相应处理后均已纠正,其余未见明显严重副反应。
3.讨论
AOC 患者病灶多向盆腹腔周围脏器及血管发生侵袭,故粘连紧密,且可产生大量腹水或胸水,AOC 既往常规治疗手段为PDS联合术后化疗,但是AOC 患者实施初始肿瘤细胞减灭术时常因恶性肿瘤组织致密粘连及转移,从而增加手术难度、术中出血、局部正常脏器功能损伤,这些都会增加手术时间及麻醉风险。但在最新FIGO 及NCCN 卵巢癌指南中明确指出首次手术的满意减灭程度是患者总生存时间及无瘤生存时间的重要影响因素[5]。
近年提出了NACT+IDS 的新治疗模式。NACT 的作用包括:(1)术前缩小原发和转移病灶,松动病灶周围粘连,在手术切除病灶的同时尽量保护重要器官或组织,并能尽可能切除所有原发和转移灶,使残余肿瘤最大径线≤1cm。为手术达到满意的R0 级减灭术提供更大的可能[6];(2)术前使肿瘤细胞静止,术中播散转移风险降低。(3)术前化疗评估化疗敏感性,指导下一步治疗方案[7]。
此项回顾性研究证实NACT+IDS 的治疗模式能够减少手术难度、缩短手术及住院时间。故对于不适合PDS 的患者,NACT+IDS模式可能为晚期卵巢癌的更佳治疗模式。但NACT 前需告知患者有10%的无效率。若NACT 无效或病情进展,往往预示预后较差,是手术还是更改化疗方案,还需进一步研究证实。故NACT的指征,需严格按照FIGO 和NCCN 指南中提到的NACT 实施前必须病理学明确为卵巢恶性肿瘤晚期[8],且预估PDS 可能无法达到满意效果或无法行PDS。评估的方式可为影像学检查或初次探查手术,例如影像学提示,肾门水平以上淋巴结考虑转移,肠管见弥漫性转移等;或初次探查手术中见肠管见散在转移灶(>2 处)、关键血管旁致密转移灶等无法行满意肿瘤细胞减灭;短期内暂无手术条件的患者应接受NACT[9]。但对于PDS 有把握达到满意的肿瘤细胞减灭,且并发症可接受的患者,还是首选PDS,可避免NACT 期间病情进展的风险[10]。因此,NACT 治疗AOC 仍需严格筛选病例,符合指南要求需行NACT,并对其耐受、敏感的患者,才能最大程度地体现NACT 的价值,在临床实际操作中需谨慎,根据每个AOC 病患的具体情况规范实施。
本研究的入组患者数较少,且随访时间有限,故对于NACT+IDS治疗方案是否能提高AOC患者的总生存期、无瘤生存率,仍进一步大量、长期的研究资料证实。
