牧草促生菌分离鉴定及对大豆促生性能的研究
2020-09-04舒健虹王子苑刘晓霞曾庆飞王小利
舒健虹,王子苑,刘晓霞,曾庆飞,王小利
(贵州省农业科学院草业研究所,贵州 贵阳 550006)
根瘤内生细菌是指与根瘤菌同时定居于豆科植物根瘤中,能与根瘤菌、宿主植物和谐相处,可以进行独立传递和繁殖[1]。植物内生菌可以通过固氮、溶磷解钾等过程产生各种生理活性物质,还可以提高宿主植物对干旱、高盐碱、重金属等胁迫的抗逆性。可产生植物生长调节剂如生长素、细胞激动素等促进植物生长[2],同时还可以产生抑菌物质增强宿主抵抗病原菌的能力[3]。植物、根瘤菌、内生细菌相互识别和选择,逐渐形成了各自特定的共生体系,在促进植物生长、改良土壤,以及生态系统的修复与平衡过程中起着极其重要的作用。近几年,有研究者从根瘤内分离出根瘤菌的同时也分离出内生细菌,如土壤杆菌(Agrobacterium)、肠杆菌(Enterobacter)、泛菌(PtuUoea)、埃希氏(Escherichia)及假单胞菌(Pseudommzas)等属群[4-6],这些内生菌不能单独与植物共生结瘤,对植物的生长起促进作用。
大多数豆科植物都能够与根瘤菌共生形成根瘤,但是不同种类的根瘤菌只能够和一定范围的豆科植物形成共生关系。研究表明,大豆氮素营养随生育期不同呈现时期性变化,根瘤氮对植株影响最高,土壤中氮影响较低[7-8]。但根瘤菌存在适应性分化,必然导致不同菌株在共生固氮效果、共生匹配性和不同生境下产生差异[9]。利用当地豆科植株根瘤分离出来的根瘤菌剂,开展根瘤菌与内生细菌组合对大豆植株影响的盆栽试验,其目的是筛选出与当地大豆品种相匹配,竞争性强的高效组合菌株,从而为下一步开发研制适合本地区推广使用的高效复合接种剂奠定坚实的物质基础。
1 材料与方法
1.1 豆科牧草根瘤样品的采集
在贵州省内选择生态条件典型、生长良好的天然豆科牧草植株,采集新鲜健壮、颜色鲜艳的成熟根瘤,剪时稍带一段根,按顺序编号并记录采集时间、地点、海拔高度、地形地貌、土壤类型、根瘤形状、颜色等内容,并将采集样品保藏于装有变色硅胶的离心管中密封,低温保存用于根瘤菌的分离。
用作盆栽试验的大豆为当地品种(黔豆1号),种子由贵州省草业研究所资源育种室提供。
1.2 培养基
PKO(Pikovaskaias)无机磷培养基[10]:用于溶磷能力测定;LB(溶菌肉汤培养基)[11]:用于菌株的活化及菌种保存;改良型YMA 培养基:用于根瘤菌的分离和固氮酶活性测定,其配方为甘露醇10 g,MgSO40.2 g,K2HPO40.25 g,KH2PO40.25 g,CaSO40.2 g,NaC1 0.1 g,酵母粉1 g,Na2MoO4(1%)1.0 mL,MnSO4(1%)1.0 mL,柠檬酸铁(1%)1.0 mL,蒸馏水定容至1 000 mL,pH 值7.0 ~7.2;固体培养基加琼脂粉16 ~18 g。
配制时先称取难溶的CaSO40.2 g 于烧杯中,加水于微波炉中煮沸后,再用磁力搅拌器搅动使之溶解。
1.3 根瘤菌株的分离与纯化
自来水冲净采集样品根表泥土,无菌水浸泡至根瘤吸胀,每份样品从根上挑取个大饱满的成熟根瘤10 ~20 颗,95%的酒精浸泡5 min 后再用0.1%HgC12处理5 min,无菌水冲洗6 次以上,转至无菌研钵中,加入1 000 mL 无菌水研磨成悬浊液,用移液枪将悬浊液转至加有刚果红的YMA 平板上,均匀涂布,28℃培养箱内恒温倒置培养。挑取不吸色、菌落圆形、边缘整齐、表面光滑而隆起、湿润黏稠、略透明或半透明的典型菌落,用稀释平板划线法,挑取单菌落进行革兰氏染色,镜检,直至获得纯化菌株。将纯化菌株接种至YMA液体培养基中,28℃振荡培养7 d 后用30%甘油保种,-70℃冷冻保藏。
1.4 菌株鉴定
选取在培养皿上生长快,且显湿润黏稠的菌株,用YMA 培养基活化菌株,待生长到中期(培养皿接种4 d),送往上海派森诺基因科技有限公司,委托其进行菌株鉴定。将得到的细菌16S rRNA 基因的核苷酸序列在NCBI 数据库中进行BLAST 在线比对,得到与待测物种序列相似性最大的物种信息,即为鉴定结果。
1.5 固氮酶活性、溶磷量测定
促生菌溶磷量的测定,首先对菌株进行活化,细菌用LB 液体培养,根瘤菌用YMA 水培养,培养至浓度为107~108cuf/mL,单一菌种取0.5 mL,组合菌种按照1∶1 的比例取菌悬液接种于盛有50 mL 已灭菌PKO 液体培养基中,测定方法参照李显刚等[12]实验方案。
菌株固氮酶活性采用青岛科创质量检测有限公司的固氮酶(NITS)酶联免疫分析试剂盒测定,以吸光度(OD 值)为横坐标,标准物的浓度为纵坐标,绘出标准曲线,用酶标仪在 450 nm 波长下测定OD 值,通过标准曲线计算样品中固氮酶(NITS)活性浓度。其中回归方程为Y=95.842x-3.958 5,R2=0.997 2,说明此测量值与拟合得到的公式之间的接近程度较好,公式较可靠。
1.6 拮抗反应试验及菌悬液的制备
将各供试菌株活化后分别两两交叉划线接种于LB 固体培养基上,28℃恒温箱中倒置培养2 ~5 d,每天观察两菌株交叉点的菌落生长情况。选取交叉点菌株生长良好的菌株进行盆栽试验。
1.7 大豆的发芽处理
挑选同一批次籽粒饱满、大小均一的大豆种子(黔豆1 号),用75 %的酒精消毒约 3 min,无菌水冲洗干净2 ~3 次,再用3%的次氯酸钠消毒10 min 后,无菌水冲洗3 ~4 次,放在加有4 mL 灭菌水的培养皿中,吸取2 mL(组合菌剂各菌液吸取1 mL,浓度107~108cuf/mL)菌液淋于消毒后的种子上室温培养 48 h。
1.8 珍珠石盆栽处理方法
将长出根尖生长正常的种子播于装有灭菌的珍珠石的花盆中,盆总重量332 ~310 g(盆重36.7 g),盆高9.5 cm,宽14.5 cm。将植株置于恒温25℃、每天光照16 h 的人工气候室中培养。出苗喷施Hoagland 全营养液[13],生长4 d 后每盆保留生长一致的幼苗3 株进行处理,每个菌株液按照1∶1 的体积,共20 mL 离心去上清液(单一菌株取20 mL 离心去上清液)加入灭菌水至20 mL 打入花盆中,每个处理重复5 次,共计100 mL;每天浇灌含有50%氮元素的Hoagland 营养液保持基质湿润,单一根瘤菌株处理作为对照CK,盆栽生长54 d。
1.9 促生菌组对大豆地上、地下部分的影响
每一处理的每个重复中随机选取2 株共10 株,用直尺测定其从地面至最高点的绝对高度为株高。植株根系全部取出选取差异小的2 株测其根长,将2 株为一个整体刈割后测定地上、地下部分鲜重,每组测5 个重复(以平地刈割为划分标准),同时计算根瘤数;105℃杀青15 min,65℃烘干至恒重,称地上植株和根系干重。
1.10 大豆植物粗蛋白、全磷、钙、酸性纤维、中性纤维含量的
植物粗蛋白(CP)含量采用硫酸-加速剂消解,凯氏法测定;植物全磷(P)含量采用硫酸-双氧水消解,钼锑抗比色法测定;植物钙(Ca)含量采用硝酸消解,原子吸收分光光度计测定;采用范式洗涤法,测定植物酸性洗涤纤维(ADF)及中性洗涤纤维(NDF)含量[14-18]。
1.11 数据处理
采用Excel 2003 和SPSS 18.0 软件进行统计分析。
2 结果与分析
2.1 促生菌的分离及鉴定结果
从贵州不同地区采集的15 份根瘤样品中,通过含结晶紫的YMA 平板划线分离培养,最终获得在平板上生长良好的36 株纯化菌株。菌株菌落多为圆形,直径在 2 ~3 mm 之间。挑选菌落隆起、边缘整齐、有粘液,且固氮酶活性较高的6 个菌株进行鉴定,其中4 株是根瘤菌,豌豆根瘤菌(Rhizobium leguminosarum)、伯克氏菌属[19](Burkholderia turbans)、中慢生型百脉根根瘤菌(Mesorhizobium loti)、根瘤菌属(Rhizobium sophorae);2 株为内生细菌,分别是枯草芽孢杆菌(Bacillus subtilis)、嗜麦寡养食单胞菌(Stenotrophomonas maltophilia),R286-1 和R286-5,R287-3 和R287-5 这2 组 为 同一根瘤菌源(表1 和表2)。
2.2 菌株拮抗反应及菌剂处理设置
将挑选出的4 个根瘤菌株和2 个细菌进行两两划线培养,结果发现所有平板划线交叉处的菌落均生长良好,表明 6 个菌株间无拮抗反应。将最终筛选出的6 个菌株设成12 个不同的组合处理,设置情况见表3。
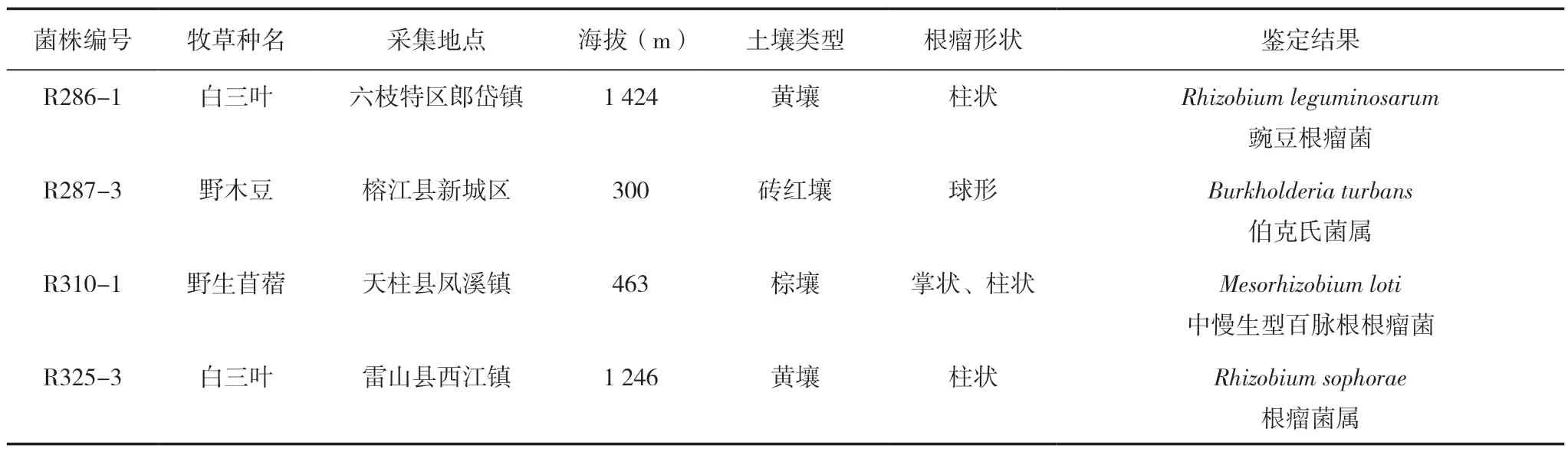
表1 根瘤菌

表2 根瘤内生细菌

表3 菌剂处理方案
2.3 促生菌株固氮酶活性分析
根瘤固氮酶活性是衡量菌种固氮能力的重要指标,也是合理施用氮肥的主要依据之一。混合菌剂和单一根瘤菌剂用YMA 液体培养测固氮酶活性,其结果有增加也有降低,其中A 号组合菌、C 号组合菌固氮酶活性显现增加趋势,A2>A1>A(CK),与A(CK)相比增加40.28%~55.02%(P<0.01),C1>C2=C(CK),C1 与C(CK)相比增加8.96%(P<0.01);B 号组合菌株和D 号组合菌株都显现下降趋势,与相应对照B(CK)、D(CK)相比差异达极显著水平(P<0.01),但组合菌株固氮酶活性都在156.79 ~211.15 IU/L 之间;组合菌株固氮酶活性由大至小为C1>C2> A2>D2>A1>D1>B1>B2,1 号细菌是从A 号根瘤菌中分离出来,2 号细菌是从B 号根瘤菌中分离出来,但固氮酶活性出现的最大值不是相对应的根瘤菌株中,而是与其他组合菌株,可见,虽然是同一根瘤源获得的细菌和根瘤菌,但不一定是最佳组合菌剂,所以用于生产还必须进行筛选试验,从固氮酶活性来看,最佳组合菌株为C1、C2、A2 这3 个组合菌种(图1)。
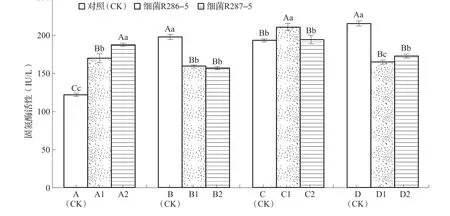
图1 不同组合菌剂的固氮酶活性
2.4 促生菌溶磷量分析
磷是植株体内重要的元素,根瘤生物固氮和保持固氮酶活性比无结瘤植株生长需更多的磷[12]。根瘤菌内分离出的两株内生细菌都具有溶磷性,溶磷量不高,与根瘤菌结合后B1>1(CK R286-5),D2>2(CK R286-7),分别与对应CK 相比增加162.78%、26.89%,D1、A2 与相应对照CK 差异不显著,其他组合都比原内生细菌的溶磷量低;菌株溶磷后其pH 值都有所下降,pH 值都为酸性,可见,内生细菌与根瘤菌组合不都是提高可溶性磷含量,也有降低其可溶性磷含量,因菌种本身也需要吸收磷元素供自身繁殖生长,组合菌株中B1、D2、A2 是最佳组合(表4)。
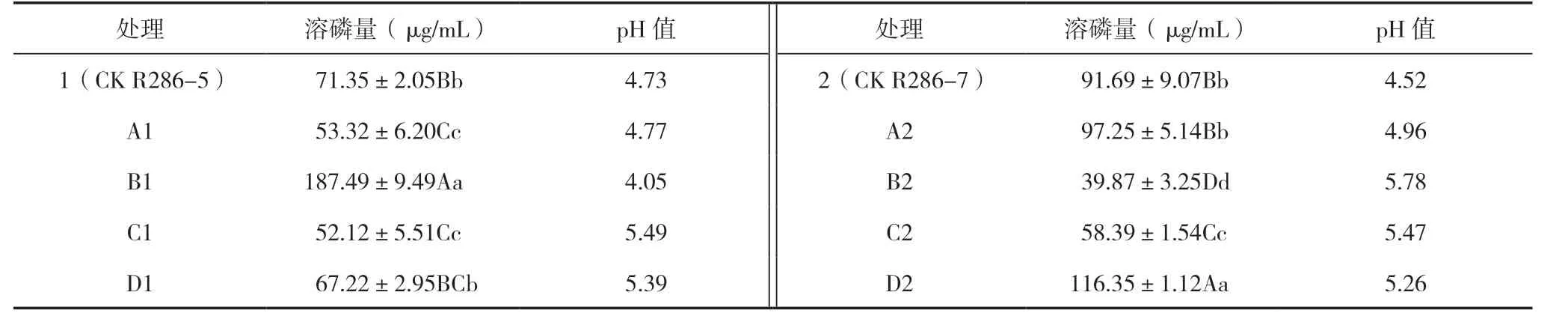
表4 菌种溶磷量
2.5 促生菌对大豆地上部分的影响
测定不同菌株组合对大豆地上部分的促生效果,发现单一的根瘤菌株对大豆的鲜重、干重、茎粗、株高的促生效果不同,其中A 号菌株与其它3 个根瘤菌株相比对大豆的鲜重、干重、株高促生效果都是最大,仅有茎粗略低于其它菌株;在根瘤菌种加入内生细菌组合后,茎粗A1、A2 与A(CK)相比增加22.39%、19.31%,差异显著(P<0.05),A1、A2株高与A(CK)相比下降26.7%、37.9%,差异显著(P<0.01),鲜重和干重比A(CK)有所降低但差异不显著;B1、B2 比B(CK)干重增加5.5%、11.8%,B2 差异显著(P<0.05),B2 茎粗高于B(CK),增加8.7%(P<0.01),B1 略低于B(CK)但差异不显著,B1、B2 株高与B(CK)相比降低了5.4%、16.6%,B2 差异显著(P<0.01);C1、C2 株高与C(CK)相比,C1 增加25.8%(P<0.01),C2 降低15.3%(P<0.01),C1、C2 茎粗高于C(CK),增加10.2%、3.5%,C1差异明显(P<0.05),鲜重和干重与C(CK)相比略有增加但无差异;D1、D2 干重与D(CK)相比增加10.7%、12.7%,差异显著(P<0.01),D1 茎粗高于D(CK),增加6.7%(P<0.01),D2 茎粗与D(CK)无差异,D1、D2 株高都低于D(CK),分别降低8.0%、4.4%,D1 差异显著(P<0.05)。 A1 组合为同一植株分离而获的内生细菌,但组合菌株没有A(CK)对大豆植株的促生效果好,仅有茎粗大于A(CK);B2组合也为同一植株分离而获的内生细菌,其对大豆的鲜重、干重和茎粗的促生效果强于B(CK)。综合地上部分干重、茎粗来看,B2、C1、D2 这3 个组合是对大豆生长匹配较佳的组合菌剂(表5)。

表5 促生菌对大豆地上部分的影响
2.6 促生菌对大豆根系特性及根瘤数的影响
植株的根能吸收土壤中的水分、无机盐,并且具有支持、繁殖、贮存合成有机物质的作用,促生菌对大豆都有一定促生效果,其对根系的促生效果要强于地上部分;A1、A2 根鲜重与A(CK)相比增加39.8%、18.4%,差异显著(P<0.01),根干重和根长A1 与A(CK)相比分别增加20.8%(P<0.01)、24.9%(P<0.05),根干重和根长A2 与A(CK)差异不明显,根瘤菌数A2>A1>A(CK)差异达显著水平(P<0.01);B 组合菌种促生效果,B1 的根系鲜重、干重优于B(CK),增加14.2%、25%(P<0.01),根长优于B(CK)但差异不显著,B2 根长优于B(CK),增加31.5%(P<0.05),根干重略高于B(CK)但差异不明显,根瘤菌数B2>B1>B(CK),B2、B1与B(CK)差异达显著水平(P<0.01);C2、C1 组合的根系鲜重优于C(CK),增加16.9%、19.9%(P<0.01),C1、C2 根长与C(CK)相比增加8.6%、25.0%,C2 差异显著(P<0.05),C1 差异不明显;D 组合的根瘤数D1>D2,优于D(CK)(P<0.01),根系鲜、干重与D(CK)差异不明显,D2 处理对大豆根长的促生作用低于D(CK),差异显著(P<0.05)。可见,筛选出的这两株内生细菌都能促进根瘤菌与大豆结合形成根瘤,大多数组合菌剂对大豆的根系鲜重、干重、根长都有促生效果,但内生细菌与不同的根瘤菌组合对植株的促生效果不同,虽然内生细菌与根瘤菌组合没有专一性,但其组合存在最佳性;综合根干重、根长和有效根瘤数来看,A2、B1、C1、D1 为最佳组合菌种(表6)。
2.7 促生菌处理对大豆品质的影响
根据施用不同组合菌液处理对大豆营养品质的变化,组合菌株对大豆粗蛋白的影响与相对应的对照(CK)相比差异达极显著水平(P<0.01),根瘤菌与1 号、2 号菌株组合对大豆的粗蛋白含量都显现升高趋势,2 号组合最显著,与相应CK 相比增加7.8%~13.1%;植株全磷含量A2 与A(CK)相比增加5.4%(P<0.05),B2 比B(CK)增加17.4%(P<0.05),B1 与B(CK)相当,其余都低于对照,与相对应的对照相比下降4.6%~18.2%(P<0.05);大豆植株全钙含量仅有D1 组合比D(CK)显著降低11.3%(P<0.01),其他组合都比相对应的对照(CK)高1.4%~20.8%(P<0.01),组合中A2>A1,B1>B2,C1>C2,D2>D1;动物的消化率与中性洗涤纤维和酸性洗涤纤维有关,也是衡量牧草营养价值的重要指标。组合菌剂处理的植株中性洗涤纤维有增加的趋势,酸性洗涤纤维有降低的趋势,其可消化纤维素A2、C1、C2、D2 与相对应的CK 相比分别增加31.04%、31.28%、27.02%、10.78%,差异显著(P<0.05),A1、B1、B2、D1 与相应CK 相比分别降低12.57%、35.15%、2.05%、4.61%,从大豆品质来看,A2、B2、D2、C1 这4 个组合处理最佳(表7)。
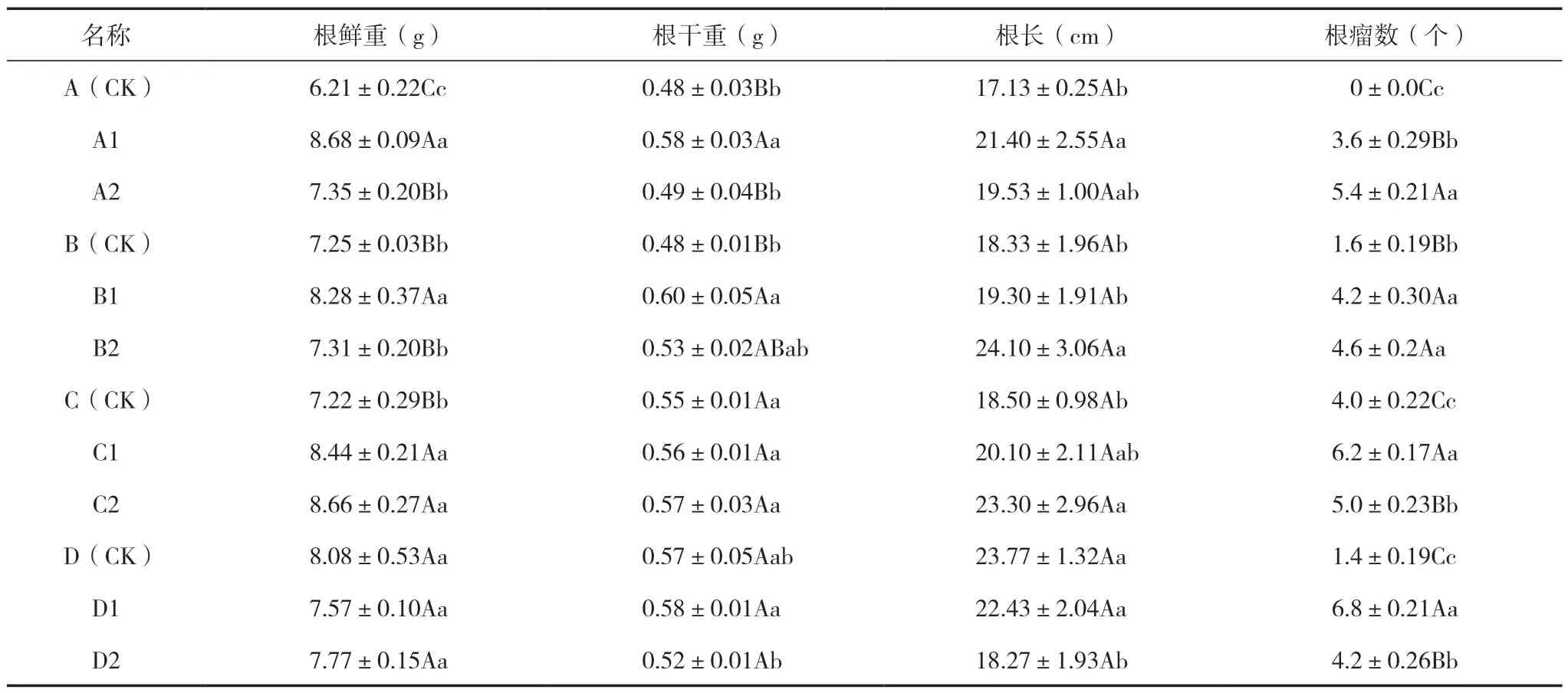
表6 促生菌对大豆根系特性及根瘤数的影响
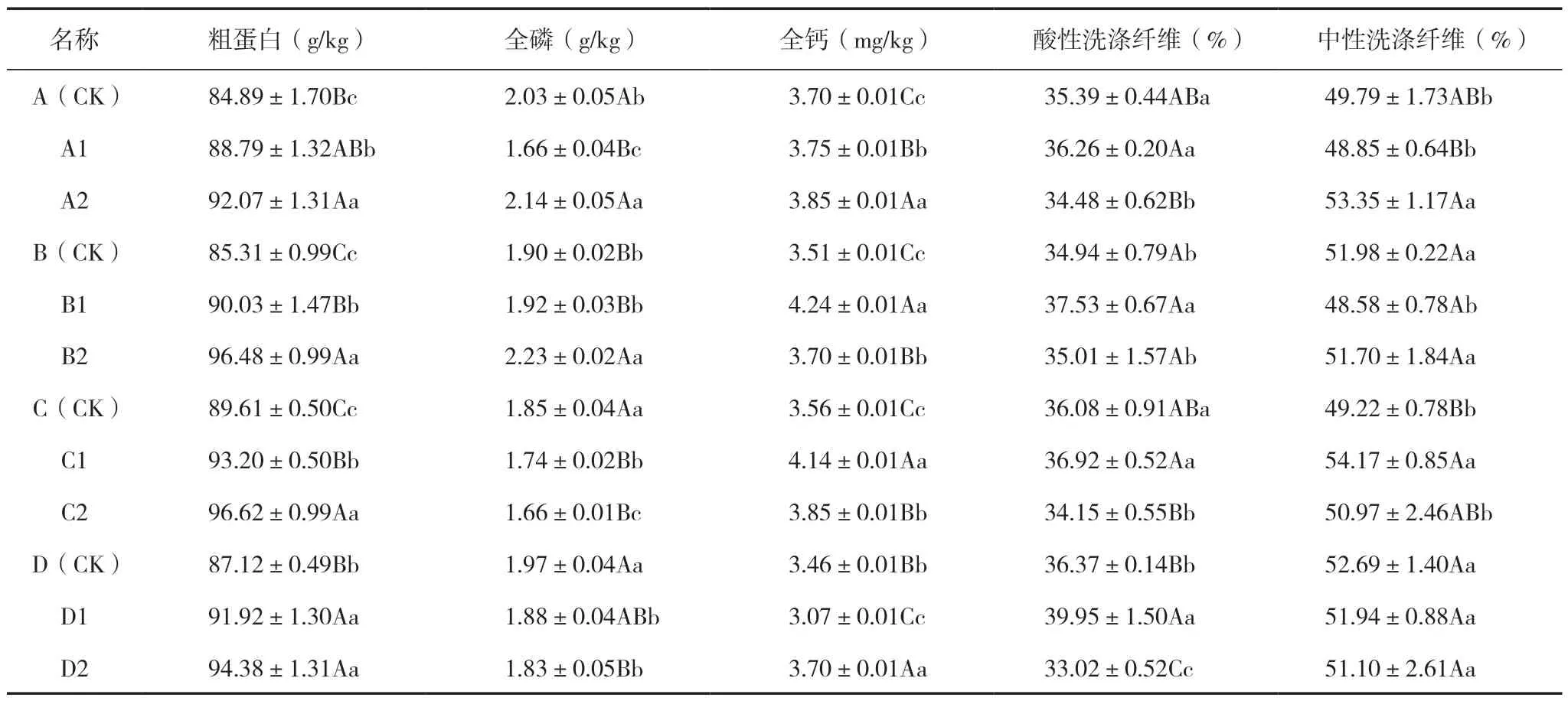
表7 促生菌处理对大豆品质的影响
3 讨论
氮元素的供应量与大豆干物质的累积有着密切的关系,只有植株的氮水平含量高,才能获得较高的干物质积累,为大豆高产打下基础[20]。韩文星等[21]报道利用不同菌株组合替代磷肥可显著提高燕麦的蛋白质,降低纤维含量。本试验用内生细菌与根瘤菌组合后所有组合的大豆粗蛋白含量都比相应CK 有所增加并且达极显著差异(P<0.01),地上部分干物质积累大多数都是呈增加趋势,与对应的CK 相比差异显著,地下部分根系干重大多显增加趋势,仅有D2 略低于D(CK),但无明显差异;供试菌剂用液体YMA 培养3~4 d 后测其固氮酶活性,显现固氮酶活性与对照处理有增加也有降低,其中A 组合的固氮酶活性含量与大豆粗蛋白(CP)含量呈相同趋势,但B、C、D 组合的固氮酶活性与大豆CP 含量不成正比,如固氮酶活性D(CK)>D2>D1,B(CK)>B1=B2,C1>C2=C(CK),大豆CP 含量D2>D1>D(CK),B2>B1>B(CK),C2>C1>C(CK),所以不能仅仅用固氮酶活性的高低来确定根瘤菌的固氮能力,还必须综合考虑根瘤数、地上部分干重、环境因子和大豆根系的分泌物与细菌互作共生的影响[22]。
土壤中许多细菌都具有将难溶性磷转化为游离态磷供植株吸收的作用[23]。研究表明两株内生细菌都有溶磷性,溶磷量不高,与根瘤菌组合后仅有B1、D2、A2,3 个组合菌剂溶磷量增大,其他组合溶磷量降低,而大豆的全磷含量却与水培钼锑抗比色法所测得溶磷结果有所差异,如组合菌剂的溶磷量B1>B2、D2>D1 差异显著(P<0.01),大豆的全磷含量为B2>B1,增加16.1%,差异显著(P<0.01),D1>D2,增加 2.73%差异不显著(P>0.05),粗蛋白含量B2>B1,增加7.16%,差异显著(P<0.01),D2>D1 增加 2.68%,差异不显著(P>0.05),可能是作物氮元素含量的增加能促进磷元素的吸收[24],但磷元素的增加对氮的吸收有一定的抑制作用[25-26],或者是根系的分泌物对菌剂溶磷作用有一定的影响,其原因还需下一步深入研究。
组合菌剂比单一根瘤菌剂对大豆幼苗的地上部分干重、茎粗、根系干重、根长、根瘤数、全氮、钙含量,都有不同程度的促进作用。综合产量和营养成份来看,内生细菌+根瘤菌剂具有“1+1>2”的良好互作效应,这种加成效应与韩华雯等[27]不同促生菌肥对紫花苜蓿产量和品质的影响、和马文彬等[28]促生菌在箭舌豌豆上生长的研究结果一致。并且已有研究表明,溶磷芽孢杆菌和根瘤菌组合能够促进植株的生长发育,刺激根瘤菌的结瘤和种群数量[29],溶磷菌接种到苜蓿,提高植物磷含量,具有结瘤、固氮作用,还明显增加茎粗、干重、茎叶比[30];可见,菌种间、菌剂与植株间存在着互作共生的关系,同时根瘤菌还存在适应性分化,将导致菌株在固氮效果、共生匹配性和不同生境下的竞争优势产生差异[9],只有深入研究促生菌的作用机理,筛选具有叠加效应的菌株组合,才能发挥菌肥增质、保产、修复与平衡环境的作用[29]。
4 结论
根瘤中大量非结瘤内生细菌的存在是一个普遍的客观现象,并且表现出极大的丰富多样性[6]。但根瘤菌与内生细菌的定殖同时受到宿主植物的控制,植物能够选择性的调控根瘤菌与内生细菌去占据共生根瘤这个特殊的微生态位[31]。利用根瘤共生技术促进生态恢复,需接种适应当地生境的根瘤菌与内生细菌来保证共生体系的正常形成和最佳效益的有效发挥[31]。所以有必要进行筛选试验,并开展大田试验测定菌株在环境因子影响下,根瘤菌与内生细菌的促生能力,以便开发具有多功能的促生菌肥。本研究中B2、C1、D2 组合菌剂对大豆地上生物量、茎粗的促进效果最佳,A2、B1、C1、D1 组合对根系生物量、根长和有效根瘤数的促进作用较明显。增施内生细菌后,综合对植株粗蛋白质、钙含量、可消化纤维素含量的影响,分析认为应用生产潜力最大的4 个菌组为A2、B2、C1、D2。
