枯草芽孢杆菌S6抗棉花枯萎病菌拮抗蛋白的分离纯化与抑菌活性研究
2020-09-02李丽程煜袁建琴
李丽 程煜 袁建琴


摘 要:为了探寻枯草芽孢杆菌S6菌中对棉花枯萎病菌有拮抗作用的蛋白,将S6菌进行液体发酵培养,初步提取得到了粗蛋白提取液。粗提液经硫酸铵沉淀、Sephadex G-50脱盐、Sephadex G-100凝胶层析、DEAE-52纤维素离子交换层析,得到了对棉花枯萎病菌有高效拮抗作用的蛋白质,纯化倍数达17。形成分离纯化S6菌株的棉花枯萎病菌拮抗蛋白的可靠技术路线,为研究和生产防治棉花枯萎病菌的生物制剂提供了理论基础。
关键词:棉花枯萎病;拮抗蛋白;分离纯化;芽孢杆菌
中图分类号:S476 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.06.002
Abstract: In order to study the protein of the bacterial strain (S6) which was identified as bacillus could antagonistic against cotton fusarium wilts efficiently, S6 bacteria was cultured by liquid fermentation, and crude protein extract was obtained by preliminary extraction. The crude extract was purified by ammonium sulfate precipitation, Sephadex G-50 desalting, Sephadex G-100 gel chromatography, DEAE-52 cellulose ion exchange chromatography, the protein with high antagonistic effect on cotton fusarium wilt was obtained, and the purification multiple reached 17 times. The reliable technical route for separating and purifying cotton fusarium wilt antagonistic protein of S6 strain was formed,which provided a theoretical basis for the research and production of biological agents for controlling cotton fusarium wilt.
Key words: cotton fusarium wilt; antagonistic protein; isolation and purification; bacillus
棉花枯萎病菌由尖孢镰刀菌萎蔫专化型(Fusarium oxysporum f.sp.vasinfectum)引起,它们使棉花萎蔫致死,且极难防治,造成的经济损失也最惨重[1-3]。抗病育种由于高抗种质资源缺乏,育种方法单一等原因,致使育种工作进展缓慢[2];化学药剂防治效果差,还会加重环境污染,可形成抗逆性很强的微菌核[4]。因此,开辟新的防病措施已成为当务之急,而生物防治以其无毒无害等优点给棉花枯萎病的防治带来了新的希望[5]。枯萎病生防细菌中比较有前途的种类是嗜麦芽糖寡养单胞菌(Stenotrophomonas maltophila)[6]、枯草芽孢杆菌(Bacillus subtilis)[7-9]、荧光假单胞杆菌(Pseudomonas fluorescens)[10]等。抗菌蛋白的分离提取和研究,是以不同分离提纯技术的组合形成的分离方案为基础的。现行的蛋白分离技术主要有以下几种:硫酸铵沉淀法、凝胶色谱法、离子交换层析法、SDS-PAGE法、高效液相色谱法等。
本研究利用传统研究技术与现代微生物技术结合从土壤中筛选到有自主知识产权的高效拮抗菌株枯草芽孢杆菌S6菌,采用分子生物学手段分离纯化对棉花枯萎病菌有拮抗作用的蛋白质,目的是形成分离纯化该蛋白的技术路线,为其应用于微生物农药,有效防治枯萎病提供理论依据和应用基础。
1 材料和方法
1.1 试验材料
1.1.1 菌株 尖孢镰刀菌(F. oxysporum) ,由中国农科院简桂良教授惠赠;枯草芽孢杆菌(B.subtilis)S6由中国农业科学院研究生院生物化学与分子生物学实验室自主筛选,从湖南、广西、北京等地采集辣椒、黄瓜、烟草等根际周围土样中自主筛选。
1.1.2 培养基[11] LB(Luria-Bertani)培养基:培养S6菌;PDA(Potato Dextrose Agar)培养基:培养棉花枯萎病菌株,测定抗菌活性。
1.2 试验方法
1.2.1 S6菌的活化与指标平板的制作 S6菌用划线法涂布于LB培养基活化,培养过夜,挑取单菌落划平板,再次活化,放入4 ℃冰箱备用。挑取枯萎病菌单菌落,用划线分别法接种于PDA固体培养基,培养24 h,挑取枯萎病菌接于PDA液体培养基,28 ℃以200 r·min-1在摇床培养24 h,用纱布过滤后,取含孢子的培养液稀释0.5 mL,均匀涂布于刚凝固的PDA固体培养基,于28 ℃恒温培养箱中培养过夜,然后放入4 ℃冰箱备用。
1.2.2 粗蛋白的提取、分级沉淀与拮抗活性验证[12]将S6菌接种于LB液体培养基中,28 ℃摇床培养36 h。收集发酵液分装于200 mL离心管8 000 r·min-1离心10 min去除菌体,取上清即为蛋白粗提液。粗提液中缓慢加入粉末状硫酸铵使其饱和度达40%,于4 ℃冰箱中静置30 min,后10 000 r·min-1離心15 min,分离上清液,沉淀溶于5 mL 0.05 mol·L-1、pH 值7.2的磷酸缓冲液中,即为40%硫酸铵沉淀蛋白粗提液。取上一步离心后的上清液,加入硫酸铵使饱和度达到70%,按同样方法处理,即得到70%硫酸铵沉淀蛋白粗提液。用同样方法处理,即可得到100%硫酸铵沉淀蛋白粗提液。接不同浓度的硫酸铵沉淀蛋白粗提液于PDA平板,在PDA平板上将枯萎病菌接种于平板中央,28 ℃培养24 h在菌丝周围打孔,将待测的活性物质注入孔内,每孔约200 μL,28 ℃下再培养,观察抑菌状况及抑菌圈大小,重复3次。蛋白活性(mm2·mg-1)=抑菌圈面积/蛋白含量[13-14]。1.2.3 拮抗蛋白的纯化 (1)Sephadex G-50除盐。将预处理过的Sephadex G-50用0.05 mol·L-1的磷酸缓冲液(pH值 7.2)平衡后装柱(26 mm×300 mm),上样量6 mL,再用同样磷酸缓冲液洗脱,流速为50 mL·h-1,洗脱液分部收集,绘制洗脱曲线。收集洗脱峰,用钠氏试剂检测无盐,装入透析袋中用聚乙二醇6 000浓缩至6 mL左右。
(2)Sephadex G-100分离蛋白。将预处理过的Sephadex G-100用同样的磷酸缓冲液平衡后装柱,上样量6 mL,用同样的磷酸缓冲液洗脱,流速为50 mL·h-1,洗脱液分部收集,绘制洗脱曲线。用钠氏试剂检测各洗脱峰为无盐,分别装入透析袋中用聚乙二醇6 000浓缩至5 mL左右。
(3)DEAE-52纤维素纯化蛋白。将经过凝胶过滤的经平板检验有活性的蛋白液加入离子交换柱,用含0.1~0.6 mol·L-1 NaCl的0.05 mol·L-1 pH值为7.2的磷酸缓冲液进行梯度洗脱,流速为50 mL·h-1,洗脱液分部收集,绘制洗脱曲线。用钠氏试剂检测各洗脱峰为无盐,分别装入透析袋中用聚乙二醇6 000浓缩至5 mL左右。
(4)用平板打孔法测定各合并管拮抗活性,保留具有拮抗活性的峰管。留存250 μL样品作为试验对照。
2 结果与分析
2.1 分级沉淀粗蛋白的拮抗活性对比
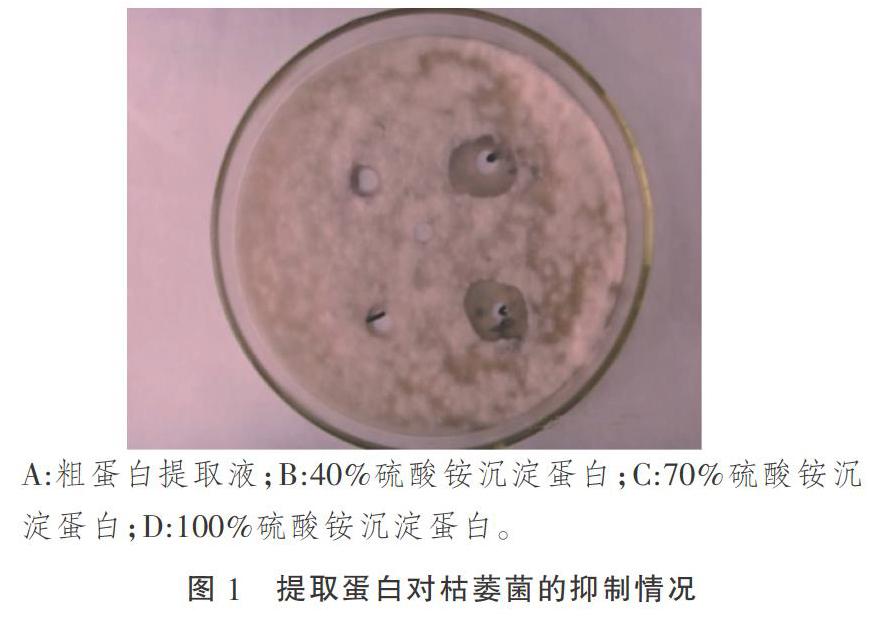
对粗蛋白进行分级沉淀,粗蛋白液、40%沉淀蛋白、70%沉淀蛋白、100%沉淀蛋白质量浓度分别为12.65,51.12,26.25,8.83 g·L-1。把它们分别接于棉花枯萎病菌指示平板中,对照为pH值为7.2的0.05 mol·L-1的磷酸缓冲液,观察抑菌情况(图1)。
根据抑菌结果,分别测定了抑菌圈直径并计算了各抑菌圈的蛋白活性(表1)。结果显示:粗蛋白提取液以及3种盐析蛋白均有抑菌活性,100%硫酸铵沉淀蛋白的棉花枯萎病菌的抑菌圈最小,蛋白活性最弱;70%硫酸铵沉淀蛋白作用的棉花枯萎病菌的抑菌圈最大,蛋白活性也最强;40%硫酸铵沉淀蛋白的棉花枯萎病菌有较好抑制作用,但不如70%硫酸铵沉淀蛋白作用明显。由此可知,70%硫酸铵沉淀蛋白粗提液抑制效果最佳,可作为下一步研究对象。
2.2 Sephadex G-50除盐
选经70%硫酸铵盐析的S6菌的蛋白,经Sephadex G-50层析脱盐,280 nm检测,得到1个峰形陡的蛋白峰(图2)。
2.3 Sephadex G-100分离蛋白并检测活性
脱盐后的蛋白再用Sephadex G-100分离纯化,得到2个峰(图3),收集体积分别为12 mL和60 mL,浓缩为5 mL左右,峰一蛋白的质量浓度1.01 g·L-1、峰二蛋白的质量浓度3.21 g·L-1。用打孔法检测拮抗性,观察抑菌情况(图4)。
根据抑菌结果,分别测定了抑菌圈直径并计算了各抑菌圈的蛋白活性(表2)。
由图4与表2可知,G-100纯化后的峰一蛋白与峰二蛋白对棉花枯萎病菌有拮抗活性,但峰二蛋白的抑制现象更为明显,蛋白活性提高到11.74 mm2·mg-1,可作为进一步纯化对象。
2.4 DEAE-52纤维素纯化蛋白并检测活性
用DEAE-52纤维素分离纯化经Sephadex G-100分离后的峰二蛋白,得到2个洗脱峰,其洗脱体积分别为36 mL、20 mL,用PEG 6 000浓缩至5 mL,蛋白质量浓度分别为1.20 g·L-1、0.81 g·L-1。
用打孔法检测拮抗性,观察抑菌情况(图5)。根据抑菌结果,分别测定了抑菌圈直径并计算了各抑菌圈的蛋白活性(表3)。
经DEAE纯化后峰一蛋白对棉花枯萎菌拮抗作用较强,蛋白活性提高到了21.58 mm2·mg-1。由此可知,初步得到了棉花枯萎病菌的拮抗蛋白(图5、表3)。
2.5 纯化效率
为了了解纯化效率,计算了每一步的纯化倍数(表4)。
从S6菌产生的粗蛋白对枯萎菌的蛋白活性为1.25,而经过硫酸铵分段沉淀、G100、DEAE分离纯化后蛋白活性提高到了21.58 mm2·mg-1。纯化倍数达到了17倍。说明我们经过一系列的分离纯化得到了较纯的对棉花枯萎菌有拮抗活性的蛋白,也说明我们的设计方案是可行的。该方案可用于拮抗枯萎菌蛋白的分离纯化(表4)。
3 结论与讨论
随着对生态环境保护意识的提高,可以大规模生产的无毒、不破坏环境、已经成为防治棉花枯萎病菌等病虫害的主要方法之一。齐东梅等[15]从土贝母和腊肠等中药和发酵食品中筛选出对棉花枯萎病菌有广谱拮抗作用的芽孢杆菌29株,经初步鉴定为枯草芽孢杆菌和地衣芽孢杆菌。孙瑶等[16]从根际土壤中分离到对棉花枯萎病菌具有强烈拮抗细菌BDT-25,经生理生化特征的鉴定证明为枯草芽孢杆菌(Bacillus subtilis)。李术娜等[17]从棉花叶部组织中分离出LC-04菌株,实验证明菌株发酵液中含有对大丽轮枝菌有拮抗活性的蛋白质类抗菌物质,经鉴定也是一株类芽孢杆菌。郝华昆等[18]分离得到对棉花枯萎病原真菌具有强烈抑制作用的菌株B110,经鉴定也为枯草芽孢杆菌(Bacillus subtilis)。本研究采用从湖南、广西、北京等地采集的辣椒、黄瓜、烟草等根际周围土样中自主筛选的对枯萎病菌都有一定拮抗作用的S6菌,经过检测确定为芽孢杆菌。由此可知,芽孢杆菌普遍对枯萎病菌有一定的拮抗作用。
杜红方[19]通过硫酸铵的分级沉淀、DEAE-Sephadex A-50與Sepharyl S-100,从LC105菌株的发酵液中得到了一种对棉花黄萎病菌具有拮抗作用的抗菌蛋白。胡明[20]确定硫酸铵分级沉淀在40%~60%范围内,经过DEAE弱阴离子交换柱,并采用pH值 6.0的MES样品缓冲液,用0~l mol·L-1的NaCI线性洗脱。再采用Sephacryl S-100凝胶的分子筛层析方法进行分离,经SDS-PAGE电泳检测结果显示获得了一个纯的蛋白组分。
本研究利用硫酸铵沉淀法初步分离了活性蛋白,而后采用凝胶层析和离子交换层析法进行分离纯化,拮抗棉花枯萎病菌的蛋白活性从最初的1.25 mm2·mg-1提高到了21.58 mm2·mg-1,纯化倍数达17.2倍。说明本文采取的技术方法是合理的,可以用于S6菌中棉花枯萎病菌拮抗蛋白的分离提取。但所得蛋白是否单一还不得而知,要进一步深入研究,需要采用更高级的分离技术,从而得到对棉花枯萎病菌的拮抗活性的特异蛋白。
参考文献:
[1]石磊岩,简桂良,孙文姬,等.我国棉花黄萎病研究现状与方向[J].植物保护学报,1998,25(2):103-107.
[2]马存,简桂良,孙文姬.我国棉花抗黄萎病育种现状、问题及对策[J].中国农业科学,1997,30(2):58-64.
[3]陈旭生,陈永萱,黄骏麒.棉花黄萎病菌鉴定技术进展[J].棉花学报,1997,9(2):64-67.
[4]WANG X,LIANG G.Control efficacy of an endophytic Bacillus amyloliquefaciens strain BZ6-1 against peanut bacterial wilt,Ralstonia solanacearum[J].BioMed research international,2014,12: 1-11.
[5]崔鄭龙,柴秀娟,孔德真,等.棉花枯萎病菌拮抗内生菌的筛选和拮抗效果检测[J].江苏农业科学,2016,44(2):158-163.
[6]BERG G,BALLIN G.Bacterial antagonists to verticillium dahliae kleb[J].Journal of phytopathology,1994,141:99-110.
[7]PODILE A R,PRASAD G S,DUBE H C.BACILLS SUBTILIS as antagonist vascular with pathogens[J].Current science,1985,54:864-865.
[8]SAFIYAZOV J S,SATTAROVA R K.The use of bacterial antagonist for control of cotton disease[J]. Field crops reseach,1995,43:51-54.
[9]于杰,张荣意,谭志琼,等,枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J].基因组学与应用生物学,2016,35(3):629-634.
[10]LEBEN S D,WADI J A.Effects of pseudomonas fluorsecens on potato plant growth and control of verticillium dahliae[J]. Phytopathology,1987,77:1592-1295.
[11]李湘民,华菊玲,宋爱芝.棉花苗期病害拮抗菌的筛选[J].江西农业学报,1994,6(2):118-121.
[12]童有仁,马志超,陈卫良,等. 枯草芽孢杆菌B 034拮抗蛋白的分离纯化及特性分析[J].微生物学报,1999,39(4):339-343.
[13]游春平,肖爱萍,魏金莲,等,稻瘟病拮抗细菌的活性研究[J].江西农业大学学报,2002,24(1):24-26.
[14]KEL,EMU S,BADEL J L.In vitro inhibition of colletotrichum gloesporiodies and other phytopathagenic fungi by an Amazoniam isolate of bacillus and its cell-free culture filtrate Aust[J].Plant pathol,1994,23(1)41-45.
[15]齐东梅,梁启美,惠明,等.棉花枯萎、黄萎病拮抗芽孢杆菌的抗菌蛋白特性[J].微生物学通报,2005(4):42-46.
[16]孙瑶,马平,朱宝成,等.棉花黄萎菌拮抗菌BDT_25的鉴定及抗菌蛋白产生条件研究[J].华北农学报,2006,21(6):119-123.
[17]李术娜,杜红方,袁洪水,等.棉花黄萎病拮抗细菌LC-04菌株的抗菌蛋白产生条件研究[J].棉花学报,2006,18(4):233-23.
[18]郝华昆,韩俊华,李为民,等.棉花黄、枯萎病拮抗菌株B110的鉴定及其抑菌作用方式[J].植物保护,2007,33(2):77-80.
[19]杜红方.棉花黄萎病拮抗细菌的筛选与抗菌蛋白的分离纯化[D].保定:河北大学,2003.
[20]胡明.棉花黄萎病抗菌蛋白的分离纯化及其部分性质的研究[D].保定:河北大学,2003.
