火龙果节律钟输出基因HpGI的克隆与表达分析
2020-09-02肖图舰马玉华袁启凤解璞毛永亚严佳文廖仕琴
肖图舰 马玉华 袁启凤 解璞 毛永亚 严佳文 廖仕琴

摘 要:節律钟输出基因GIGANTEA通过光周期途径促进植物开花,为研究火龙果GIGANTEA同源基因功能,应用RT-PCR克隆获得该基因的开放阅读框序列,命名为Hylocereus polyrhizus GIGANTEA(HpGI),GenBank登录号为MK609546。序列分析结果表明,HpGI开放阅读框长度为3537 bp,编码1178个氨基酸。系统进化分析显示,HpGI与甜菜BvGI、菠菜SoGI、丝石竹GpGI的分子进化距离较近。预测HpGI定位于细胞核,无信号肽和跨膜螺旋结构域,属于非分泌蛋白。基因表达分析结果表明,HpGI基因在茎和花芽中的表达量显著高于茎芽、果皮和根;相比对照,延长光周期处理8 d时,其表达量显著上调。推测HpGI基因可能通过光周期途径促进火龙果开花。
关键词:火龙果;GIGANTEA同源基因;克隆;表达分析中图分类号:S59; S813.3 文献标识码:A
Molecular Cloning and Expression Analysis of Rhythms Clock Output GeneHpGI from Hylocereus polyrhizus
XIAO Tujian1, MA Yuhua1, YUAN Qifeng1, XIE Pu1, MAO Yongya1, YAN Jiawen1*, LIAO Shiqin2
1. Institute of Pomology, Guizhou Academy of Agricultural Sciences, Guiyang, Guizhou 550006, China; 2. Fruit Industry Development Office of Luodian County, Luodian, Guizhou 550100, China
Abstract: Rhythms clock output geneGIGANTEApromotes flowering via the photoperiod pathway. To analysis the function ofGIGANTEAhomologous gene in pitaya [Hylocereus polyrhizus (Weber) Britton & Rose], the open reading frame (ORF) sequence was cloned through RT-PCR. The ORF ofHylocereus polyrhizus GIGANTEA(HpGI) is 3537 bp, encoding 1178 amino acids, and the GenBank accession number is MK609546. The phylogenetic analysis showed that HpGI andBeta vulgarisGIGANTEA are the closest in molecular evolution distance, followed bySpinacia oleraceaGIGANTEA andGypsophilapaniculateGIGANTEA. It was speculated that HpGI was located in the nucleus, and it was a non-secretory protein. No signal peptide and transmembrane helix domain were found. The results of quantitative RT-PCR revealed that the expression level ofHpGI gene in the stem and flower bud was significantly higher than that in the stem bud, peel and root. Moreover, the transcription of theHpGIgene was significantly induced by the 8 d night-breaking treatment, compared to the untreated samples. It was deduced thatHpGImay promote flowering via the photoperiod pathway in pitaya.
Keywords: Hylocereus polyrhizus;GIGANTEA homologous gene; cloning; gene expression
DOI: 10.3969/j.issn.1000-2561.2020.07.003
火龙果(Hylocereusspp.)是典型的长日照植物,其中红肉类型的临界日照时长为12 h[1]。在北半球地区,火龙果的自然花期为5—10月[2],采用人工补光方式延长光周期可诱导火龙果在非自然产期开花,实现周年生产[2]。在温度适宜、植株无花果负载的情况下,持续补光15~45 d即可诱导红肉类型火龙果的花芽形成和发育[3-4],火龙果成花与光照时间密切相关。
植物成花受自身遗传因子和外界环境因素的共同影响,光周期是主要成花途径之一[5-6]。植物节律钟输出基因GIGANTEA(GI)是光周期途徑调控开花的关键基因之一[7],通过应答光周期信号进而调控CONSTANS(CO)和flowering locus T(FT)等开花促进基因[8-9]。在长日照条件下,拟南芥(Arabidopsis thaliana)GI基因突变体开花时间延迟[10],而超表达GI能让拟南芥提早开花[11]。长日照单子叶模式植物二穗短柄草(Brachypo-dium distachyon)的GI同源基因表达产物也能促进开花[12]。应用基因转化技术将BoGI反义链导入甘蓝(Brassica oleracea)后,其花期明显推迟[13],说明BoGI行使促进成花功能。GI同源基因在上述长日照植物中具有功能保守性,而在水稻(Oryzasativa)、大豆(Glycine max)和牵牛花(Pharbitis nil)等短日照植物中的作用却不尽相同。超表达OsGI在长、短日照情况下均导致水稻延迟开花[14-15];在牵牛花中过表达PnGI同样可以延迟花期[16],而大豆GmGI能与FKF1/FKF2蛋白互作而促进开花[17]。GI及其同源基因的功能在不同日照类型的植物中存在一定的差异。国内外关于火龙果光周期途径调控成花的研究报道较少,鉴定火龙果GI同源基因并分析其功能具有重要意义。
本研究以自交亲和型火龙果新品系黔蜜龙为试验材料,克隆获得了GI同源基因编码区的cDNA序列并进行了结构、系统进化和表达模式分析,以期为进一步研究火龙果GI同源基因功能奠定基础,为基于延长光周期的火龙果产期调控技术提供理论依据。
1 材料与方法
1.1 材料
以黔蜜龙火龙果[Hylocereuspolyrhizus(Weber)Britton & Rose]为材料,在农业农村部火龙果种质资源保护贵州创新基地(25°21′18′′~ 25°21′27′′N,105°46′14′′~105°46′36′′E)进行补光处理,具体参考严佳文等[18]的方法。采集处理1、8、15、21 d和相应对照2年生向阳面结果枝刺座周围约1 cm2见方的肉质茎,以及自然条件下生长的火龙果根、茎、茎芽、花芽和果皮(花谢后10 d)。所有样本采集时间均为15:00时左右,3次生物学重复,液氮速冻后保存在?80 ℃超低温冰箱备用。
1.2方法
1.2.1 RNA提取及cDNA合成 采用TRIzol试剂提取火龙果总RNA,具体方法参照试剂说明书(Invitrogen,美国)。用NanoDrop 2000检测总RNA的浓度和纯度,Agilent 2100测定RNA完整性。选取RIN值≥7.0、OD260/280≥1.8、OD260/230≥1.5的总RNA用于cDNA合成,具体方法参照逆转录试剂盒说明书(Promega,M1701,美国)。
1.2.2 基因克隆和测序 根据前期获得的uni-gene序列,应用Primer 5.0软件设计GI同源基因的扩增引物,引物信息见表1。PCR反应体系为20 μL,包含10×PCR buffer 2.0 μL、10 mmol/L的dNTPs 2 μL、2.5 μmol/L的引物HpGI-F、HpGI-R各2 μL,TaqDNA聚合酶(TaKaRa,RR02MQ,大连)1 U,cDNA 2 μL,去离子水补充体积至20 μL。PCR反应程序为:94 ℃预变性4 min;94 ℃变性30 s,58 ℃复性45 s,72 ℃延伸4 min,35次循环;最后72 ℃延伸10 min。PCR产物以1%琼脂糖凝胶电泳检测并以胶回收试剂盒(Trans-Gen Biotech,北京)进行纯化。回收片段采用pMD18-T克隆试剂盒(TaKaRa,大连)进行TA克隆,随机选取5个阳性克隆送上海生工生物工程技术服务有限公司进行测序,应用NCBI数据库中的ORF finder程序(https://www.ncbi.nlm. nih.gov/orffinder/)预测目的基因的开放阅读框(open reading frame,ORF)并获得氨基酸序列。
1.2.3 序列分析和系统进化树的构建 应用ProtParam(https://web.expasy.org/protparam/)预测蛋白分子量、等电点和疏水性。应用Predict-Protein(https://www.predictprotein.org/)在线工具进行蛋白质二级结构预测。应用PSORT在线工具(http://www.psort.hgc.jp/)、TMHMM Serverv. 2.0(http://www.cbs.dtu. dk/services/TMHMM/)和SignalP Serverv.3.0(http://www.cbs.dtu.dk/services/ SignalP-3.0/)分别进行亚细胞定位分析、跨膜螺旋区预测和信号肽预测。应用蛋白质结构域分析程序SMART(http://www.smart.embl.de/)预测其功能结构域。在NCBI數据库中下载已报道的其他植物的GI蛋白序列,应用MEGA7.0软件进行GI蛋白的系统发育分析。采用ClustalW进行多序列比对,设置自展值为1000,以Neighbor Joining法构建系统进化树。
1.2.4 定量RT-PCR分析 根据火龙果HpGI基因序列,应用Primer 5.0软件设计定量RT-PCR引物,引物信息见表1。应用BIO-RAD CFX Connect?荧光定量PCR仪分析HpGI的相对表达量。定量RT-PCR反应体系为20 ?L,具体参照定量PCR试剂盒(Applied Biosystems? Cat: 4367659)说明书。内参基因引物、定量RT-PCR程序和数据计算、统计方法均参考严佳文等[18]的方法。试验设置生物学重复、技术重复各3次。
2 结果与分析
2.1HpGI基因克隆
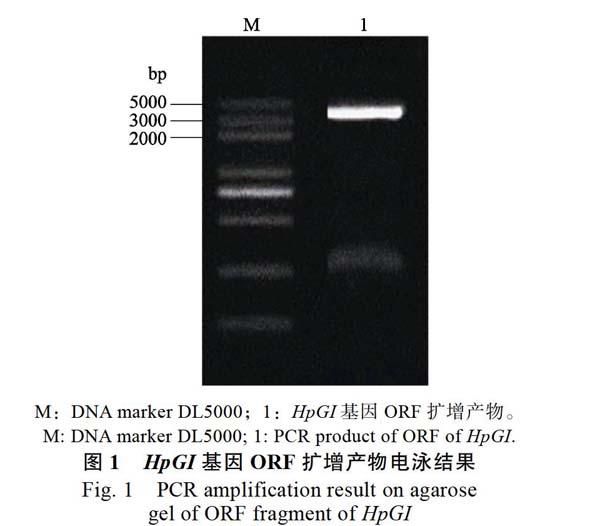
以cDNA为模板,应用引物HpGI-F、HpGI-R扩增GI同源基因序列。凝胶电泳结果显示,扩增产物大小与预期的3686 bp接近(图1)。测序得到的碱基序列与前期获得的unigene序列仅有2个碱基差异,一致性为99.95%。应用ORF finder预测ORF长度为3537 bp,将该GI同源基因序列命名为HpGI,GenBank登录号为MK609546。
2.2HpGI基因生物信息学分析
2.2.1HpGI编码蛋白理化性质分析HpGI编码1178个氨基酸组成的蛋白,分子量为129.196 kDa,等电点6.45,带负电荷的氨基酸(Asp+Glu)数量为124,带正电荷的氨基酸(Arg+Lys)数量为115,不稳定指数50.69,平均疏水性值为?0.072,属于亲水性蛋白。亚细胞定位和信号肽预测结果显示,该蛋白定位于细胞核内,没有信号肽输出位点,也没有线粒体靶向肽和叶绿体转运肽,属于非分泌蛋白。跨膜结构预测结果显示,该蛋白无跨膜螺旋区,这一预测结果与其定位于细胞核内相符。
2.2.2HpGI编码蛋白结构和进化树分析 将HpGI编码的氨基酸序列与甜菜(Beta vulgaris)、拟南芥(Arabidopsis thaliana)、水稻(Oryzasativa)和玉米(Zea mays)这几个代表性物种的GI同源蛋白进行序列比对,与BvGI的一致性高达85.41%,与AtGI、OsGI和ZmGI一致性分别为72.51%、69.09%和68.78%(图2),HpGI与以上4种植物GI蛋白均存在保守的氨基酸残基(图2黑色背景部分)。二级结构预测结果表明HpGI的α-螺旋、β-折叠和无规则卷曲分别占比50.9%、4.8%和44.3%。
为进一步明确HpGI与其他植物GI同源蛋白之间的亲缘关系,构建了HpGI与甜菜(Beta vulgaris,Bv)、菠菜(Spinacia oleracea,So)、丝石竹(Gypsophilapaniculata,Gp)、大樱桃(Prunus avium,Pa)、葡萄(Vitisvinifera,Vv)、桃(Prunus persica,Pp)、甘蓝(Brassica oleracea,Bo)、枣(Ziziphus jujuba,Zj)、大豆(Glycine max,Gm)、枇杷(Eriobotryajaponica,Ej)、番薯(Ipomoea batatas,Ib)、番荔枝(Annona squamosa,As)、菊花(Chrysanthemum morifolium,Cm)、黑麦草(Lo-lium perenne,Lp)、拟南芥(Arabidopsis thaliana,At)、水稻(Oryzasativa,Os)、玉米(Zea mays,Zm)和苜蓿(Medicago truncatula,Mt)的GI同源蛋白的系统进化树。结果显示,18种GI同源蛋白分成双子叶亚族和单子叶植物亚族,HpGI与拟南芥等同属于双子叶植物亚组(图3)。HpGI与甜菜BvGI(XP 010681268.1)的分子进化距离最近,其次是菠菜SoGI(XP 021849292.1)和丝石竹GpGI(BAW15106.1)。通过系统进化分析,进一步说明HpGI是节律钟输出基因GI的同源基因。
2.3HpGI表达分析
应用定量RT-PCR分析了HpGI基因在火龙果不同组织和光照处理材料中的表达情况。HpGI在根、茎、茎芽、花芽和果皮中均表达,其中茎和花芽中的表达量显著高于茎芽和果皮(P< 0.05),根中的表达量最低(图4)。光照处理1 d时,HpGI表达量与对照无显著差异;处理8 d时,
其表达量(11.94±3.26)显著高于处理1 d(2.20± 0.24)和对照(2.14±0.48)(P<0.05);处理15和21 d时,其表达量恢复到1 d时的水平,而各对照样品中的表达量无显著差异(图5)。
3讨论
GI基因最初从拟南芥中克隆,编码含有1173个氨基酸的蛋白[7]。近年来,研究者们从其他植物中克隆到GI同源基因所编码蛋白大小存在一定的差异。黑麦草LpGI(CAY26028.1)最小,含1148个氨基酸,而枣ZjGI(XP_015886353.1)含有1181个氨基酸。本研究克隆的火龙果GI同源基因开放阅读框序列为3537 bp,编码1178个氨基酸,大小与拟南芥AtGI(NP_564180.1)和枣ZjGI更接近。亚细胞定位预测结果表明,火龙果HpGI(MK609546.1)既没有信号肽输出位点和跨膜螺旋区,也没有线粒体靶向肽和叶绿体转运肽,定位于细胞核,属于非分泌蛋白,这与菊花[19]、甘蓝型油菜(Brassica napus)[20]、番荔枝[21]和番薯[22]等植物中的研究结果一致。HpGI与其他GI同源蛋白的序列比对结果显示,HpGI与甜菜BvGI的一致性高达85.41%,与拟南芥、水稻和玉米的GI蛋白一致性分别为72.51%、69.09%和68.78%,且存在多处高保守性的氨基酸残基。系统进化分析结果表明,HpGI与AtGI、BvGI等同属于双子叶植物亚族。以上结果表明,HpGI是节律钟输出基因GI的同源基因。
在光周期途径调控植物开花的过程中,GI基因感受和响应光敏色素和生物节律钟信号进而调控下游开花相关基因的转录水平[7-9]。HpGI基因在火龙果的根、茎、茎芽、花芽和果皮中均有表达,但在茎、花芽中的表达量显著高于其他组织,在根中的表达量最低。前人研究表明:甘蓝型油菜BnGI在不同组织中表达情况为分生组织>茎>叶>花蕾>果实>根[20];番荔枝AsGI在叶片、花蕾中的表达量高于顶芽和果实[21]。HpGI与BnGI、AsGI的表达模式较为一致,这可能是因为叶(茎)和花是感受光周期和响应生物节律信号更为敏感的部位。人工补光处理8 d后,HpGI在火龙果茎中的表达量显著高于对照和处理1 d时,而对照中的表达量始终无显著变化。短日照植物菊花暗处理13 d后,CmGI表达量显著上调[19]。采用补光措施延长长日照植物的光周期,或者采用遮光措施缩短短日照植物的光周期,均能诱导GI同源基因的表达量上调而促进开花。综上所述,HpGI基因可能在延长光周期而诱导火龙果成花的过程中发挥作用。
本研究克隆了火龙果GI同源基因,命名为HpGI。通过生物信息学、组织特异性和延长光周期后的基因表达分析,初步研究了该基因表达产物的理化性质、进化关系及其对光周期的响应特征,为进一步阐释其功能奠定了基础。后续研究拟将HpGI基因导入拟南芥GI突变体,验证其功能。此外,通过分析与之互作或受其调控的光周期途径成花相关基因的表达模式,从分子水平揭示HpGI的作用机制。
参考文献
- Jiang Y L, Liao Y Y, Lin T S, et al. The photoperiod regulated bud formation of red pitaya (Hylocereus sp.)[J]. American Society for Horticultural Science, 2012, 47(8): 1063-1067.
- Jiang Y L, Liao Y Y, Lin M T, et al. Bud development in response to night-breaking treatment in the non-inductiveperiod in red pitaya (Hylocereus sp.)[J]. American Society for Horticultural Science, 2016, 51(6): 690-696.
- 许 明, 翁武斌. 台湾常见火龙果产期调节技术[J]. 福建农业科技, 2015(12): 24-26.
- 赖瑞云, 张雪芹, 林建忠, 等. 補光对大棚火龙果冬季促花的影响[J]. 亚热带植物科学, 2018, 47(3): 286-288.
- Golembeski G S, Kinmonth-Schultz H A, Song Y H, et al. Photoperiodic flowering regulation in Arabidopsis thaliana[J]. Advances in Botanical Research, 2014, 72: 1-28.
- 帅敏敏, 黄有军. 光周期途径成花关键基因GIGANTEA和CONSTANS的研究进展[J]. 分子植物育种, 2018, 16(17): 5601-5607.
- Park D H, Somers D E, Kim Y S, et al. Control of circadian rhythms and photoperiodic flowering by the Arabidopsis GIGANTEA gene[J]. Science, 1999, 285(5433): 1579-1582.
- Sawa M, Nusinow D A, Kay S A, et al. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis[J]. Science, 2007, 318(5848): 261-265.
- Sawa M, Kay S A. GIGANTEA directly activates flowering locus T in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(28): 11698-11703.
- Fowler S, Lee K, Onouchi H, et al. GIGANTEA: A circadian clock-controlled gene that regulates photoperiodic flowering in Arabidopsis and encodes a protein with several possible membrane-spanning domains[J]. The EMBO Journal, 1999, 18(17): 4679-4688.
- Mizoguchi T, Wright L, Fujiwara S, et al. Distinct roles of GIGANTEA in promoting flowering and regulating circadian rhythms in Arabidopsis[J]. The Plant Cell, 2005, 17(8): 2255-2270.
- Dunford R P, Griffiths S, Christodoulou V, et al. Characterisation of a barley (Hordeum vulgare L.) homologue of the Arabidopsis flowering time regulator GIGANTEA[J]. Theoretical and Applied Genetics, 2005, 110(5): 925-931.
- Thiruvengadam M, Shih C F, Yang C H. Expression of an antisense Brassica oleracea GIGANTEA (BoGI) gene in transgenic broccoli causes delayed flowering, leaf senescence, and post-harvest yellowing retardation[J]. Plant Molecular Biology Reporter, 2015, 33(5): 1499-1509.
- Hayama R, Izawa T, Shimamoto K. Isolation of rice genes possibly involved in the photoperiodic control of flowering by a fluorescent differential display method[J]. Plant and Cell Physiology, 2002, 43(5): 494-504.
- Hayama R, Yokoi S, Tamaki S, et al. Adaptation of photoperiodic control pathways produces short-day flowering in rice[J]. Nature, 2003, 422(6933): 719-722.
[16] Higuchi Y, Sage-Ono K, Sasaki R,et al. Constitutive expression of theGIGANTEAortholog affects circadian rhythms and suppresses one-shot induction of flowering inPharbitisnil, a typical short-day plant[J]. Plant and Cell Physiology, 2011, 52(4): 638-650.
- Li F, Zhang X M, Hu R B, et al. Identification and molecular characterization of FKF1 and GI homologous genes in soybean[J]. PLoS One, 2013, 8(11): e79036.
- 严佳文, 解 璞, 袁启凤, 等. 火龙果开花调控转录因子基因HpSOC1的克隆與表达分析[J]. 植物生理学报, 2018, 54(10): 1561-1568.
- 孙 霞, 王秀峰, 郑成淑, 等. 菊花节律钟输出基因CmGI (GIGANTEA)的cDNA 全长克隆、序列信息及定量表达分析[J]. 中国农业科学, 2012, 45(13): 2690-2703.
- 周晓晨, 韩洪强, 陈火英, 等. 甘蓝型油菜生物节律钟输出基因BnGI的克隆和表达分析[J]. 上海交通大学学报(农业科学版), 2014, 32(5): 5-11.
- 刘锴栋, 袁长春, 黎海利, 等. 番荔枝节律钟输出基因 AsGI的克隆、亚细胞定位与表达分析[J]. 园艺学报, 2015, 42(12): 2395-2404.
- Tang W, Yan H, Su Z X, et al. Cloning and characterization of a novel GIGANTEA gene in sweet potato[J]. Plant Physiology and Biochemistry, 2017, 116: 27-35.
