姜黄素抗肿瘤作用基础与临床研究进展
2020-09-02李玉倩李学军
李玉倩,李学军
(1.石河子大学药学院,新疆 石河子 832000;2.北京大学医学部基础医学院药理学系,北京 100191)
恶性肿瘤是世界上第二大死亡原因,也是主要的公共卫生问题之一,尽管肿瘤治疗取得了巨大进展,但恶性肿瘤的发病率和死亡率仍然很高。因此,寻求更高效、低毒的肿瘤治疗策略仍然是当前研究的重点。姜黄(turmeric)是东南亚的传统药物[1]。姜黄的主要活性成分是从其根茎中提取出来的姜黄素类化合物,包括姜黄素(curcumin,分子式为C21H20O6,相对分子质量为368.39)、去甲氧基姜黄素(demethoxycurcumin,分子式为 C20H18O5,相对分子质量为338.35)和双去甲氧基姜黄素(bisdemethoxycurcumin,分子式为C19H16O4,相对分子质量为308.33)[2]。姜黄素在姜黄中的含量高于后两者,约为77%,是姜黄发挥生物活性的最主要成分。姜黄素是一种疏水性多酚,可溶于乙醇、丙酮和二甲亚砜,具有广泛的生物和药理活性,可用于治疗肿瘤、糖尿病、炎症、神经退行性疾病、心血管疾病、代谢综合征和肝病等[3]。近年来,姜黄素因副作用较少,在抗肿瘤方面的应用受到了众多研究者的关注,其作用和机制主要包括抑制肿瘤的侵袭和迁移、诱导肿瘤细胞凋亡和抑制多种细胞信号通路等。尽管姜黄素具有良好的抗肿瘤效果,但其口服生物利用度低、在水溶液中溶解度差以及在生理条件下降解快等特点,导致临床给药很困难。本文根据姜黄素在肿瘤细胞、动物模型和临床试验等文献资料,综述姜黄素的抗肿瘤作用及其机制、姜黄素的衍生物、新型药物递送系统以及临床试验等研究进展,以期为相关领域进一步研究提供参考。
1 抗肿瘤作用
目前研究发现,姜黄素对膀胱癌、乳腺癌、肺癌、前列腺癌、宫颈癌、卵巢癌和皮肤癌等多种恶性肿瘤具有抑癌作用[4]。GUNEY等[5]研究表明,姜黄素抑制乳腺癌MCF-7和MDA-MB-231细胞的增殖和转移。SUN等[6]研究发现,姜黄素可抑制胃癌SGC-7901细胞的增殖、迁移和侵袭。BACHMEIER等[7]将人乳腺癌MDA-MB-231细胞注射到裸小鼠的乳腺中,给予姜黄素后发现,姜黄素能显著抑制肿瘤向肺转移。ZHANG等[8]发现,给小鼠腹腔注射姜黄素可抑制皮下移植RN5恶性间皮瘤细胞的生长。
姜黄素联合化疗药物可增强化疗药物抗肿瘤疗效。姜黄素与5-氟尿嘧啶联用,增强了结直肠癌HCT1163细胞对5-氟尿嘧啶的敏感性,并降低5-氟尿嘧啶诱导的耐药性[9]。姜黄素与多柔比星(阿霉素)联用,降低了霍奇金淋巴瘤L-540细胞的增殖[10]。LIU等[11]在裸小鼠腋下注射人前列腺癌PC3细胞,发现顺铂联合姜黄素给药后,肿瘤体积明显小于顺铂和姜黄素单独给药组。XU等[12]将Lewis肺癌细胞接种到C57BL/6小鼠,经紫杉醇脂质体联合姜黄素给药,发现紫杉醇联合姜黄素雾化吸入后抑制肿瘤增殖作用最强,且可提高荷瘤小鼠的存活率。
2 抗肿瘤作用机制
2.1 调节芳香烃受体活化
许多致癌物需要通过细胞色素P450(cytochromeP450,CYP)等Ⅰ相解毒酶进行生物转化才能破坏DNA或其他细胞分子。早期的研究表明,姜黄素调节芳香烃受体(aryl hydrocarbon receptor,AhR)及CYP450酶[13]。CHOI等[14]报道,姜黄素通过产生氧化应激诱导AhR降解并降低CYP1A1和CYP1B1的表达。姜黄素抑制苯并芘(benzo[a]pyrene,B[a]P)诱导的AhR激活、核易位和DNA的结合,降低CYP1A的转录激活,继而降低CYP1A1/1A2酶活性[15]。然而,RINALDI等[16]报道,姜黄素促进AhR核易位,增加CYP1A1和CYP1B1在多种细胞中的表达。另一项研究也显示,姜黄素介导AhR激活,随后CYP1A1活性增加[17]。由于姜黄素在调节AhR和CYP酶方面的相互矛盾的结果,其对AhR的活化作用尚有待进一步研究。
2.2 诱导核因子2相关因子(NF-E2-related factor2,Nrf2)活化
Ⅱ相解毒酶,如血红素氧合酶-1、UDP-葡萄糖醛酸转移酶、谷胱甘肽硫转移酶(glutathione S-transferase,GST)和醌氧化还原酶〔NAD(P)H:quinone oxidoreductase 1,NQOR〕等可抑制肿瘤生长。编码这些酶的基因含有抗氧化反应元件(antioxidant response element,ARE),该元件受Nrf2的严格调控,Nrf2是细胞预防化学/氧化应激的重要调节因子之一。Nrf2与抑癌蛋白Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein1,Keap1)相关。Keap1除抗肿瘤还可促进Nrf2的降解[18]。姜黄素可破坏Nrf2-Keap1复合物,使Nrf2转位至细胞核,在细胞核中结合ARE,激活Ⅱ相酶的表达[19]。DAS等[20]将Daltons淋巴瘤细胞移植入小鼠腹部,发现姜黄素显著诱导Nrf2的活化和核易位而增强Ⅱ相抗氧化酶GST和NQO1的活性,抑制肿瘤生长。
2.3 促进肿瘤细胞凋亡和自噬
凋亡是抑制肿瘤生长的最有效途径之一。姜黄素介导P27、P53、胱天蛋白酶3和胱天蛋白酶1水平升高使细胞凋亡。ZHOU等[21]报道,姜黄素增加胱天蛋白酶3和9的表达,促进人乳腺癌MCF-7细胞的凋亡。姜黄素亦可抑制霍奇金淋巴瘤细胞NF-κB和信号转录与激活因子3(signal transducer and activator of transcription 3,STAT3),降低细胞增殖相关蛋白Bcl-2、Bcl-xl、细胞型FLICE样抑制蛋白(cellular FLICE-like inhibitory protein)、X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)、凋亡抑制蛋白1(inhibitor of apoptosis protein 1)、生存素蛋白、c-Myc和细胞周期蛋白D1(cyclin D1)的表达,促进细胞凋亡[22]。线粒体膜电位限制细胞凋亡,而姜黄素可诱导线粒体膜电位下降,使胱天蛋白酶活性增加,促进细胞凋亡。在一项对人非小细胞肺癌NCI-H460细胞的研究中,姜黄素降低细胞线粒体膜电位,上调Bax、Bad、胱天蛋白酶3、胱天蛋白酶8和活性氧(reactive oxygen species,ROS)水平,下调Bcl-2,Bcl-xl和XIAP而促进细胞凋亡[23]。我们的研究亦表明,姜黄素及其衍生物双去甲氧基姜黄素能抑制移植的肺癌和胰腺癌的生长和转移,主要通过葡萄糖调节蛋白78依赖的通路和线粒体功能障碍促进细胞凋亡,并协同吉西他滨对人胰腺癌细胞产生抗肿瘤作用[24]。
除凋亡外,自噬对于维持细胞一致性也很重要。姜黄素可通过Beclin-1依赖和独立于Beclin-1途径促进肿瘤细胞自噬。JIA等[25]报道,姜黄素上调Beclin-1蛋白水平及自噬相关轻链蛋白3-Ⅱ(light chain-Ⅱ,LC3-Ⅱ)促进人髓性白血病K562细胞发生自噬。KIM等[26]研究表明,姜黄素促进空泡的形成和LC3-Ⅰ向LC3-Ⅱ的转化,诱导口腔鳞状肿瘤细胞自噬。
2.4 抑制细胞周期
姜黄素下调细胞周期蛋白A、细胞周期蛋白D2、细胞周期蛋白E、P21、细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 1,CDK2)、CDK4和CDK6以浓度依赖的方式在G0/G1和G2/M期抑制细胞周期。在一项对人骨肉瘤细胞的体外研究中,姜黄素可浓度和时间依赖性地下调细胞周期蛋白D1、细胞分裂周期蛋白2和细胞周期蛋白B1,抑制G1/S和G2/M期[27];姜黄素也可浓度依赖性地上调细胞周期蛋白D、细胞周期蛋白E、CDK2、P19、P21和P27Kip1,使人乳腺癌MCF-7细胞停滞于G1期[21]。
2.5 抑制NF- κB激活
NF-κB控制着与肿瘤相关的大量细胞信号转导途径。在肿瘤形成过程中,功能活跃的NF-κB被称为核因子IκB抑制因子(inhibitor of nuclear factor kappa B,IκB)的抑制蛋白保持无活性。不同的细胞外刺激导致IκB激酶磷酸化和泛素化或通过蛋白酶快速降解,得到的游离NF-κB位于细胞核中,在细胞核中的特定启动子区域,NF-κB与多种基因如细胞因子、促炎分子、生长因子、细胞黏附分子和肿瘤基因结合并使其激活;而姜黄素可抑制NF-κB表达[28]。研究表明,NF-κB激活肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、IL-8、STAT3、环氧化酶 2(cyclooxygenase-2,COX-2)、Bcl-2、基质金属蛋白酶和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,从而刺激ROS,产生慢性炎症,引起肿瘤生长[29];而姜黄素可通过抑制NF-κB和Wnt/β途径阻止宫颈癌HeLa细胞增殖和侵袭[30]。
2.6 调节微RNA(micro RNA,miRNA)和高迁移率族蛋白1(high-mobility group box-1,HMGB1)表达
miRNA是含18~25个核苷酸的单链非编码内源性分子,参与转录后基因表达的调节,致癌和抑癌基因miRNA的改变通常与肿瘤进展改变有关。姜黄素下调致癌miRNA如miR-27a,miR-21,miR-20a,miR-17-5p和miR-34a的表达[31],上调抗癌miRNA如 miR-15a/16-1,miR-22,miR-145,miR-203 和let-7a的表达,促进肿瘤细胞凋亡[32]。而HMGB1可结合不同的细胞表面受体,如Toll样受体2(Toll-like receptor 2,TLR2)、TLR4和晚期糖基化终产物受体作用于靶细胞并促进炎症及肿瘤进展[33]。AFRIN等[34]研究表明,姜黄素通过降低HMGB1和NF-κB的核易位可抑制小鼠非酒精脂肪性肝炎向肝癌的进展。DA等[35]报道,姜黄素通过抑制HMGB1和VEGF-D的表达抑制胃癌细胞向淋巴管转移。
2.7 激活沉默信息调节家族蛋白
沉默信息调节因子2(silent information regulator2,SIRT2)蛋白家族,称为sirtuins,是进化保守的NAD+依赖性去乙酰化酶。已知哺乳动物中sirtuins调节几种不同的功能如细胞重编程,这是癌变的关键因素。而姜黄素可调节sirtuins表达,其介导的SIRT1活化具有神经保护作用。姜黄素在头颈部鳞状肿瘤细胞移植小鼠中通过上调SIRT1而发挥抗肿瘤作用[36]。
2.8 抑制肿瘤血管生成及相关生长因子
细胞和动物水平实验研究显示姜黄素通过下调VEGF、血管生成素1(angiopoietin-1,Ang-1)、Ang-2、PDGF、COX-2、低氧诱导因子1α(hypoxia inducing factor-1α,HIF-1α)、转化生长因子 β1(transfonning growth factor-β1,TGF-β1)和碱性成纤维细胞生长因子(basic nbroblast growth tactor,bFGF)的表达来抑制血管生成。它也通过抑制NF-κB、胞外信号调节激酶(extracellular-signal regulated kinases,ERK)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、蛋白激酶C(protein kinse C,PKC)、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)和基质金属蛋白酶而抑制血管生成[37]。我们研究表明,姜黄素对移植肺癌合并缺血的动物模型产生双向调节作用,发现在同一个体、同一种剂量情况下,姜黄素既促进缺血后肢血流重建,又抑制肺癌的发展、转移和血管生成,其作用机制可能是通过对缺血和肿瘤组织双向调节HIF-1α/mTOR/VEGF/VEGFR信号途径实现的。进一步采用蛋白质组学研究证,实它可以逆转由中性粒细胞弹性蛋白酶(neutrophil elastase,NE)诱导的肺癌组织血管新生,并可直接与NE结合,或通过促进α1-抗胰蛋白酶的表达而进一步产生对NE的抑制作用,提示该化合物对临床缺血合并肿瘤的治疗将可能产生有益的影响[38]。
2.9 抑制微管蛋白聚合
微管是α-和β-微管蛋白异二聚体的聚合物,是真核生物细胞骨架的重要组成部分。因为对微管动力学的干扰可阻止肿瘤细胞周期并诱导细胞凋亡,微管蛋白已成为开发抗肿瘤药物的优选靶点。用宫颈癌HeLa细胞和乳腺癌MCF-7细胞研究显示,姜黄素抑制微管蛋白聚合,促进间期和有丝分裂微管的解聚。在乳腺癌MCF-7细胞中姜黄素也可抑制微管的动态不稳定性[39]。
2.10 抗多药耐药性
一旦肿瘤细胞出现多药耐药性,就很难逆转,因为过度表达的P-糖蛋白(P-glycoprotein,P-gp)伴随着许多其他活性靶基因表达的改变。髓源白血病K562细胞长期用多柔比星处理时会导致P-gp的上调而形成获得性耐药,当用姜黄素类化合物预处理后,可显著抑制P-gp表达和NF-κB活化而抑制耐药性产生[40]。同样,SHAH等[41]用不同浓度的阿糖胞苷和姜黄素作用于从急性髓系白血病患者骨髓中获得原代白血病细胞,通过逆转录聚合酶链反应方法,观察对多药耐药(multidrug resistance,MDR)基因如MDR1、肺耐药相关蛋白(lung resistance-related protein,LRP)和乳腺癌耐药蛋白(breast cancer resistant protein,BCRP)基因的影响。结果显示,姜黄素使MDR1,LRP和BCRP的基因表达分别下降了35.75%,31.30%和27.97%,降低了阿糖胞苷细胞耐药性的产生。也有研究显示,姜黄素可通过抑制GSTP1提高长春新碱耐药结肠癌HCT-8细胞的化疗敏感性,从而逆转长春新碱耐药性[42]。
3 药物代谢
姜黄素口服主要在肝和肠中偶联形成姜黄素葡萄糖醛苷酸和硫酸盐,如四氢姜黄素葡糖醛酸苷和六氢姜黄素硫酸盐等。用3H放射性同位素标记法对姜黄素的代谢进行研究,发现大鼠灌胃姜黄素10 g·kg-1时,绝大部分姜黄素随粪便排泄,其中1/3以原形存在[43]。VAREED等[44]检测了健康人志愿者单次口服姜黄素后0.25~72 h的药动学,当姜黄素剂量为10和12 g时,对血清样品进行游离姜黄素、葡萄糖醛酸苷及其硫酸盐结合物分析。结果显示,在检测的14个时间点中,所有受试者都检测到萄糖醛酸苷与硫酸盐且比例为1.92∶1,只有1人检测到游离姜黄素,显示姜黄素口服给药后被人体吸收主要以葡萄糖醛酸苷或硫酸盐的形式存在。与其结果相似,另一项临床研究表明,健康志愿者空腹摄入2 g姜黄素粉末1 h后检测血浆中的含药量,只有不到10 μg·L-1的姜黄素原药被检测出[45],表明姜黄素肠道吸收和组织分布低且体内代谢迅速。
4 衍生物
姜黄素化学结构修饰可改变药物分子的受体结合能力和药理活性,提高姜黄素的整体抗肿瘤活性。目前已提出了几种结构修饰方法形成姜黄素的衍生物(表1),以期增强其对特定肿瘤细胞的选择性毒性和稳定性。
5 新型药物递送系统
目前研究者们正在研发多种新的姜黄素药物递送系统,如纳米颗粒、聚合物纳米球、纳米凝胶、固体分散体、脂质体、胶束、环糊精络合物和磷脂体等,以在不提高毒性的情况下提高抗肿瘤功效,提高生物利用度。
5.1 纳米颗粒
纳米颗粒是药物传递过程中的载体,可在运输过程中以持续和可控的速度输送药物,保护药物活性成分,改变组织分布和药物的清除,可用于多种给药途径,如口腔、鼻腔、静脉等,并提高药物生物利用度。如KANAI等[62]招募了6名健康志愿者口服150 mg姜黄素纳米粒,间隔2周后,同样的受试者接受了210 mg姜黄素纳米粒,使用高效液相色谱法在摄入姜黄素纳米粒后0,1,2,4,6 和24 h测量血浆中姜黄素含量。结果显示,在150 mg和210 mg时,姜黄素纳米粒的最大浓度分别为(189±48)μg·L-1和(275±67)μg·L-1,大大提高了姜黄素的生物利用度。
5.2 聚合物纳米球
可生物降解的合成聚合物如聚右旋乳酸-羟基乙酸共聚物〔poly(lactide-co-glycolide),PLGA〕和天然聚合物如丝素蛋白和壳聚糖已广泛用于药物递送。研究表明,大鼠ig给予PLGA-姜黄素,在预防血脑屏障破坏和抑制炎症细胞因子、趋化因子受体3(CXC-chemokine receptor 3,CXCR 3)及其配体10(CXC-chemokine ligand 10,CXCL10)中的作用至少是天然姜黄素的15倍,同时增加抗炎因子IL-10。在同等浓度下,单剂量口服PLGA-姜黄素比天然姜黄素在抑制血清γ干扰素和提高IL-10水平方面更有效。单次口服含350 μg姜黄素的PLGA-姜黄素5 mg,血中姜黄素达到的浓度比用5 mg天然姜黄素获得的浓度高3~4倍,并延长了姜黄素在大脑中的存留时间[63]。PUNFA等[64]研究发现,与游离姜黄素相比,PLGA-姜黄素纳米粒子在多药耐药宫颈癌细胞中抑制P-gp的作用更强,但PLGA-姜黄素的细胞毒性更强。
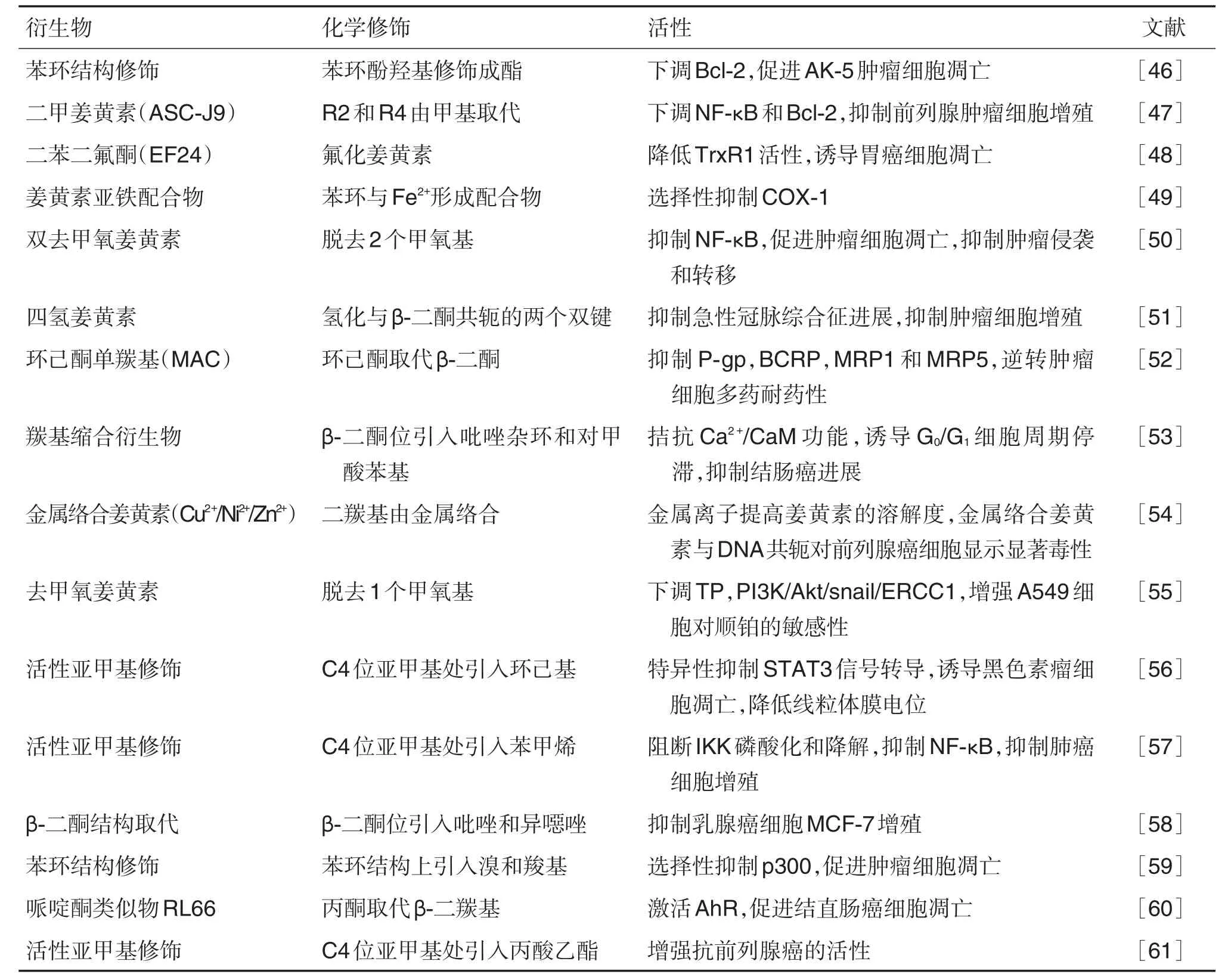
表1 姜黄素结构修饰衍生物
5.3 纳米凝胶
甲壳素是一种非常通用的药物负载材料。负载姜黄素的甲壳素纳米凝胶已被用作治疗皮肤癌的透皮系统,研究显示,与姜黄素溶液相比,甲壳素纳米凝胶稳态透皮通量是姜黄素溶液的4倍,对人皮肤黑素瘤(A375)有特异性毒性[65]。
5.4 固体分散体
固体分散体的药物递送方法已成为高效递送有一定疗效但水溶性差的抗癌药物的手段。一项大鼠实验发现,姜黄素自胶束固体分散体经胃生物利用度是游离姜黄素的19倍,且以浓度依赖的方式增加姜黄素对人成胶质细胞瘤U-87MG细胞和乳腺癌MCF-7细胞的毒性[66]。CHEN等[67]报道,姜黄素聚维酮固体分散体(Cur-K30)抑制小鼠多种肿瘤细胞增殖,抑瘤率高于同剂量姜黄素混悬液灌胃组,灌胃Cur-K30对小鼠肝癌H22细胞移植瘤、小鼠黑色素瘤B16细胞移植瘤和裸鼠人结肠癌SW480细胞移植瘤的抑制率分别为43.2%,53.1%和59.8%,下调了瘤组织中VEGF的表达而抑制肿瘤血管生成。
5.5 胶束
聚合物胶束是改善疏水性药物的水性制剂,延长药物在体内的循环时间,提高细胞摄取率,靶向肿瘤区域。YANG等[68]制备了可注射的姜黄素胶束,在小鼠结肠肿瘤模型中皮下注射给药。体内研究证实,姜黄素胶束比游离姜黄素有更强的抗癌作用。体外研究表明,姜黄素胶束通过诱导细胞凋亡和增加细胞摄取抑制结肠肿瘤细胞CT26的生长。TIMA等[69]比较了游离姜黄素和FLT3特异性姜黄素胶束对白血病MV411细胞的作用。结果显示,姜黄素胶束提高了MV411细胞对姜黄素的摄取速率,并在细胞周期的G0/G1期阻滞MV411细胞,显示出更强的细胞毒性作用。
5.6 脂质体
脂质体由磷脂双层壳和水核组成,是包裹疏水和亲水化合物的理想载体。姜黄素脂质体,尽管包封率低(45%),该制剂的细胞毒性在各种细胞系如人肝癌细胞HepG2、肺癌细胞A549、结直肠癌细胞HT29和宫颈癌细胞中显示出比姜黄素高20倍[70]。
5.7 磷脂体
KHATK等[71]合成了姜黄素-磷脂复合物,提高了姜黄素的水溶性和脂溶性。在体外人乳腺癌MCF7细胞中发现,姜黄素-磷脂复合物抗肿瘤效果显著。毒性研究发现,在相当于姜黄素在2 g·kg-1的剂量下,姜黄素-磷脂复合物是无毒的。急性和亚急性毒性研究表明,该制剂口服安全,一系列遗传毒性研究表明,其无遗传毒性,各种毒理学评价表明其在动物模型中短期和长期给药的口服安全。LIU等[72]对姜黄素-磷脂复合物-近红外染料(CUR/IR780@SMEDDS)进行研究,通过光热和光动力评估、细胞毒性、侵入和转移4T1乳腺癌细胞的体外迁移、大鼠体内口服生物利用度研究和荷瘤裸鼠药效学研究来评估抗乳腺癌转移的功效。结果显示,与姜黄素和IR780混悬液相比,CUR/IR780@SMEDDS提高了姜黄素和IR780在大鼠体内的经胃生物利用度。CUR/IR780@SMEDDS在体外表现出显著的光动力效应。在转移性4T1乳腺癌细胞中,CUR/IR780@SMEDDS结合局部近红外激光照射可诱导细胞毒性,并抑制4T1细胞的侵袭和迁移。在原位移植4T1乳腺癌细胞荷瘤裸鼠中,经胃CUR/IR780@SMEDDS与局部近红外激光照射相结合抑制了肿瘤的进展和肺转移。
5.8 环糊精络合物
环糊精是由亲水性外层和亲脂性核心组成的环状寡糖。在药物递送过程中,环糊精络合物可增加药物溶解度、生物利用度且改善负载药物的稳定性。与游离姜黄素相比,肿瘤细胞对环糊精-姜黄素(CD5,CD10,CD20和CD30)包合物的摄取显著增加。PURPURA等[73]通过对12名健康志愿者参与的双盲交叉研究,测定了口服12 h后的不同时间姜黄素的血浆浓度,比较了新型γ-环糊精姜黄素制剂、姜黄素和姜黄精油的生物利用度。结果显示,γ-环糊精姜黄素制剂相对生物利用度最高。另一项研究发现,姜黄素-环糊精复合物对肺癌有互补的治疗作用,将这些复合物灌胃给予原位植入肺部肿瘤的小鼠,可提高姜黄素的生物利用度,并显著减小肿瘤体积[74]。
6 临床试验
除在细胞或动物模型水平上进行研究外,已进行了若干临床研究,以评估姜黄素在不同类型的肿瘤患者中单独或与其他治疗方法联用治疗的有效性与安全性。已完成的临床研究试验汇总见表2[47,75],目前在www.clinicaltrials.gov注册的正在进行的姜黄素抗肿瘤临床试验汇总见表3。
以上结果显示,姜黄素的临床试验仍处于初步阶段,并且少量临床试验表明姜黄素抗肿瘤疗效差,但大部分已完成的临床试验和个案报告报道的结果显示姜黄素对不同恶性肿瘤患者的治疗具有安全性和有效性,其中姜黄素抗肿瘤效应最有前景的是姜黄素联合其他抗肿瘤化疗药物或使用新型药物递送方式,而未来还需要更多完整的临床试验来证实姜黄素抗肿瘤的疗效及用法用量。
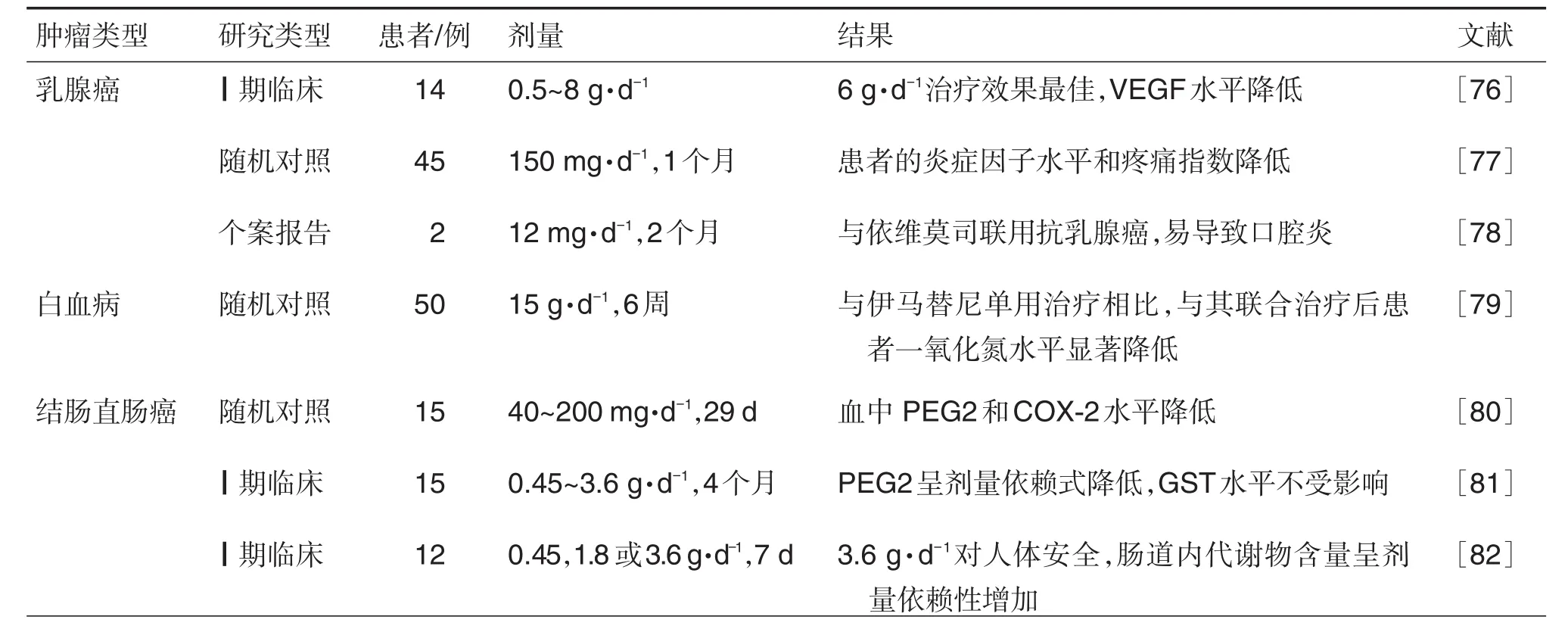
表2 已完成的姜黄素临床研究试验

续表2
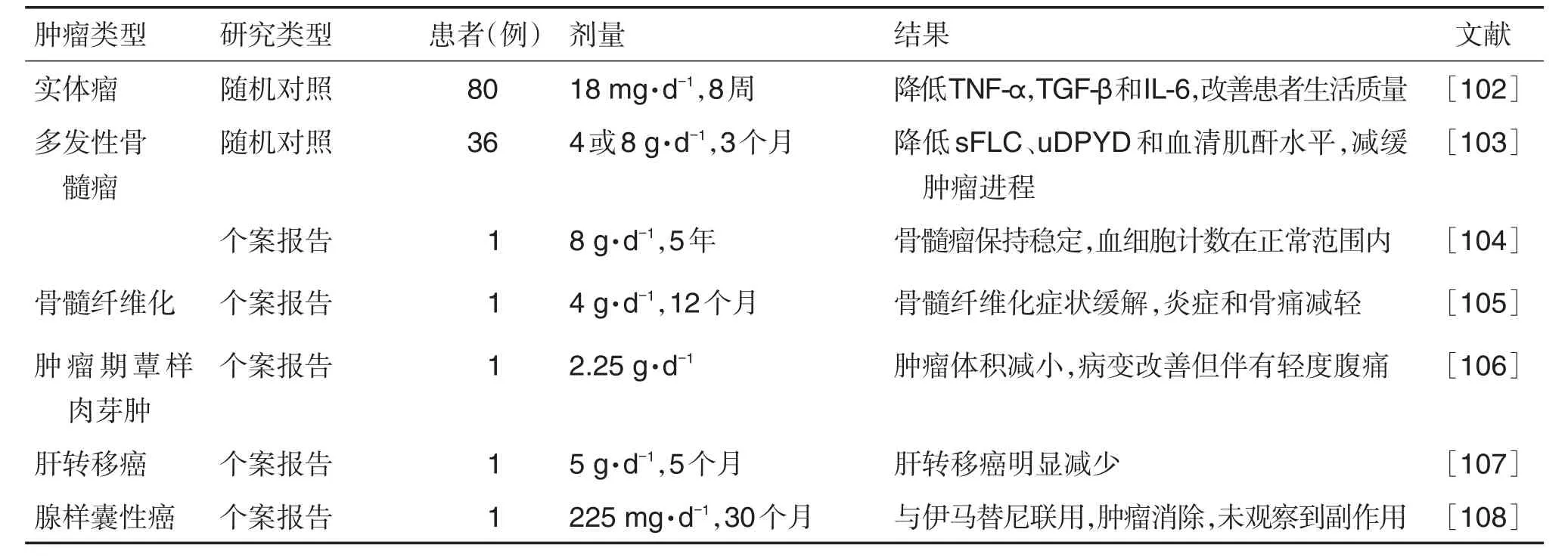
续表2
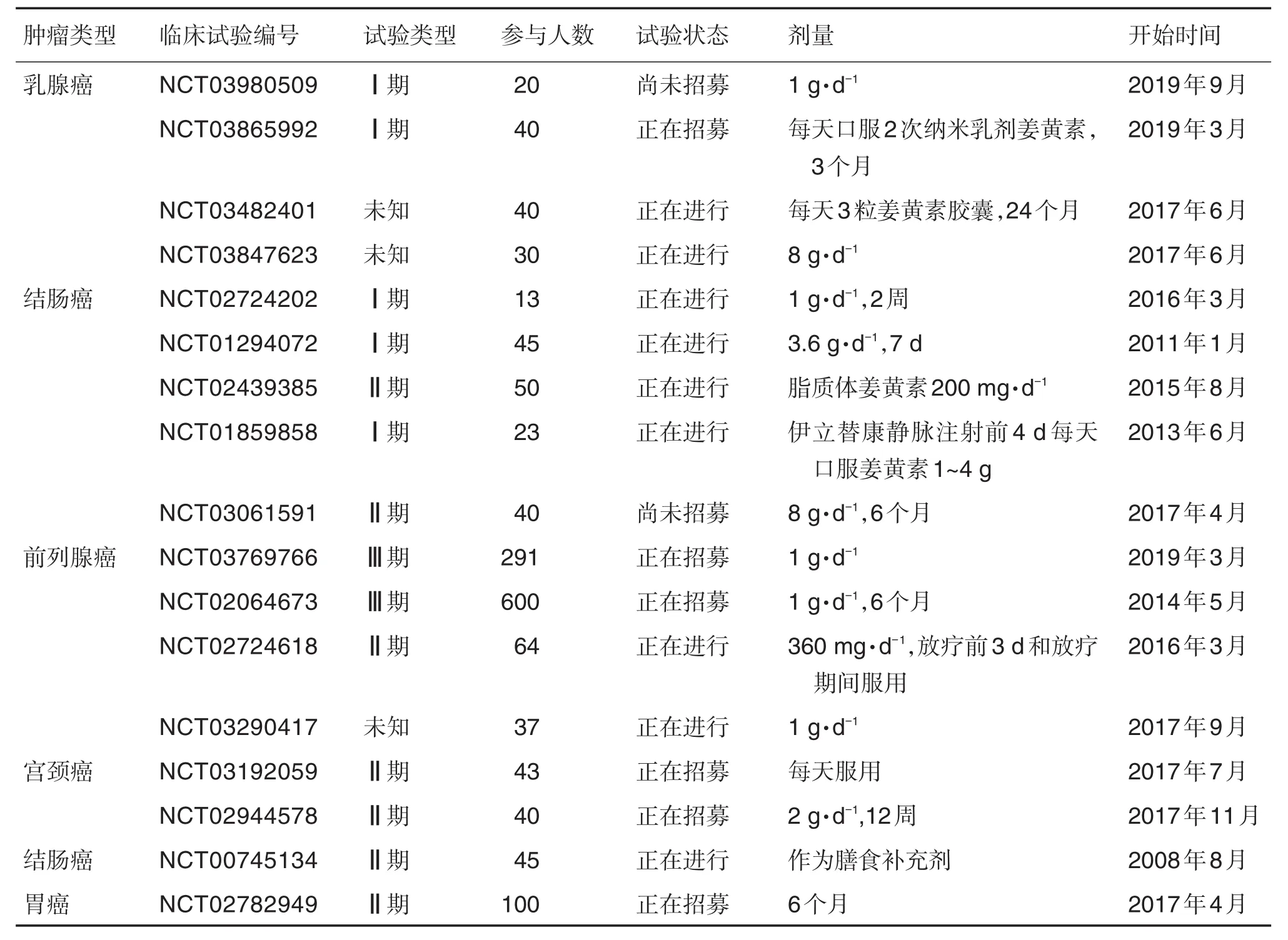
表3 正在进行的姜黄素抗肿瘤临床试验
7 结语
综上所述,姜黄素具有抗肿瘤作用,在体内外、动物模型及临床试验均显示了姜黄素抗肿瘤的有效性,揭示了其临床治疗前景。姜黄素抗肿瘤的作用机制涉及调节多种细胞信号通路,并作用于多种分子靶点,包括转录因子、细胞因子、生长因子及其受体、酶、炎症因子、调节细胞增殖及凋亡的相关基因等。上述研究结果让我们看到了姜黄素在治疗动物和人类肿瘤中的益处,但为了让这些结果在未来用于临床抗肿瘤治疗,还需要对姜黄素及其衍生物和新剂型在人体内的作用及作用机制、吸收和代谢特点等做进一步的研究,以确定更为合适的药物、剂量或剂型,选择更为合适的人群,并给予精准的抗肿瘤治疗,提高疗效,成为临床有效的肿瘤治疗药物。
