结核分枝杆菌TetR 家族蛋白Rv3295 新调控靶点及辅助因子的初步研究
2020-08-31吕明月崔莹莹唐祎依党光辉崔子寅刘思国宋宁宁
吕明月,崔莹莹,唐祎依,党光辉,崔子寅,刘思国*,宋宁宁*
(1. 黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163000; 2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)引起的严重危害人类健康的重要传染病。全世界约三分之一的人被感染,每年有数以百万计的人因结核病而死亡[1]。MTB 之所以能够在宿主体内长期滞留而不引起任何疾病症状,是因为其具有适应广泛生存环境的能力,例如低氧环境、树突状细胞、休眠和活化的巨噬细胞[2]。因此,解析MTB 调控适应外界环境和宿主体内长久滞留的分子机制具有重要的科学意义。
一般来说,TetR 家族蛋白是一种转录抑制蛋白,它能够与DNA 结合,在没有特定配体的情况下抑制转录。当配体存在时,配体则会与TetR 的C 端结合引起构象改变,从而导致与靶DNA 的分离[3]。Rv3295 隶属于TetR 家族蛋白,然而目前受Rv3295 调控的靶基因及其影响调控作用的辅助因子尚不清楚。Rv3229c(DesA3)是一种与膜结合的硬脂酰辅酶A(CoA)去饱和酶,与氧化还原酶Rv3230c 共同合成油酸。油酸是分枝杆菌膜甘油三酯和磷脂的前体[4]。另外,在分枝菌酸合成过程中,油酸可以将双键引入到特定的分枝菌酸结构中[5]。前期已有研究证明,DesA3是MTB 在巨噬细胞内存活所需的关键基因,表明油酸在MTB 代谢过程中起重要作用[6]。二线抗结核药物硫脲异氧基靶标于DesA3,对耐药菌株MTB 具有杀灭作用,并已与异烟肼联合用于临床治疗[7-8]。
本研究中,rv3229c 是否为转录调控蛋白Rv3295新的调控靶点?且哪些小分子会影响Rv3295 与rv3229c 的结合?Rv3295 中哪些重要氨基酸残基参与了与小分子的互作?这几个重要科学问题的阐述对于我们深入了解Rv3295 的转录调控机制及后期药物靶标的筛选奠定了一定的理论基础。
1 材料与方法
1.1 菌种、载体及实验动物MTB H37Rv 基因组和pET-22b 载体由本实验室保存;E.coli DH5α和E.coli BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。新西兰大白兔购自坤达养殖场。
1.2 主要试剂7H9 和LB 液体/固体培养基均购自美国BD 公司;IPTG 购自美国Amresco 公司;BCA 蛋白检测试剂盒购自天根生化科技(北京)有限公司;PCR 产物纯化试剂盒和DNA 胶回收试剂盒购自OMEGA 公司;M-280 羊抗兔IgG 免疫磁珠购自美国Thermo Fisher Scientific 公司;甲基绿购自国药集团化学试剂有限公司;放线菌素D 购自Alphabio 公司;iPure DNA 提取试剂盒购自Diagenode 公司。
1.3 重组蛋白Rv3295 的表达与纯化参照rv3295基因序列(Gene ID:887180)设计引物SN7f 和SN8r,以MTB H37Rv基因组DNA为模板,PCR扩增rv3295基因(表1),经双酶切后克隆至pET-22b载体,构建重组表达质粒pET-22b-rv3295,经酶切与测序鉴定正确后转化至E.coli BL21(DE3)感受态细胞。37 ℃180 r/min培养至OD600nm=0.6时加终浓度1 mmol/L IPTG 30 ℃过夜诱导表达,离心收集菌体。超声破碎后离心、留上清弃沉淀。利用Ni-NTA亲和树脂进行纯化,经500 mmol/L咪唑洗脱,然后透析,经SDS-PAGE 和western blot 鉴定,以BCA蛋白检测试剂盒测定蛋白质浓度。
1.4 凝胶迁移试验(EMSA)在5'端分别用Cy5 标记的引物SN387f 与SN387r 通过PCR 扩增Cy5 标记的DNA 片段rv3229c(表1),然后进行EMSA。EMSA 反应体系(20 μL):40 ng/μL Cy5 标记DNA;2 μL 10×binding buffer;2 μL 25 mmol/L DTT;1 μL 1 mg/mL poly(dI-dC)和不同浓度(0.4 μmol/L、0.8 μmol/L)的Rv3295,37 ℃孵育30 min。8%的非变性聚丙烯酰胺凝胶在200 V 下电泳3 h~4 h,分离DNA-蛋白质复合物,使用凝胶成像系统扫描。

表1 本研究使用的引物Table 1 Primers table
1.5 DNA 大沟小沟结合试验为确定Rv3295 与rv3229c启动子主要结合的区域,用Cy5标记的rv3229c探针分别与2.5 μmol/L、25 μmol/L、250 μmol/L 的甲基绿(一种主要与大沟结合的试剂)和2.5 μmol/L、25 μmol/L、250 μmol/L 放线菌素D(一种与小沟结合的试剂)一起孵育。20 μL 体系中包括100 mmol/L Tris-HCl(pH 7.5);500 mmol/L KCl;10 mmol/L DTT;1 mg/mL poly(dI-dC)和Rv3295,37 ℃孵育30 min。通过EMSA 对其进行分析。
1.6 染色质免疫沉淀(ChIP)试验采用ChIP 方法测定Rv3295 在体内与DNA 的结合能力。将纯化的Rv3295 蛋白与弗氏不完全佐剂进行体积比为1∶1 混合后对两只新西兰大白兔进行皮下注射,每只兔子注射400 μg,每隔14 d 注射一次,注射3 次后进行心脏采血,制备血清,-80 ℃保存,该血清用于后续的ChIP 试验。
将MTB H37Rv 在200 mL 7H9 培养基中培养至对数生长期(OD600nm=0.8),1%甲醛固定10 min,加入125 mmol/L甘氨酸反应5 min,终止反应。7000 r/min离心10 min 后用3 mL IP 缓冲液重悬沉淀,利用20%振幅,on 3 s,off 5 s的超声破碎仪在冰上超声破碎5 min,13000 r/min 离心20 min,转移上清至新的EP 管中,利用琼脂糖凝胶电泳检测,获得100 bp~700 bp 的超声DNA 片段。利用辛酸-硫酸铵法[9]纯化Rv3295 多克隆抗体。用20 μL Rv3295 多克隆抗体与M-280 羊抗兔抗体偶联制备包被磁珠。1.5 mL 上清液中,取100 μL 作为对照,其余1.4 mL 与包被磁珠在4 ℃孵育3 h,用离心法收集免疫复合物,65 ℃孵育过夜,用iPure DNA 提取试剂盒纯化样品,酚氯仿萃取两次DNA,乙醇沉淀,采用引物SN387f/SN387r(表1)进行PCR。
1.7 同源建模Rv3295 的目标序列从Uniprot(IDP96900)获得,用BLAST 鉴定模板晶体结构,并从RCSB 蛋白数据库(PDB ID∶2 QIB)中下载。同源建模用MOE v2018.01011[10]进行。在pH 值为7,温度为300 K 的条件下,用LigX 优化蛋白质的质子化状态和氢的取向。首先,对应目标序列与模板序列,建立了10 个独立的中间模型。这些不同的同源模型是通过对不同的循环候选体和侧链旋转体的置换选择得到的,最后选择基于GB/VI 评分函数得分最高的中间模型作为最终模型,然后利用AMBER 10:EHT 力场进行进一步能量优化。
1.8 分子对接用ChemBioDraw 2014 绘制了6 个小分子(VB1、VB3、VB6、VC、Fe3+和Zn2+)的二维结构,并通过能量优化得到三维结构。用MOE-Dock 方法研究分子与蛋白质之间潜在的分子结合模型。对接前,选择AMBER 10:EHT 力场和R-field 隐式溶剂模型。使用MOE 中的Site Finder 模块识别绑定口袋。附近的残基包括Ala 22、Phe 25、Gly 26、Phe 60、Val 63、Val 64、Glu 67、Ala 68、Tyr 72、Ala 98、Gln 102、Glu 105、Ala 106 和Leu 121。对接流程遵循“induced fit”法则,结合口袋的侧链可以根据配体构象调整,并受其位置的限制,用于约束侧链转动的权重为10。对每个配体先用London dG 评分对所有对接位置进行排序,将前20 个构象进行力场细化,通过GBVI/WSA dG 再次评价。结合自由能最低的构象为最佳(可能)结合模式。利用PyMOL(www.pymol.org)生成了分子图像。
2 结 果
2.1 重组蛋白Rv3295 的纯化及鉴定将诱导表达的重组蛋白Rv3295 纯化后经SDS-PAGE 检测,结果显示存在一条26 ku 的条带(图1),条带大小正确,可进行后续EMSA 试验。

图1 重组蛋白Rv3295 纯化鉴定结果Fig.1 Protein purification of Rv3295
2.2 Rv3295 与rv3229c启动子区域在体外特异性结合根据细菌单杂交数据,预测rv3229c 可能是Rv3295 的靶标[11]。为确定Rv3295 与rv3229c 启动子区域是否相互作用,用Rv3295 和Cy5 标记的rv3229c启动子DNA 进行EMSA(图2A),结果显示,随着Rv3295 浓度的增加,可以明显观察到滞后条带的出现。为了进一步确认Rv3295 与rv3229c 结合的特异性,进行了竞争试验,用非标记冷探针rv3229c 启动子DNA 与Cy5 标记的rv3229c 启动子DNA 进行竞争(图2B),结果显示,冷探针rv3229c 启动子DNA 可竞争性地抑制Rv3295 与Cy5 标记的rv3229c 启动子DNA 的结合,表明Rv3295 在体外与rv3229c 启动子DNA 的结合是特异性结合。
2.3 ChIP 试验结果利用ChIP 试验检测Rv3295 在体内与启动子rv3229c 结合情况,结果显示,从抗-Rv3295 多克隆抗体所提取的免疫复合物中可以扩增出目标DNA 片段,而免疫前的血清对照组未能扩增rv3229c 启动子区域(图2C),表明Rv3295 与rv3229c 启动子区域在体内结合,rv3229c 是MTB Rv3295 的转录调控靶点。

图2 Rv3295 与rv3229c 启动子在体内外相互作用Fig.2 Interactions between Rv3295 and rv3229c promoter in vitro and in vivo
2.4 Rv3295 与靶DNA 大沟结合试验为探索Rv3295 是与rv3229c 的大沟还是小沟作用,本研究通过增加甲基绿和放线菌素D 的浓度后利用EMSA 进行分析(图3),结果显示,随着甲基绿浓度的增加,DNA-蛋白质复合物的形成受到抑制,出现了更多的非结合DNA,相反,增加放线菌素D 浓度对DNA-蛋白质复合物无影响。表明Rv3295 与DNA 的大沟相互作用,同时该结合试验为了解Rv3295 蛋白与DNA互作的结构模式及调控作用做了初步的预测。

图3 Rv3295 与DNA 大沟结合试验Fig.3 Rv3295 binds to the major groove of DNA
2.5 影响Rv3295 与DNA 互作的小分子及金属离子的筛选转录调控蛋白往往通过调控基因转录来感知小分子并适应环境变化。本研究利用EMSA 从一系列氨基酸、维生素和金属离子中筛选影响Rv3295与rv3229c 启动子结合的小分子(图4)。结果显示,不同浓度的VB1、VB3、VB6、VC、Fe3+和Zn2+抑制了Rv3295 与rv3229c DNA 片段的结合。相反,所有检测的氨基酸和一些金属离子(Pb2+、Cd2+、Cu2+、Co2+、Ni2+、Mn2+、Cr3+)、dATP、dTTP、dCTP、dGTP、四环素、c-di-GMP、c-di-AMP 不影响DNA-蛋白质复合物的形成(图5)。该试验结果表明VB1、VB3、VB6、VC、Fe3+和Zn2+对Rv3295 与rv3229c DNA 片段的结合有抑制作用。
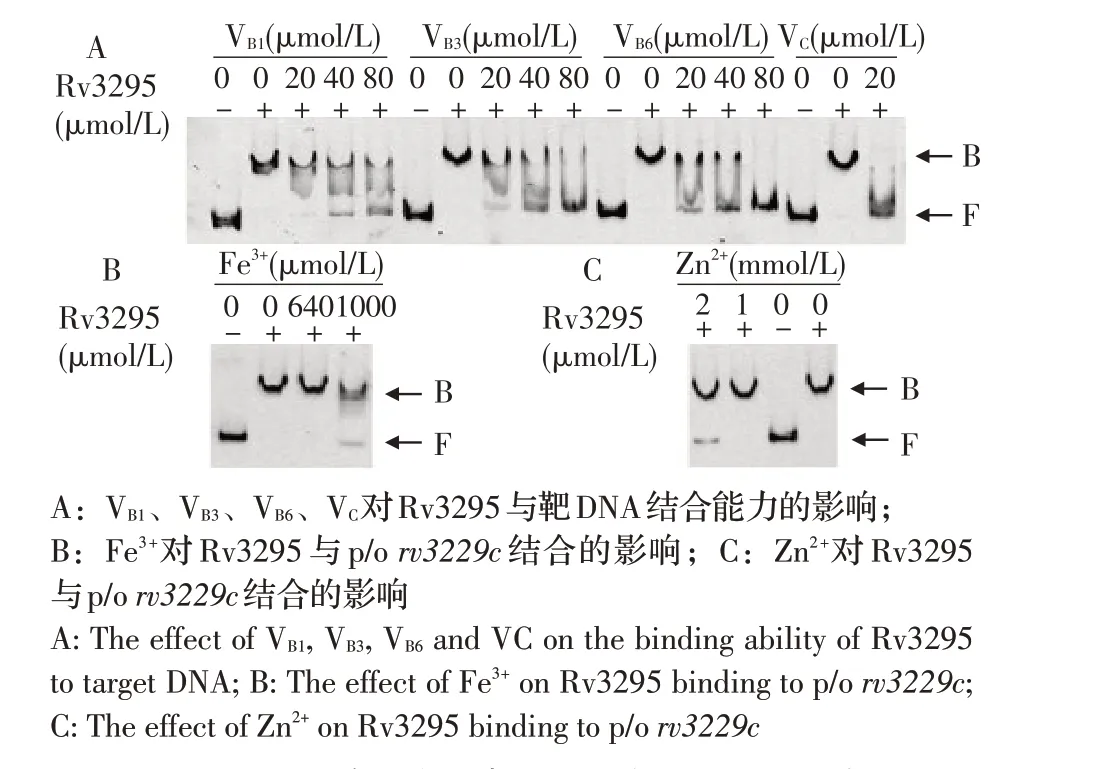
图4 EMSA 检测维生素和金属离子对Rv3295 与rv3229c 结合的影响Fig.4 Effect of vitamins and metal ions on Rv3295 binding to the rv3229c tested by EMSA
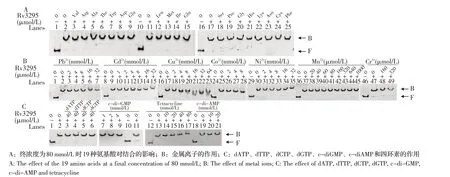
图5 氨基酸、金属离子和其它小分子对Rv3295 与rv3229c 启动子结合的影响Fig.5 Effect of amino acids,metal ions and other cofactors on Rv3295 binding to the rv3229c promoter tested by EMSA
2.6 Rv3295 的同源建模对Rv3295 进行同源建模, Rv3295 的Ramachandran 图显示,99%的残基位于合理区域(图6A、6B),表明模型的三维结构构建合理。对Rv3295 模型的结构进行分析,结果显示,Rv3295 蛋白由11 个螺旋组成,残基(1~50)形成1~3 螺旋,残基(54~218)形成4~11 螺旋。Rv3295结构与模型结构基本一致。三维结构重叠的平均RMSD 值为0.78A(图6C、6D 和图7)。

图7 Rv3295 的二维结构Fig.7 The 2D structure of Rv3295
2.7 Rv3295 的分子对接为了研究6 种小分子(VB1、VB3、VB6、VC、Fe3+、Zn2+)与Rv3295 之间潜在的分子结合模式,本研究进行了分子对接,由GBVI/WSA dG 评分估计的结合自由能表示蛋白与小分子的结合能力,较低的结合分数表示较高的结合亲和力。结果显示,VB1、VB3、VB6和VC主要形成氢键,Fe3+和Zn2+主要形成盐桥。Val 64 和Leu 121 与VB1相互作用(图6E);Glu 67 与VB3相互作用(图6F);Glu 105 与VB6相互作用(图6G);Glu 105 与VC相互作用(图6H);Glu 67、Gln 102 和Glu 105 与Fe3+相互作用(图6I);Glu 67、Gln 72 和Ala 98 与Zn2+(图6J)相互作用(表2)。表明Glu 67 和Glu 105 氨基酸残基在Rv3295 与小分子及金属离子的相互作用中起重要作用。

图6 Rv3295 的同源建模和分子对接Fig.6 Homology modeling and Molecular Docking of Rv3295
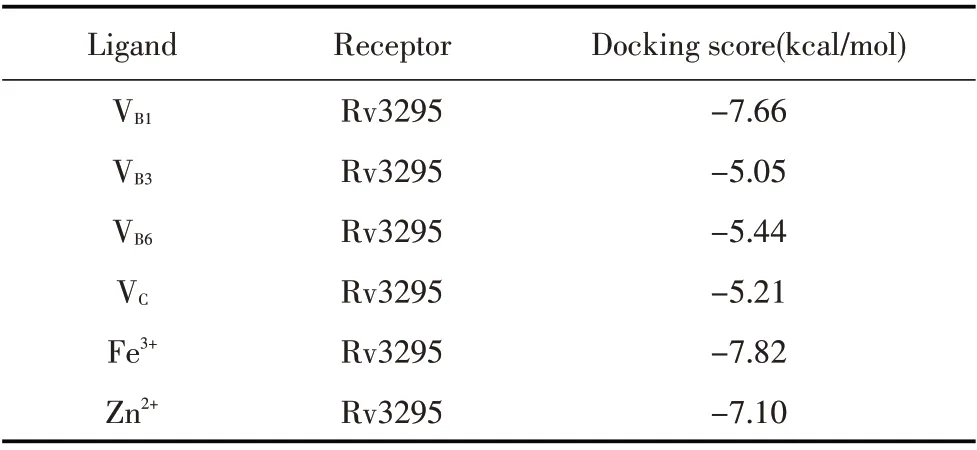
表2 Rv3295 与小分子对接打分情况Table 2 The docking score between Rv3295 and ligands
3 讨 论
TetR 转录调控蛋白家族广泛分布于细菌中,主要参与抗生素耐药、调控编码小分子的基因、群体感应和原核生理学等生理功能[12]。Rv3295 隶属于TetR 家族蛋白,但是其调控功能及影响调控的小分子尚未见相关报道。MTB Rv3229c 编码DesA3,为MTB 3 种需氧硬脂酰脱饱和酶(DesA1、DesA2 和DesA3)之一[13],其过表达与低水平异氧抗性(ISO)有关,ISO 是类似于异烟肼(INH)和乙硫酰胺(ETH)的硫脲衍生物,可抑制分枝菌酸的合成,并已用于结核病的临床治疗[8]。
MTB 通过感知某些小分子,利用转录调控蛋白,启动自身调节系统进而适应环境变化。已知的TFR(TetR family of regulators)配体种类多样,包括胆汁酸、抗生素、蛋白质、脂肪酸及其衍生物、细胞信号分子、碳源和金属离子[12]。通过EMSA 筛选影响Rv3295 与DNA 互作的小分子及金属离子的试验中发现VB1、VB3、VB6、VC、Fe3+、Zn2+影响Rv3295 与DNA 的结合。这是关于维生素影响TetR 家族蛋白与靶基因DNA 结合的首次报告,表明TetR 家族蛋白具有广泛的小分子适应性。除了Rv3295 外,维生素(VC)也对隶属于Lrp 家族蛋白的Rv3291c(LrpA)转录调控蛋白与其目标基因的结合有抑制作用[14],鉴于某些维生素具有抗菌特性,并参与MTB 的关键生物合成途径。因此,维生素作为调控基因转录的小分子具有潜在的重要的研究和临床应用价值。
TetR 家族调控因子(TFRs)具有螺旋-转角-螺旋(HTH)结构,包含两个结构域:与DNA 结合的N-末端和与配体结合的C-末端[15]。迄今为止,几个TFR-小分子复合物的结构已被解析[12],这对于了解小分子存在的条件下TFR 的调控机制具有重要意义。有研究表明甲基绿、放线菌素D 分别与DNA 的大沟或小沟相互作用[16]。通常小沟结合蛋白以高亲和力结合DNA,表现出完全不同的整体褶皱,并以不同的方式重建DNA 构象,并与疏水基相互作用进而与其他蛋白结合,从而有效地充当DNA 伴侣。一般而言,TFRs 的保守结构中包含9 个α螺旋。螺旋1~3 形成DNA 结合区,具有显著的序列同源性,螺旋4~9 形成了不同的配体结合域,使得这些配体可与这个家族的不同调控基因结合[17]。然而,空肠弯曲菌CemR 却缺乏通过与DNA 大沟相互作用且与靶DNA 特异性结合所需的螺旋3[17]。互作的结构结果显示,Rv3295C-末端与小分子(VB1、VB3、VB6、VC)及金属离子(Fe3+、Zn2+)存在相互作用,这与大多数已解析的TetR 家族蛋白结构特点相符合,由于位于C 端结构域的Glu 67 和Glu 105 参与了与大多数被测配体的结合,因此猜测这两个残基可能在与辅助因子的相互作用中起重要作用,但仍需通过构建点突变蛋白进行后续验证。另外,大多数TFRs 主要利用特定小分子与其C 端结构域的构象改变从而抑制基因的转录。虽然目前还尚未有小分子影响Rv3295 调控的具体机制的相关报道,但其分子对接结果部分说明了小分子有可能也是通过C 端结构改变与Rv3295 的结合亲和力,从而调节基因的表达。
通过EMSA 与ChIP 联合分析发现Rv3295 在体外与体内均与desA3 启动子结合,这表明Rv3295 可以直接调控desA3 的表达,且参与油酸的合成调控,暗示该蛋白在MTB 的致病性中起到重要的调控作用。该研究是对关于Rv3295 调控desA3 基因表达的首次相关报告。综上所述,本研究对Rv3295 的调控功能研究奠定了理论基础,并对后期药物靶标的筛选做了一定的铺垫工作。
