异氟烷对脑缺血再灌注脑损伤的保护作用及对海马区c-fos 和Bax 表达的影响
2020-08-31黄治国
黄治国,殷 维,晏 毅
(中国人民解放军联勤保障部队九二零医院麻醉科,云南昆明 650118)
脑缺血再灌注后产生的损伤包括自由基的产生、氧化应激作用、兴奋性氨基酸毒性作用及神经元内钙超载,促使大量神经递质释放,最终导致神经细胞凋亡的发生[1]。异氟烷是应用于临床最广泛的吸入麻醉药之一,经过多年的临床应用发现它具有降低颅内压、减少脑内氧耗、诱导与维持平衡、苏醒快、副作用少等特点。有关吸入麻醉药对缺血神经元保护作用的机制,尽管已经提出了许多假说[2-3],但其较深层次的作用机制迄今为止仍不很清楚。本文通过构建脑缺血再灌注大鼠模型,观察吸入不同浓度异氟烷(isoflurane,IF) 对大鼠神经功能的改变及其对缺血神经元c-fos,Bax 表达的影响,为进一步明确异氟烷的神经保护作用以及相应的作用机制提供理论依据。
1 材料与方法
1.1 实验材料与仪器
1.1 实验动物
SPF 级雄性Wistar 大鼠,32 只,体重(200±20) g,购自北京维通利华实验动物技术有限公司,许可证号SCK(京) 2016-0006。12 h 循环光照,室温20℃~25℃,自由饮水和摄食。
1.2 主要试剂和仪器
大鼠c-fos、Bax、β-actin 引物合成(上海生工生物工程有限公司);c-Fos,Bax 抗体(CST,Danvers,MA,USA);β-actin 抗体及相应二抗(Santa Cruz,USA);RIPA 裂解液,Trizol 提取试剂,逆转录试剂盒(Fermentas);异氟烷(瑞沃德生命科技有限公司);SOD,MDA 检测试剂盒(南京建成生物工程研究所);仪器:脑立体定位仪B3E03-004(瑞沃德生命科技有限公司),电凝止血器(上海亮直医疗器械有限公司),微型电钻P-500-3(施力特),动脉夹(北京冀诺泰科技发展有限公司);多功能酶标仪(Thermo),超低温冰箱(Thermo),低温高速离心机(Beckman);自制呼吸箱;恒温水浴箱(美国scilogex);荧光定量PCR 仪(ABI StepOne),低温离心机(HITACH:CF-16RX);大鼠线栓(广州佳灵)。
1.3 动物分组及缺血模型制备
大鼠经戊巴比妥钠(来自昆明医科大学动物学部,35 mg/kg) 腹腔注射麻醉,体温由直肠探头监视,将大鼠放在可控温电热毯上面,体温维持在(37.0±1.0) ℃,在体式显微镜下,取颈旁正中切口,分离颈前筋膜与肌肉组织,在甲状软骨上缘分离出左侧ECA、ICA,丝线结扎ECA,将ECA 剪断,微型血管夹暂时夹闭CCA 近分叉处和ICA 远端,于ECA 残端用显微剪制备适当的小口,使用大鼠专用栓线进入该切口,当线栓准确进入ICA后再将ECA 的松结结扎,最后将ICA 远处留置的动脉夹打开,线栓插入距离ICA 和ECA 分叉处8~9 mm,感到阻力后即停止插入线栓,使线栓完全固定,将动脉夹取下,构建MCA 阻塞,MCAO梗阻2 h 后,拔除线栓,恢复血供,形成缺血再灌注损伤,彻底清洗并缝合手术切口。置饲养笼中观察。动物随机分为四组:假手术组(Sham),缺血组(IR),IR+IF(1.5%) 组,IR+IF(2.0%) 组。假手术组只手术暴露,不插入线栓以及MCA 栓塞,术后4 h 取材。吸入麻醉药组在制成脑缺血再灌注模型后,置于呼吸箱内,于缺血期间分别持续吸入最低肺泡有效浓度1.5%,2.0%的异氟烷。每组8 只大鼠,其中4 只取材后进行脑组织含水量测定,另外4 只,新鲜取材各大鼠右侧海马组织,分为3 份,-80℃冻存备用。
1.4 神经功能行为缺陷评分
再灌注4 h 后对大鼠进行神经损害严重程度评分(neurological severity score,NSS)[4],NSS 包含了运动、感觉、反射及平衡实验,最低0 分,最高18 分。0 分为神经功能正常;1~6 分为轻度损害;7~12 分为中度损害;13~18 分为神经功能重度损害。
1.5 大鼠脑组织含水量测定
神经功能行为缺陷评分后,各组大鼠均用戊巴比妥钠(35 mg/kg 腹腔注射) 麻醉后,断头取脑,迅速切取右侧大脑半球,滤纸吸干其表面血渍,电子天平精确称重后,置于120℃恒温干燥箱内烘烤48 h 至恒重,再精确称重,采用干湿重法测定脑组织含水量,以百分率表示。计算公式为:脑组织含水量=(湿脑重量-干脑重量)/湿脑重量×100%。
1.6 脑组织中SOD,MDA 含量检测
-80℃冰箱取出1 份海马组织加入4℃生理盐水制备组织匀浆,离心取上清液,分为两份,按试剂盒说明书检测SOD,MDA 含量。
1.7 实时定量RT-PCR
-80℃取出第2 份海马组织进行总RNA 提取,参照Trizol 试剂盒说明书进行。每个样本取1 μg总RNA 作为逆转录模板合成cDNA。所用引物见。PCR 反应条件:94℃2 min;94℃20 s、60℃30 s、72℃30 s,共40 个循环;产物经溶解曲线单峰验证,记录每个反应管中的荧光信号达到所设定值时所需的循环数(Ct 值),△△Ct=(Ct目的基因-Ctβ-actin) 治疗组-(Ct目的基因-Ctβ-actin) 对照组,数据采用2-△△Ct法分析,计算目的基因与内参β-actin 比值作为目的基因的相对表达量,见表1。
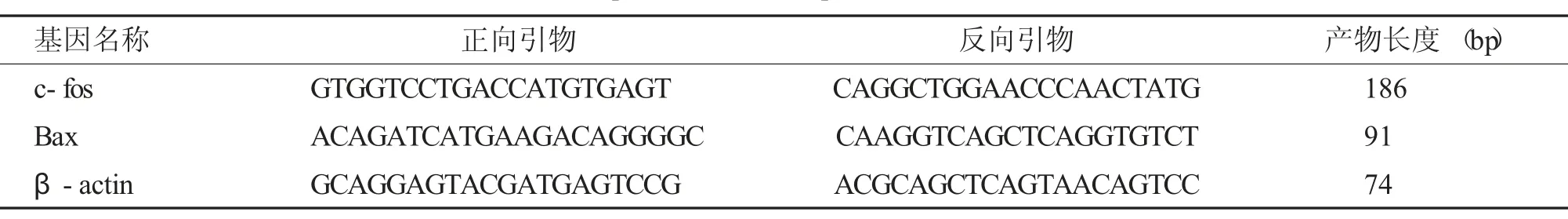
表1 实时定量PCR 检测所用引物序列Tab.1 Primer sequence list for quantitative real-time PCR
1.8 Western blot 检测蛋白表达
-80℃取出剩余的1 份海马组织,加入RIPA裂解液制备样本总蛋白,加入4 倍体积的上样缓冲液,沸水中变性3 min,离心后收集上清液,上样,电泳分离后,200 V、400 mA 转膜2.5 h,封闭、洗膜后,加入用TBST 稀释的一抗(β-actin,1:200;c-Fos,1:1 000;Bax,1:1 000),4℃冰箱摇晃孵育过夜。再用TBST 溶液洗膜3 次,每次10 min,加入HRP 标记的二抗,室温下摇晃孵育2~4 h,化学发光成像系统下显色。
1.9 统计学处理
数据采用SPSS 统计学软件进行统计学分析,结果均以均数±标准差(±s) 表示;假设检验采用单因素方差分析,两组间差异比较使用LSD检验。P<0.05 为差异有统计学意义。
2 结果
2.1 异氟烷处理后脑缺血再灌注大鼠行为学变化
缺血再灌注损伤4 h 后,各组行为学评分显示:Sham 组未观察到任何神经功能损伤,IR 组(15.20±1.398),IR+IF(1.5%) 组(9.40±3.273),IR+IF(2.0%) 组(3.60±2.413),两组间评分存在差异(P<0.05),提示异氟烷处理能促进大鼠脑缺血后神经功能修复。
2.2 脑组织含水量
再灌注后4 h,与模型组(84.33±1.408) %相比,假手术组的(78.59±2.030) %脑组织含水量较低,说明IR 组有明显的脑水肿,1.5%异氟烷处理组的(81.03±2.897) %的脑组织含水量有一定下降,但差异不明显(P>0.05);2.0%异氟烷处理组(79.25±2.029) %的脑组织含水量下降更为显著(P<0.05),见表2。
表2 各组大鼠神经功能缺损行为学评分和脑脑组织含水量比较(±s)Tab.2 Comparison of NSS score and the water content in brain tissue among different groups(±s)
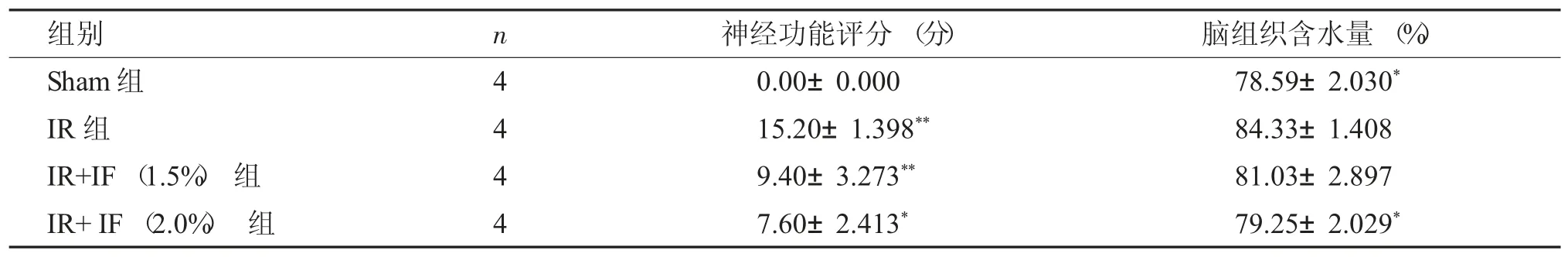
表2 各组大鼠神经功能缺损行为学评分和脑脑组织含水量比较(±s)Tab.2 Comparison of NSS score and the water content in brain tissue among different groups(±s)
与IR 组比较,*P<0.05,**P<0.01。
2.3 异氟烷处理后脑组织中SOD,MDA 含量
与假手术组相比,模型组脑组织匀浆中SOD活性明显降低,而MDA 含量显著增高,经1.5%异氟烷处理后,脑组织匀浆中SOD 酶活性较模型组有相应改善,且MDA 含量明显降低,2.0%异氟烷处理组较1.5%组效果有增强,但差异无统计学意义(P>0.05),见图1。
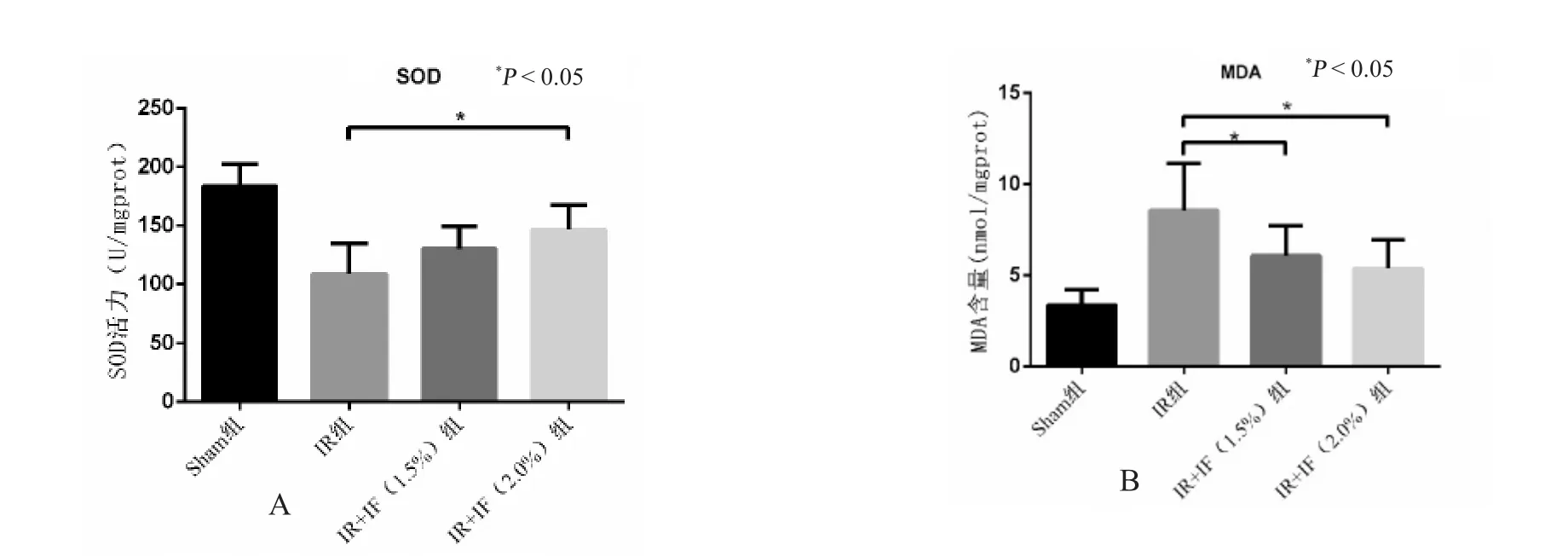
图1 异氟烷处理对脑缺血再灌注后SOD 和MDA 的影响Fig.1 The effects of Isoflurane posttreatment on the release of SOD and MDA following cerebral ischemia reperfusion
2.4 异氟烷处理后脑缺血再灌注大鼠脑组织中c-fos 和Bax 表达变化
qRT-PCR 检测结果显示异氟烷对脑缺血再灌注大鼠海马中c-fos 和Bax 的表达具有明显的调节作用。缺血再灌注之后,c-fos 和Bax mRNA 在大鼠脑组织海马区中表达明显增强;与IR 模型组相比,1.5%和2.0%异氟烷均可明显降低c-fos 和Bax的mRNA 表达量,并且组间差异有统计学意义(P<0.05),见图2。
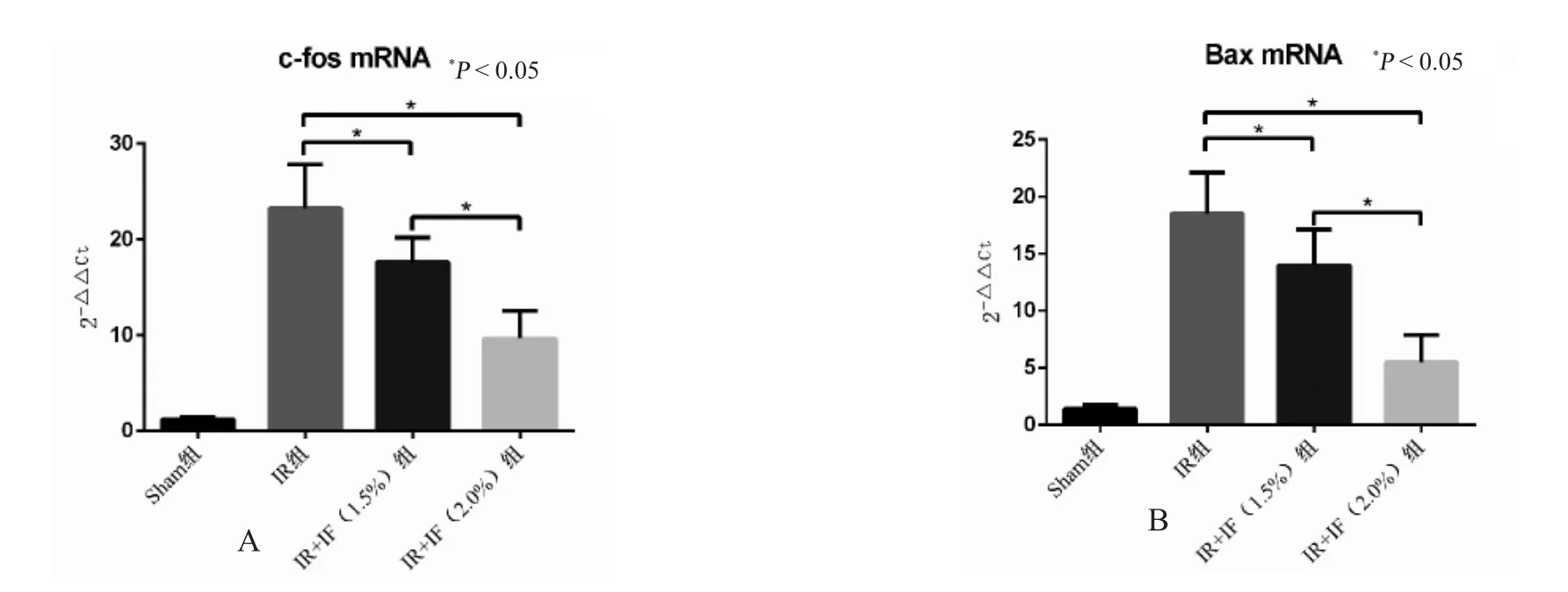
图2 qRT-PCR 检测异氟烷处理对脑缺血再灌注后后c-fos 和Bax 的影响Fig.2 The effects of Isoflurane posttreatment on the expression of c-fos and Bax following cerebral ischemia reperfusion by qRT-PCR
2.5 Western blot 结果
与假手术组相比,模型组海马区组织中c-fos和Bax 蛋白表达量明显升高,经1.5%异氟烷处理后,海马区组织中c-fos 和Bax 蛋白表达量较模型组显著降低,且差异有统计学意义(P<0.05);2.0%异氟烷处理组较1.5%组效果有增强,但差异无统计学意义(P>0.05),见图3。
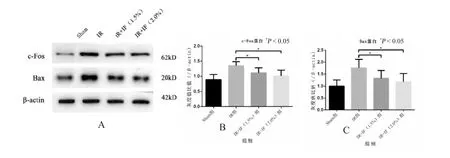
图3 Western blot 检测异氟烷处理对脑缺血再灌注后c-fos 和Bax 的影响Fig.3 The effects of Isoflurane posttreatment on the expression of c-fos and Ba following cerebral ischemia reperfusion by Western blot
3 讨论
即早基因(immediate early gene,IEG) 在体内发挥第三信使的作用,被发现普遍存在于中枢神经细胞中,正常状态下呈现低表达,难于检测。但在神经细胞接受内源刺激后,早期快反应基因即出现快速表达[6],作用于目的基因,导致目的基因转录水平发生改变,参与调节神经细胞的生长、分化和损伤修复。研究脑损伤时早期快速反应基因表达的意义在于明确他们对于继发性病理损害过程发生与发展的影响,尤其是在神经细胞损伤机理与抗损伤修复机制中的作用。研究已证实,中枢神经系统在受到如脑缺血、癫痫发作等损害性刺激时,即早基因c-fos、c-jun 出现异常高表达。药物诱发癫痫时,脑不同部位出现c-fos、c-jun mRNA 及其蛋白表达,并于用药后15 min 开始表达,1 h 后达到高峰,16 h 后恢复正常水平[7]。c-fos 作为即早基因中的研究热点之一,参与神经细胞生长、发育、分化、记忆和信息传递等生理过程。大脑在受到缺血缺氧、创伤性损伤等多种刺激后,可激活中枢神经系统(nervous system,CNS) 中c-Jun、c-Fos 基因的表达。
Bax 作为Bcl-2 家族蛋白中的第一个促进细胞凋亡的因子,其分子量大约为21 κD。Bax 通常以单体形式分布于细胞浆中,并均匀围绕在线粒体外膜周围[8]。Bax 可通过调节线粒体PT 孔破坏线粒体膜的完整性,改变线粒体膜的通透性,导致线粒体跨膜电位丢失,释放线粒体内的细胞色素C等促凋亡因子到细胞质内,进而激活Caspase 级联反应[9]。线粒体PT 孔的改变,导致线粒体内外之间Ca2+、pH 值、电荷发生变化,影响呼吸链的正常进行。Bax 蛋白还可以增加Ca2+释放,释放的Ca2+可以直接激活Caspase 效应分子或使线粒体对各种内、外源性凋亡刺激因素敏感性增高,促进细胞凋亡的发生[10]。众多研究都表明神经细胞凋亡在脑缺血再灌注损伤过程中的的重要作用,如何减弱、抑制神经细胞的凋亡也成为对于脑缺血再灌注损伤治疗的一个重要方向[11]。
脑缺血再灌的一个早期反应是海马神经元迅速表达c-fos 基因[12]。关于c-fos 表达的功能意义目前还争议,但神经元受损导致c-fos 高表达这一点是肯定的[13]。Neumann-Henfelin 等[14]表 明Ca2+是c-fos 表达增强的激发剂。缺血再灌早期细胞内Ca2+浓度升高导致c-fos 的高表达。如上所述,由于异氟烷对Ca2+的内、外流均有阻滞作用[15],因此也表现出对c-fos 表达的衰减作用。
综上所述,本研究中发现异氟烷对于大鼠脑缺血再灌注损伤具有一定保护作用,可以改善大鼠因脑缺血引起的神经功能减弱、也可改善海马区神经细胞的凋亡、还可抑制c-fos mRNA 表达,并且在一定程度上呈现出剂量依赖性。异氟烷因其安全、可控性好等优点,成为目前临床上应用最为广泛的吸入氟化麻醉药之一。近年研究发现,异氟烷对神经系统的作用广泛而复杂,因此积极开展异氟烷对神经系统作用机制的研究对于全面认识异氟烷具有积极的作用。
