荧光寿命数据的相量分析及其应用*
2020-08-29林丹樱牛敬敬刘雄波张潇张娇于斌屈军乐
林丹樱 牛敬敬 刘雄波 张潇 张娇 于斌 屈军乐
(深圳大学物理与光电工程学院, 光电子器件与系统教育部/广东省重点实验室, 深圳 518060)
1 引 言
随着荧光标记技术的快速发展, 荧光显微成像技术已成为生物医学研究领域不可或缺的工具之一. 荧光寿命作为荧光的一个重要参量, 反映了荧光分子从激发态回到基态的退激发速率, 是荧光分子的固有特性, 其变化能非常灵敏地反映荧光分子所处微环境(如细胞微环境中的温度、黏度、pH 值、离子浓度等)的变化情况[1]. 同时由于荧光寿命的测量可不受荧光探针浓度、激发光强度、光漂白等因素的影响, 相比强度测量更有利于实现定量化, 因此探测样品中荧光寿命的分布和变化的荧光寿命显微成像技术(fluorescence lifetime imaging microscopy, FLIM)常常被应用于定量测量细胞内的一些生物物理和生物化学参数[2,3], 或气溶胶的黏度测量等[4]. 另一方面, 许多荧光团分子具有相似的荧光光谱, 假如利用它们对样品中不同的结构进行特异性标记, 直接从光谱上很难分离, 但利用它们荧光寿命不同的特点, 可借助FLIM 技术对其荧光进行区分, 从而实现多结构的同时标记和成像. 这些特点使得FLIM 在生命科学研究中有着越来越广泛的应用.
一般而言, FLIM 中荧光寿命的测量方法有时域法与频域法两类, 其中频域法使用周期调制的连续光激发样品, 检测荧光信号相对激发光的振幅和相位变化来计算样品的荧光寿命; 时域法采用高重复频率的飞秒脉冲激光激发样品, 利用门控技术、扫描相机技术、时间相关单光子计数(timecorrelated single photon counting, TCSPC)技术等记录脉冲过后荧光信号的衰减过程并拟合或计算荧光寿命. 因此, 不管对于哪种类型的FLIM, 荧光寿命数据的处理都是非常关键的一环. 例如, 时域法荧光寿命数据最常用的处理方法是非线性最小二乘(nonlinear least-squares, NL-LS)拟合法,即选择一种衰减模型(单指数、双指数或多指数衰减)对每个像素点的测量数据进行曲线拟合, 然后分析出各衰减组分的荧光寿命值. 但是这种方法要求衰减模型的选择要合适, 同时要求每个像素点要采集足够多的光子数(通常 >1000)才能够进行有效拟合[5]. 这就使得基于这种数据处理方法的FLIM 技术在应用上受到了相应的限制. 例如,TCSPC-FLIM 通常需要在激发光较弱的情况下进行成像, 以避免相邻两个脉冲之间检测到的光子数多于1 而导致的光子堆积问题, 因此要求每个像素点采集足够多的光子数就需要延长采集时间, 由此带来的问题就是获得一幅荧光寿命图像的时间相对较长, 成像速度受限, 无法应用于一些荧光寿命变化速度较快的场合.
因此, 针对这些问题, 研究者们开发出了其他的算法, 例如相量分析(phasor analysis, PA)[6]、极大 似 然 估 计 (maximum likelihood estimate,MLE)[7]、一阶矩(the first moment, M1)[8]、贝叶斯 分 析(Bayesian analysis, BA)[9]、压 缩 感 知(compressed sensing, CS)[10]等, 这些方法可通过降低寿命分析对光子数的要求从而间接地提高FLIM 技术的成像速度[11]. 其中, PA 法通过将时域信息变换到频域, 可直接计算得到荧光寿命值,简单快速, 无需拟合, 且在低光子数情况下也能得到比较准确的寿命值, 适合于快速FLIM 成像. 另一方面, PA 法生成的相量图能将具有相似荧光衰减特性的荧光团分子所对应的像素点显示在相邻区域, 形成一定的簇状分布, 这种特点使得利用该方法可以更方便地对数据进行可视化和聚类分析,因此结合PA 法的FLIM 技术(phasor-FLIM)越来越受到科研人员的青睐, 在生命科学和生物医学研究中应用越来越广泛.
本文首先详细阐述phasor-FLIM 的基本原理及使用方法, 并在此基础上介绍该技术应用于细胞代谢状态测量、蛋白质相互作用研究、细胞微环境测量以及辅助病理诊断和提高超分辨成像分辨率等方面的最新研究进展, 最后对其发展前景进行展望.
2 Phasor-FLIM 的基本原理
如前所述, FLIM 技术中荧光寿命的测量通常分为频域法和时域法[1,6]. 这两种方法在数学意义上互为傅里叶变换, 但它们获取荧光寿命信息的方式不同, 得到的数据内容和形式不同, 从而数据处理方法一般也不同. 频域法一般使用正弦调制的连续光激发样品, 测量得到的是具有相同频率的荧光信号, 但由于荧光寿命的影响, 荧光信号的振幅和相位相比激发光均发生了变化, 因此通过计算荧光信号相对激发光的振幅调制度变化和相位延迟可计算得到荧光寿命. 而时域法则需要采用高重复频率的飞秒脉冲激光激发样品, 利用前面提到的门控技术、扫描相机或TCSPC 技术等直接或间接记录脉冲过后的荧光衰减过程, 得到的是荧光强度(或光子数)随时间的变化关系, 因此一般可通过曲线拟合得到荧光寿命.
PA 法最先被用于处理频域FLIM 技术得到的荧光寿命数据, 其相量由频域FLIM 测量得到的解调系数和相位延迟来构建, 是原始数据的直接表达[12]. PA 法同样适用于时域FLIM 数据的分析,但需要先将时域的荧光衰减变换到频域. 由于时域FLIM 中的TCSPC-FLIM 目前应用最为广泛,因此PA 法在该技术中的应用也是报道得最多的.以下分别介绍这两类技术中PA 法分析荧光寿命的基本原理, 并结合荧光相量图的特点阐述其典型的应用思路.
2.1 频域法FLIM 及其相量分析
在频域FLIM 中, 激发光常采用正弦调制的连续光源, 如激光、氙灯、LED 灯等, 激发光强可描述为
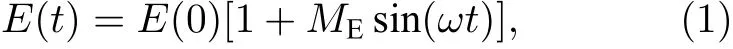
其中E(0)和E(t)分别为起始时刻和t时刻的激发光强度,ME=a/A为激发光的强度调制度(a和A分别是激发光的振幅和平均强度, 如图1(a)所示),w为调制的角频率. 利用该激发光激发标记有荧光团的样品后, 所检测到的荧光也是正弦调制的, 且其频率与激发光相同, 但强度调制度会降低,相位也有一定延迟. 如果荧光衰减符合单指数衰减规律, 则荧光光强可描述为
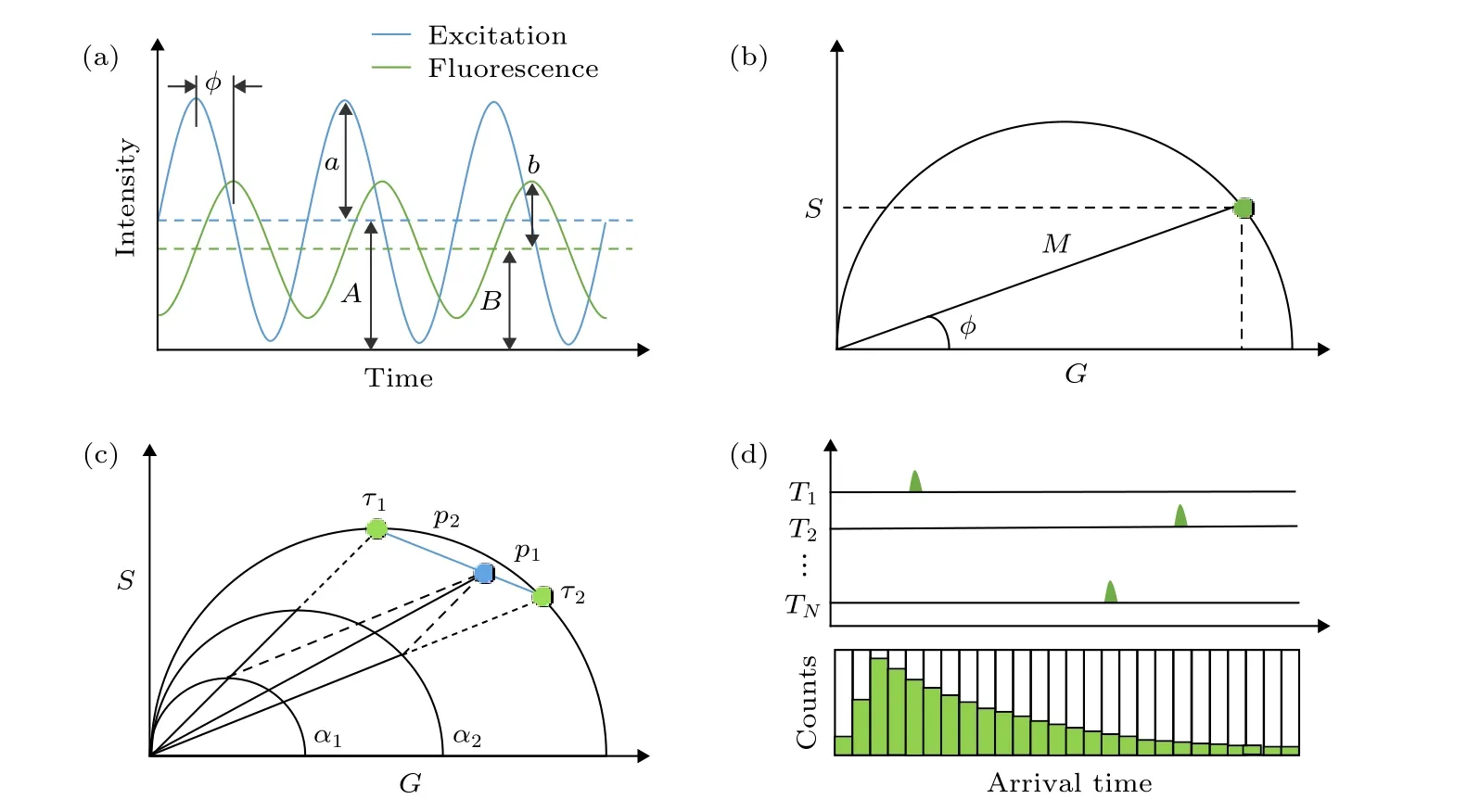
图1 荧光寿命的测量方法及相量分析(PA)法示意图 (a)频域法测量原理示意图; (b)单指数衰减的寿命相量示例图; (c)双指数衰减的寿命相量示例图; (d)时间相关单光子计数(TCSPC)测量原理示意图Fig. 1. Schematic diagram of fluorescence lifetime measurement and phasor analysis (PA): (a) Frequency domain method; (b) lifetime phasor of single-exponential decay; (c) lifetime phasor of bi-exponential decay; (d) time-correlated single photon counting (TCSPC) method.
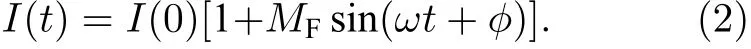
相应地,I(0)和I(t)分别为起始时刻和t时刻的荧光强度,MF=b/B为荧光的强度调制度(b和B分别是荧光的振幅和平均强度, 如图1(a)所示),f为相位延迟或相移. 通过测量相移f和解调系数M=MF/ME, 即可计算出相应的荧光寿命, 即:
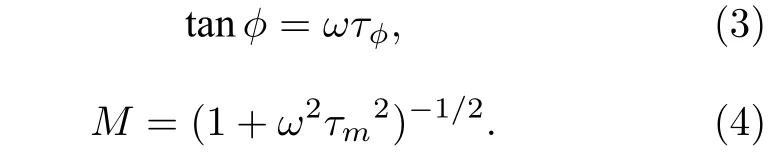
可以证明[12,13], 当荧光的衰减过程符合单指数衰减规律(即I(t) =I(0)e–t/t,t为寿命)时, (3)式和(4)式算得的寿命tf和tm是相等的, 理论上只需要计算其中一个即可. 但假如荧光的衰减过程是两个或多个单指数衰减过程的组合(即双指数衰减或多指数衰减), 则情况更加复杂, 通常需要先在不同调制频率wi下重复测量多组fi和Mi, 并通过以下公式先计算出等效相移和解调系数再求解寿命, 即:
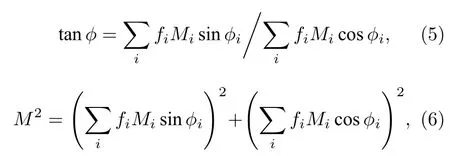
其中fi为第i个调制频率测得的光强占总光强的比例.
1984 年, Jameson 等[13]利用相量的概念对频域法FLIM 得到的数据进行几何表示, 他们利用单个像素点对应的解调系数M和相移f来构建一个相量, 即以M作为该相量的模, 以f作为该相量的辐角, 则可以认为相量与像素点是一一对应的, 相量图上一个相量的端点就代表了一个像素点的全部荧光寿命信息(如图1(b)所示). 该相量在实轴和虚轴的分量可用Weber 符号表示[14], 即:
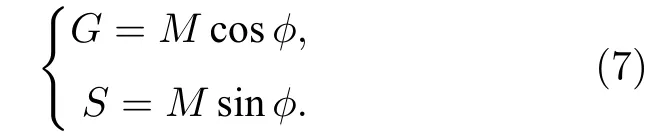
对于单指数衰减情形, 由(3)式和(4)式可得到cosf=M, 因此可以得到:
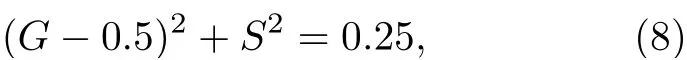
即以坐标(G,S)表示的相量端点被约束在圆心位于(0.5, 0)处、半径为0.5 的半圆上. 半圆上的每个点表示不同的寿命, 寿命值从左到右递减, 其中(1, 0)表示接近零的寿命, (0, 0)表示无限长的寿命, 如图1(b)所示.
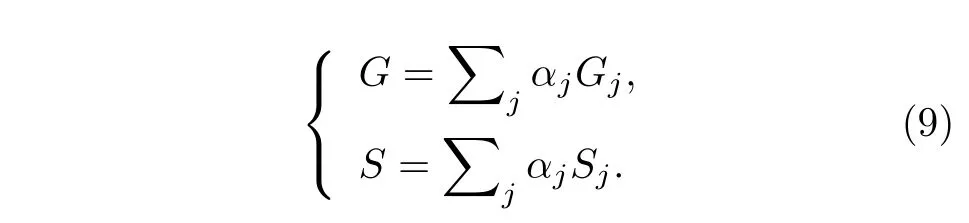
几何意义上, 多指数衰减过程对应的相量端点应位于其各个单指数衰减组分对应的寿命相量端点连接组成的集合内. 如图1(c)中, 双指数衰减过程对应的寿命相量端点(蓝色)落在半圆以内, 位于两个单指数衰减组分对应的寿命相量端点(绿色)的连线上, 且与两端点的距离(p1,p2)由两个组分的占比(a1,a2)决定.
2.2 时域法FLIM 及其相量分析
PA 法同样适用于时域法FLIM 数据的分析.这里以目前应用最广泛的TCSPC-FLIM 技术为例. 如图1(d)所示, TCSPC 将每一次脉冲信号作为一个信号周期, 每个周期内当探测到第一个荧光光子时就在其到达时间对应的时间通道中进行计数, 经过多次累积即可建立一个反映荧光衰减过程的光子数-时间分布直方图, 用于求解荧光寿命.
2008 年, Digman 等[16]将Weber[14]于1981年提出的荧光脉冲响应的傅里叶分析方法用于TCSPC 技术, 并使用以下关系式计算相量端点坐标, 也可以将每个像素的全部荧光衰减信息转换为相量图上的单个点, 即:
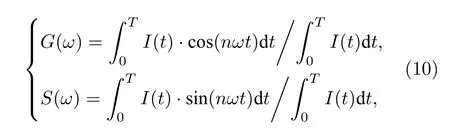
其中G(w)和S(w)分别是荧光脉冲响应傅里叶频谱的实部和虚部, 这里用作寿命相量的两个分量;I(t)是脉冲过后t时刻的荧光光强,w是脉冲激光的角频率,T是周期长度(实际可取动态范围),n是谐波的阶次, 一般情况下取基频分量, 即n=1. 因为TCSPC 是在N个离散的时间通道tk中记录荧光衰减分布直方图的, 因此上述积分运算可转化为求和计算:
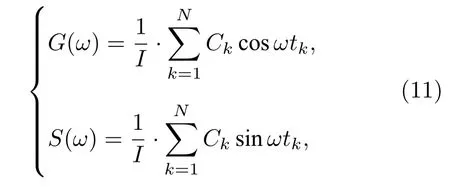
其中Ck是第k个时间通道记录的光子数,是所有时间通道记录的总光子数.
如果荧光脉冲响应呈单指数衰减规律, 则代入(11)式可得G(w)和S(w)与荧光寿命t的关系为:
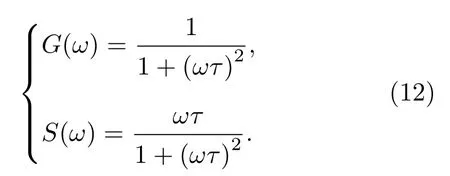
可以验证,G,S仍然满足(8)式的关系, 即单指数衰减情形下以坐标(G,S)表示的相量端点仍被约束在圆心位于(0.5, 0)处、半径为0.5 的半圆上, 与频域法得到的相量图一致.
而如果荧光脉冲响应是呈多指数衰减的, 则同样根据线性叠加关系可知, 坐标(G,S)表示的相量端点也位于半圆以内, 其中双指数衰减过程对应的相量端点也在其两个单指数衰减组分对应的相量端点连线上, 与频域法得到的结论一致.
2.3 相量图的特点及其典型应用思路
如前所述, 对于满足单指数衰减规律的情形,荧光寿命相量图上以坐标(G,S)表示的相量端点被约束在圆心位于(0.5, 0)处、半径为0.5 的半圆上, 而多指数衰减过程的相量端点则位于半圆以内, 具体地说, 是位于各单指数衰减组分相量端点连接组成的集合内. 例如, 对于双指数衰减情形,其寿命相量端点位于两个单指数衰减组分相量端点的连线上, 且位置与两个组分的占比有关. 相量图的这些特点, 使得其在荧光寿命数据的定量分析、可视化和聚类分析方面有很大优势.
如前所述, 荧光寿命反映的是荧光分子从激发态回到基态的退激发速率, 因此当处于激发态的荧光分子所处的微环境不同, 或者荧光分子与其他分子发生相互作用和能量转移时, 荧光寿命会发生灵敏的变化. 所以, 许多荧光团存在两个甚至两个以上的衰减速率, 分别对应于荧光团的不同状态, 例如细胞内的还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)处于自由态时(主要位于细胞质中)的荧光寿命为几百皮秒(t1), 与蛋白质绑定后处于结合态时(主要位于线粒体中)的荧光寿命则达到几纳秒(t2)[6].2005 年Brid 等[17]利用干扰NADH/NAD+比例的代谢药物氰化钾(Potassium cyanide, KCN)阻断细胞的呼吸作用, 证明了细胞中自由态和结合态NADH 的占比与NADH / NAD+比例有关, 从而提出利用FLIM 测量自由态和结合态NADH 的比例, 来间接获得活细胞内的NADH/NAD+比例.NADH 与其氧化形式NAD+作为生物体内许多氧化还原反应的辅酶参与生命活动并相互转化, 它们之间的平衡反映了氧化磷酸化和糖酵解的比率, 因此NADH/NAD+比例及其变化可用于监测细胞代谢方式的变化. 对于细胞内NADH/NAD+比例的探测, 传统的方法有酶循环法、毛细管电泳法、质谱分析法等, 但这些方法只适用于对细胞提取物进行检测. 直接对细胞内NADH/NAD+比例进行探测也可以采用荧光强度成像的方法, 这是因为NADH 发荧光而NAD+不发荧光. 但由于荧光团浓度的不均一性以及自由态和结合态NADH 荧光量子产率的不同, 基于强度成像的NADH/NAD+测量结果通常存在较大误差. Brid 等[17]的工作为定量监测活细胞内NADH/NAD+的比例提供了一种新的思路, 即通过FLIM 定量测量自由态和结合态NADH 的比例来间接获得NADH/NAD+比例. 他们的研究还表明, 当NADH/NAD+比例发生变化时, 自由态和结合态NADH 的荧光寿命值(即t1和t2)几乎保持恒定, 变化的是它们各自的占比(即a1和a2). 多指数衰减情形的寿命相量与其各个单指数衰减组分寿命相量之间的线性关系,使得采用了PA 法分析荧光寿命的phasor-FLIM 特别适合于在已知单指数衰减组分寿命的前提下, 对多组分尤其是双组分中不同组分的占比进行定量分析. 所以, phasor-FLIM 的典型应用之一, 就是根据寿命相量端点的位置对NADH 两种寿命组分的占比进行定量分析, 从而用于细胞代谢状态的测量[18−27].
此外, 在利用荧光共振能量转移(fluorescence resonance energy transfer, FRET)对蛋白质相互作用进行研究的FLIM-FRET 实验, 以及一些利用FLIM 研究细胞微环境参量变化的场合, 也会涉及到双指数衰减甚至多指数衰减及其组分占比的变化, 因此phasor-FLIM 在这些应用中的报道近几年也多了起来[28−34].
其次, PA 法生成的相量图中, 具有相似荧光衰减特征的像素点所对应的相量端点会显示在相近的位置, 因而形成一定的簇状分布(如图2(a)和图2(b)所示), 称为“相量簇”. 同一个相量簇对应于具有相似荧光衰减特性的多个像素点, 但这些像素点在样品中的分布可以是不连续的, 和它们的空间分布并没有直接联系. 利用该特点, 可在相量图上选取感兴趣的相量簇, 并通过其对应关系找到相量簇中各相量端点所对应的像素点在样品上的位置, 就可以方便地将样品中具有相似荧光寿命特征的区域标记出来(如图2(c)所示), 还可以进一步对这些荧光寿命特征相似的区域进行聚类分析, 从而为研究一些生物医学问题带来极大的便利[18−20].倘若对不同的相量簇对应的像素点赋以不同的伪彩色, 则利用该方法还可以方便地实现荧光寿命图像的多色显示(如图2(d)所示), 从而起到辅助病理判断等作用[35−37]. 最近, 这种利用PA 法对荧光寿命的分布进行聚类分析的方法还被应用于辅助提高基于受激辐射耗尽(stimulated emission depletion, STED)的超分辨成像的分辨率[38−40].
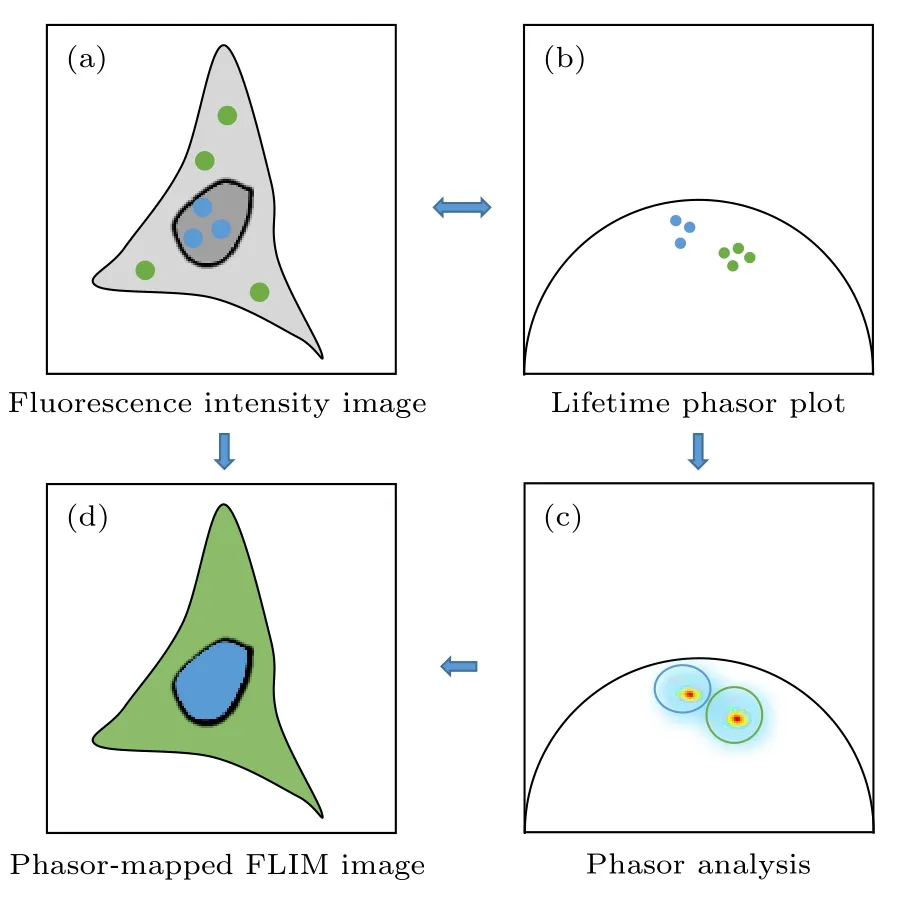
图2 Phasor-FLIM 的应用思路示意图 (a)包含未处理寿命信息的荧光强度图; (b)经PA 法分析得到的寿命相量图; (c)对寿命相量直接进行分析; (d)通过相量聚类分析和伪彩色标记得到的荧光寿命图Fig. 2. Schematic diagram of phasor-FLIM application:(a) Fluorescence intensity image with untreated lifetime information; (b) lifetime phasor plot obtained by PA analysis;(c) direct analysis of lifetime phasors; (d) phasor-mapped FLIM image based on phasor clustering analysis and pseudo-color assignment.
综上, 目前phasor-FLIM 的应用可以用图3来表示. 以下将举例说明phasor-FLIM 的应用研究进展.
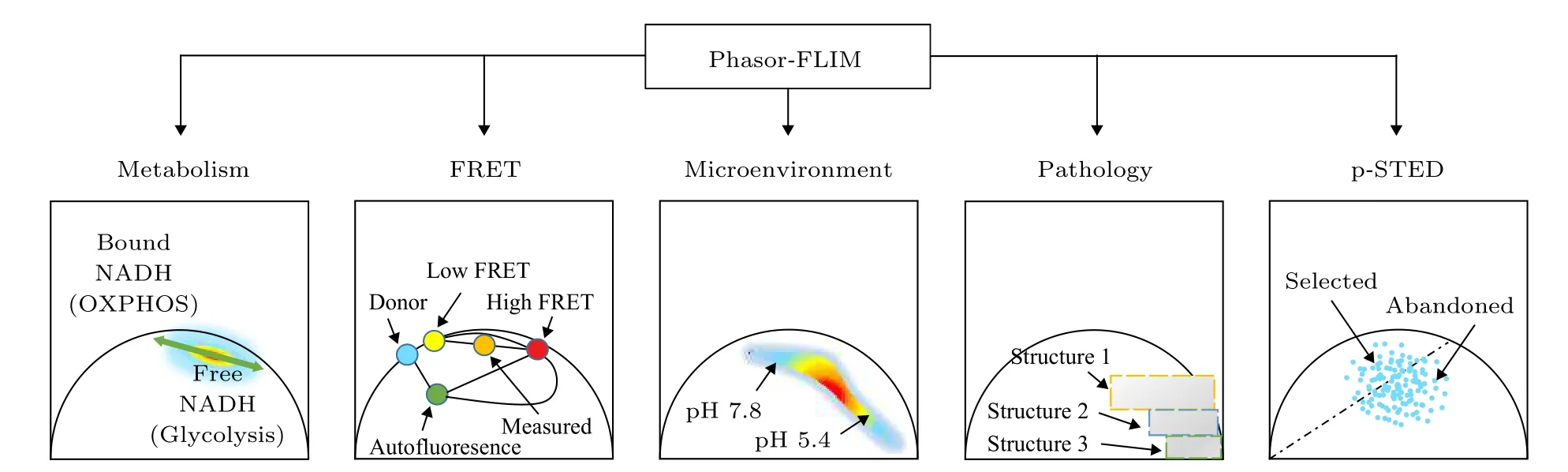
图3 Phasor-FLIM 的应用分类示意图Fig. 3. Application classification diagram of phasor-FLIM.
3 Phasor-FLIM 的应用研究进展
3.1 基于NADH 的细胞代谢应用研究
细胞的能量主要来自细胞呼吸, 正常细胞或正常分化的细胞在有氧条件下采用糖酵解进行代谢,缺氧条件下通过氧化磷酸化进行代谢. 而高度增殖的细胞(如癌细胞或干细胞)即使在氧气充足的条件下也多选择糖酵解作为主要的产能方式, 这种现象被称为“Warburg 效应”[41]. 而这种细胞代谢方式的不同导致两者所含NADH 的浓度和状态存在差异. 因此基于前面提到的NADH 处于两种不同状态具有不同荧光寿命的特性, 以NADH 作为内源荧光标志物的双光子FLIM 成像常被用于研究正常细胞、干细胞、癌细胞以及其他疾病发生时细胞的代谢差异, 而结合了PA 法的phasor-FLIM可方便地实现活组织中单细胞代谢表型的观测, 在细胞分化和增殖、疾病的机理研究和诊断等方面均具有很好的应用前景, 目前也取得了一些重要的应用研究进展.
细胞分化和增殖过程会改变糖酵解和氧化磷酸化之间的平衡, 所以代谢变化可用于研究细胞分化和增殖状态. Stringari 等[18−20]通过对细胞内包括NADH 在内的各种内源性荧光标志物进行FLIM 成像, 并利用PA 法对FLIM 图像进行分割,可以区分胶原蛋白、视黄醇、视黄酸, 以及处于自由态和结合态的NADH. 他们对小肠进行双光子FLIM 成像并对利用PA 法得到的寿命相量簇进行聚类分析, 用来识别高度增殖的小肠干细胞, 通过代谢状态对小肠干细胞和分化的后代进行分类分析, 以监测与代谢变化相关的生理(病理)过程.Lee 等[21]对白细胞和白血病细胞进行FLIM 成像,因为白血病细胞快速增殖, 糖酵解占主导地位, 寿命相量簇向短寿命方向移动, 利用PA 法定量分析自由态和结合态NADH 比例的变化, 可从血液中快速筛选和分离白血病细胞. 与传统的生物分子诊断技术相比, 这种基于phasor-FLIM 的单细胞筛查方法对细胞友好, 具有临床筛选血液细胞的潜力. 细胞外基质(extracellular matrix, ECM)是所有组织必不可少的动态组成部分, 并通过提供机械和生化信号来直接影响细胞行为. ECM 的变化可以改变组织的动态平衡, 从而潜在地促进细胞转化和肿瘤的发生. Romero-Lopez 等[22]将正常细胞接种在提取自正常人结肠和转移至肝脏的结肠肿瘤的ECM 中, 利用phasor-FLIM 技术定量分析了自由态和结合态NADH 的比例, 结果发现接种在肿瘤ECM 中的细胞比接种在正常ECM 中的细胞具有更高的游离NADH 水平, 糖酵解速率较高, 表明ECM 在癌细胞及其相关脉管系统的生长中起到了重要作用.
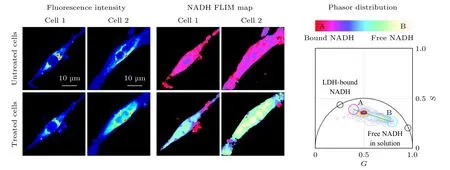
图4 Phasor-FLIM 用于分析细胞在缺氧和线粒体毒性药物氰化钾刺激下NADH/NAD+比例的变化, 研究代谢状态的转变[27]Fig. 4. Phasor-FLIM was used to analyze the change of NADH/NAD+ ratio under the stimulation of hypoxia and mitochondrial toxic drug potassium cyanide, for studying the change of metabolic state of cells[27].
由于许多疾病的发病机制与细胞代谢也有着密切的关联, phasor-FLIM 在疾病的机理研究及诊断方面也有不少应用实例. 例如, 亨廷顿病(Huntington’s disease, HD)是一种常染色体神经退行性疾病, 能量代谢障碍是HD 的主要发病机制. Sameni 等[23]使用phasor-FLIM 来定量测量HD 中自由态和结合态NADH 的比例变化, 作为活细胞代谢变化的间接测量, 用以研究HD 发病机制, 结果表明HD 的代谢障碍为糖酵解增加, 导致氧化应激和细胞死亡. 这种定量分析的方法可用于筛选HD 组织并进行潜在的药物筛选, 对诊断和治疗疾病具有重要意义. 阿兹海默症(Alzheimer’s disease, AD)是一种老年人多发的神经退行性疾病, 与抗氧化保护降低和线粒体功能障碍有关.Dong 等[24,25]使用双光子激发FLIM 技术结合PA 法定量分析了老年小鼠海马区神经元游离NADH 的水平, 结果发现随着年龄的增加, 游离的NADH 浓度降低, 氧化磷酸化占据主导地位,AD 进一步恶化, 而还原性治疗可恢复老年小鼠及AD 小鼠神经元中游离NADH 的水平. Hato 等[26]则采用类似的方法对活体小鼠肾脏进行双光子FLIM 成像, 使用PA 法分析肾脏中的代谢变化,提供了一种研究肾脏疾病代谢的方法. Datta 等[27]通过双光子FLIM 对人诱导多能干细胞分化的心肌 细 胞(human induced pluripotent stem cellderived cardiomyocytes, hiPS-CMs)进行成像, 检测缺氧和线粒体毒性药物氰化钾病理刺激下代谢状态的变化. 如图4 所示, 缺氧状态下和用药物刺激时hiPS-CMs 的寿命相量分布向自由态NADH的方向移动, 代谢方式转变为糖酵解. 这种非侵入性成像技术有助于研究心脏病的发病机理和治疗方法[27].
3.2 基于FLIM-FRET 的蛋白互作研究
当一个荧光分子(供体)的荧光发射光谱与另一个荧光分子(受体)的激发光谱相重叠, 且两者间的距离合适(一般为6—10 nm)时, 供体的激发能诱发受体发出荧光, 同时其自身的荧光强度发生衰减, 称为FRET 效应. 由于该效应发生的程度(即FRET 效率)与供体和受体的距离紧密相关,该效应常被用于研究蛋白质间的相互作用(简称“蛋白互作”). 具体的做法是将供体荧光分子和受体荧光分子分别标记于两个蛋白质分子上, 通过测量FRET 效率来反映两个蛋白质之间的距离, 从而反映其是否发生相互作用以及相互作用的程度.从荧光寿命的角度看, 当FRET 效应发生时, 由于供体将能量转移到受体上, 供体的荧光寿命将变短. 考虑到FLIM 测量不受光漂白等因素的影响,利用FLIM 进行FRET 效率的测量比测量荧光强度变化的方法要更加准确, 因此FLIM-FRET 已被广泛应用于蛋白互作的研究. 发生和不发生FRET(或者说FRET 效率很高和很低)两种状态下供体的寿命可认为是不变的, 相当于两个单指数衰减组分, 因此根据PA 法的分析, 两种状态下得到的寿命相量应位于半圆上. 而当部分供体发生FRET 时, 总体的荧光衰减满足双指数衰减规律,寿命相量端点将位于上述两个单组分寿命相量端点的连线上, 且到两端的距离与两种组分的占比有关, 由此可方便地计算出FERT 效率. 2012 年和2013 年, Hinde 等[28,29]利 用 phasor-FLIM 和FRET 监测了小G 蛋白与RBD 蛋白在溶血磷脂酸(lysophosphatidic acid, LPA)刺激下相互作用的变化, 结果表明, 在荧光强度图像看不出明显差异的情况下, FLIM 图像和PA 定量分析均显示小G 蛋白与RBD 蛋白的标签蛋白EPCF 和Critine在LPA 刺激下FRET 效率显著增加(如图5 所示). Lou 等[30]在 共 表 达H2B-eGFP 和H2BmCherryrry两种荧光蛋白的Hela 细胞中利用phasor-FLIM 测得的FRET 效率对核小体的紧实度进行了量化, 用于定量反应DNA 的损伤情况.
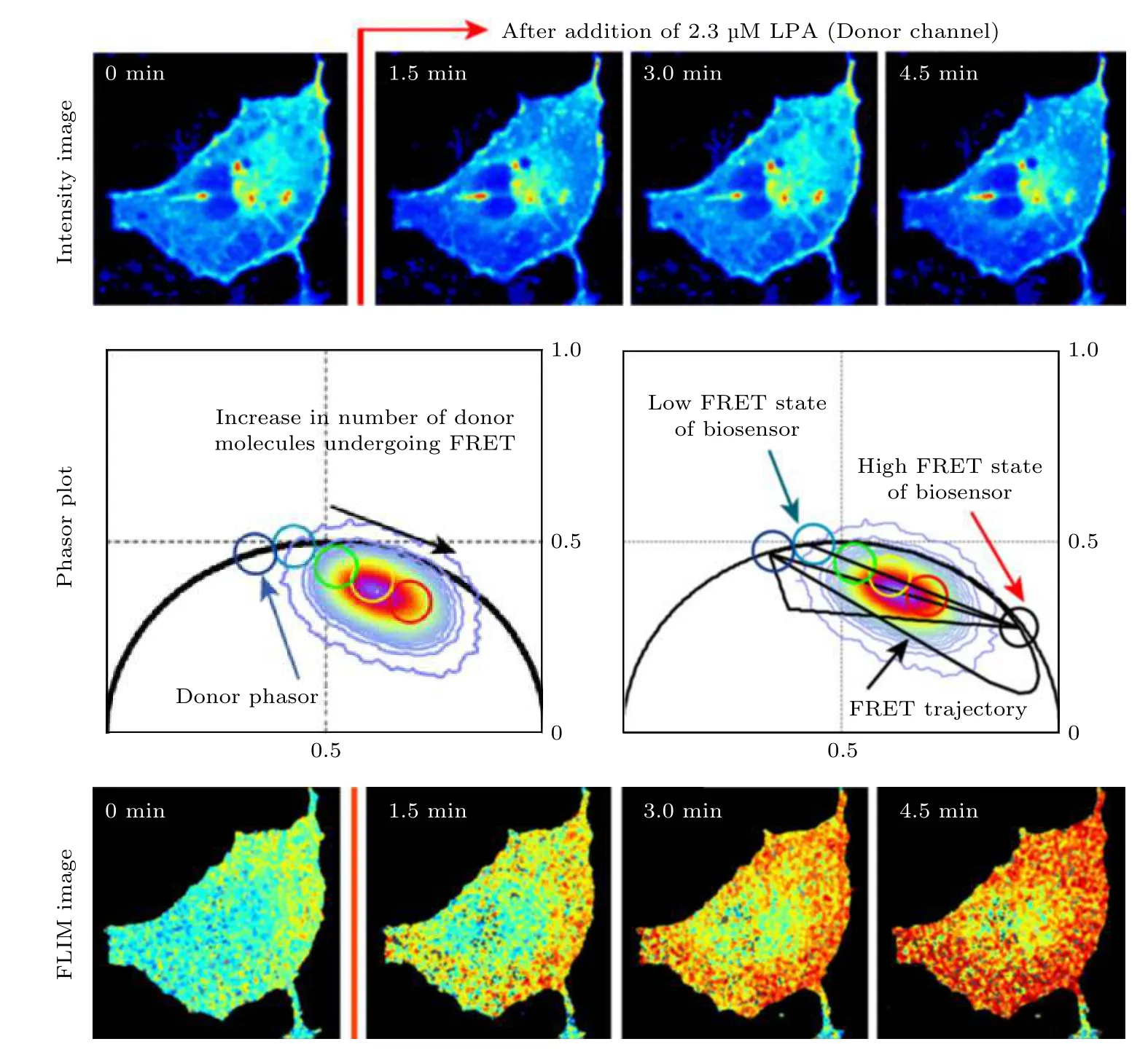
图5 Phasor-FLIM 用于定量测量RhoA-kRas 单链生物传感器的荧光共振能量转移(FRET)效率, 研究蛋白互作[28]Fig. 5. Phasor-FLIM was used in quantitative FRET efficiency detection of a RhoA-kRas single chain biosensor, studying interaction between proteins[28].
3.3 基于敏感探针的细胞微环境参量测量
由于荧光寿命与荧光分子所处的微环境密切相关, 因此采用一些对细胞中某种微环境参量(如温度、pH 值、离子浓度、黏度等)特别敏感的荧光探针对这些微环境参量及其变化进行定量测量是FLIM 的常规应用. Chen 等[31]将PA 法应用于温度的FLIM 测量, 通过荧光分子罗丹明B 的寿命相量图定量分析比较了Hela 细胞在8 种不同温度下寿命相量簇的分布变化. Battisti 等[32]采用具有pH 依赖性的荧光团E2GFP, 利用phasor-FLIM 将所有的实验图像在同一个相量图上进行比较, 从而分析细胞在生理状态和非生理状态下pH 值的变化(如图6 所示). 深圳大学Zhou 等[33]使用phasor-FLIM 分析监测了pH 敏感的细胞间纳米药物的释放. 他们合成聚合物纳米颗粒PAHCit/DOX, 用于阿霉素(DOX)在癌细胞中的有效释放, 并对其释放过程进行了监测. 具体来说, 这种PAH-Cit/DOX 纳米颗粒在生理pH 下稳定, 但在弱酸性条件下能够有效释放DOX. 同时, 他们采用phasor-FLIM 对该纳米粒子在癌细胞中释放DOX 的荧光寿命进行了监测, 从而提供了一种评估纳米载体药物释放效率的方法. Ferri 等[34]则开发了一种基于BODIPY 的黏度敏感荧光分子BoMe, 将BoMe 与phasor-FLIM 相结合用于评估早衰综合症(Hutchinson-Gilford progeria syndrome,HGPS)细胞内的黏度.
3.4 辅助病理诊断
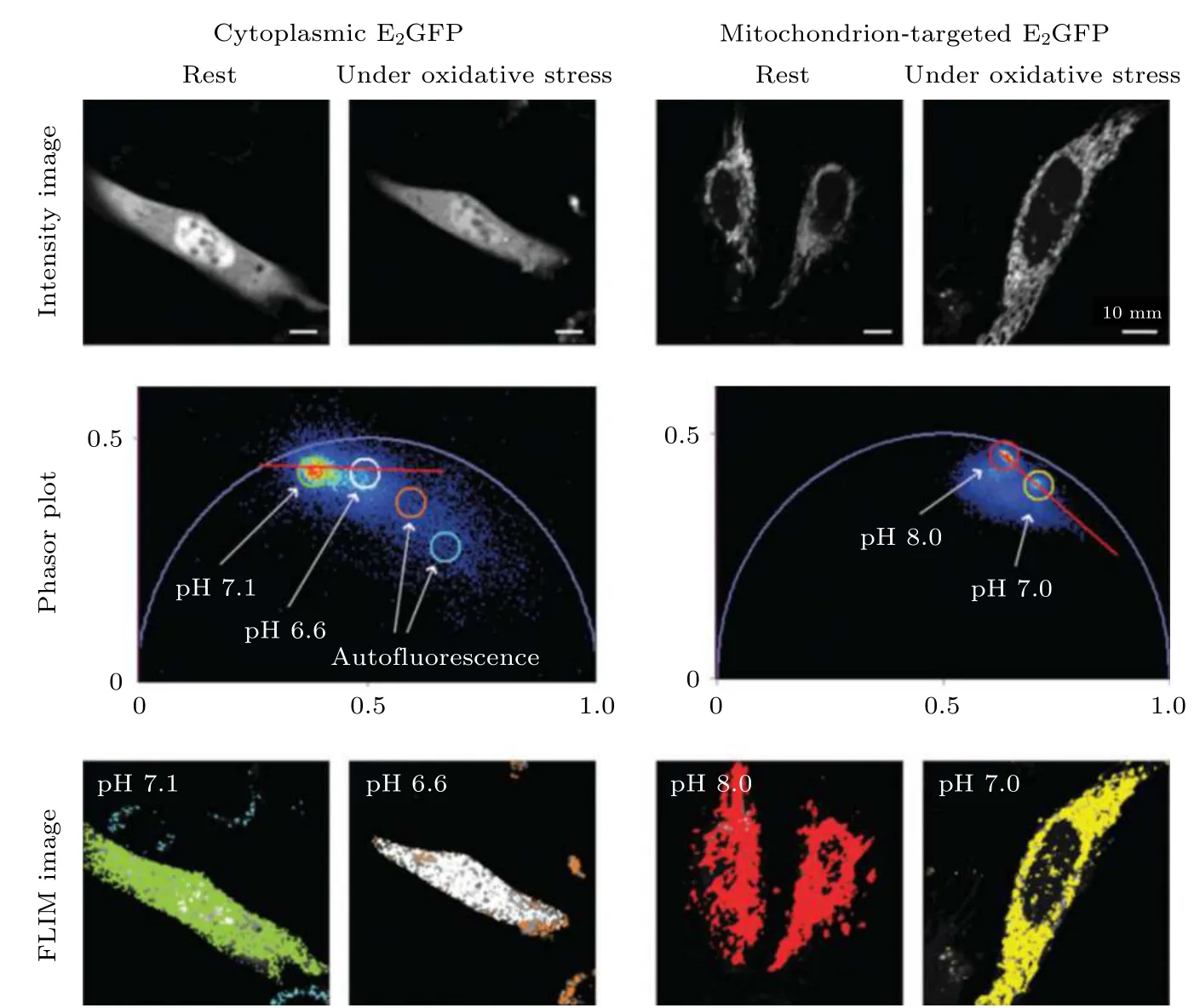
图6 Phasor-FLIM 用于分析细胞在正常(静止)状态和氧化应激状态下pH 值的变化[32]Fig. 6. Phasor-FLIM was used to analyze the changes of pH value of cells in normal state (at rest) and under oxidative stress[32].
非黑色素瘤皮肤癌(non-melanoma skin cancers, NMSC)是白种人群体中最常见的肿瘤疾病, 光化性角病(actinic keratosis, AK)、博文病(Bowen disease, BD)、基 底 细 胞 癌(basal cell carcinoma, BCC)和浸润性鳞状细胞癌(invasive squamous cell carcinoma, SCC)都是其常见的亚型. 该类型皮肤疾病的临床症状很不明显, 因而采用活组织实现对NMSC 的诊断比较困难, 目前临床上主要是通过对苏木精和伊红(hematoxylin and eosin, H&E)染色切片的形态学特征分析来进行诊断. 但这种方法鉴别与诊断上述不同NMSC亚型的准确性通常与病理学家的专业知识、技能和经验有关, 可能会导致不同人员鉴别与诊断的结果存在巨大差异, 主观性大, 出错概率较高, 影响后续治疗. 2017 年, 深圳大学的Luo 等[35]对H&E 染色的皮肤病理切片进行了双光子FLIM 成像, 并结合PA 法定量分析了AK, BD, BCC 这三种类型的皮肤肿瘤对应的寿命相量簇分布情况, 结果表明不同皮肤肿瘤疾病的寿命相量簇其坐标值、角斜率、相量面积分布均存在差异, 提示phasor-FLIM 技术可为鉴别诊断这些皮肤肿瘤疾病提供一种简便可行的组织病理学分析方法, 其准确性和客观性相对于明场H&E 诊断将有显著提高. 此外,他们还采用PA 法对H&E 染色的BCC 细胞切片的荧光寿命数据进行了半定量分析[36], 并通过聚类分析对不同的相量簇赋以不同的伪彩色, 从而使FLIM 图像上的病理学特征更加明显, 可进一步辅助病理诊断和促进细胞病变及发展机理方面的深入研究(如图7 所示).
输尿管的阻塞会增加肾小管的压力, 降低肾小球的滤过率, 并通过肾脏激活许多血管活性激素和细胞因子, 导致纤维化. 临床上常用Picrosirius 红或Masson Trichrome 染色的组织切片, 依靠病理学家专业的知识来诊断间质纤维化. Ranjit 等[37]利用phasor-FLIM 研究了小鼠肾脏单侧输尿管梗阻(unilateral ureteral obstruction, UUO)纤维化的发展过程, 根据相量分布的平均位置、形状、角度和数目, 区分了健康组织和病变的纤维化组织,同时可以从FLIM 图像定量得到纤维化程度, 可用于监测疾病发展或治疗效果.
3.5 提升超分辨成像分辨率
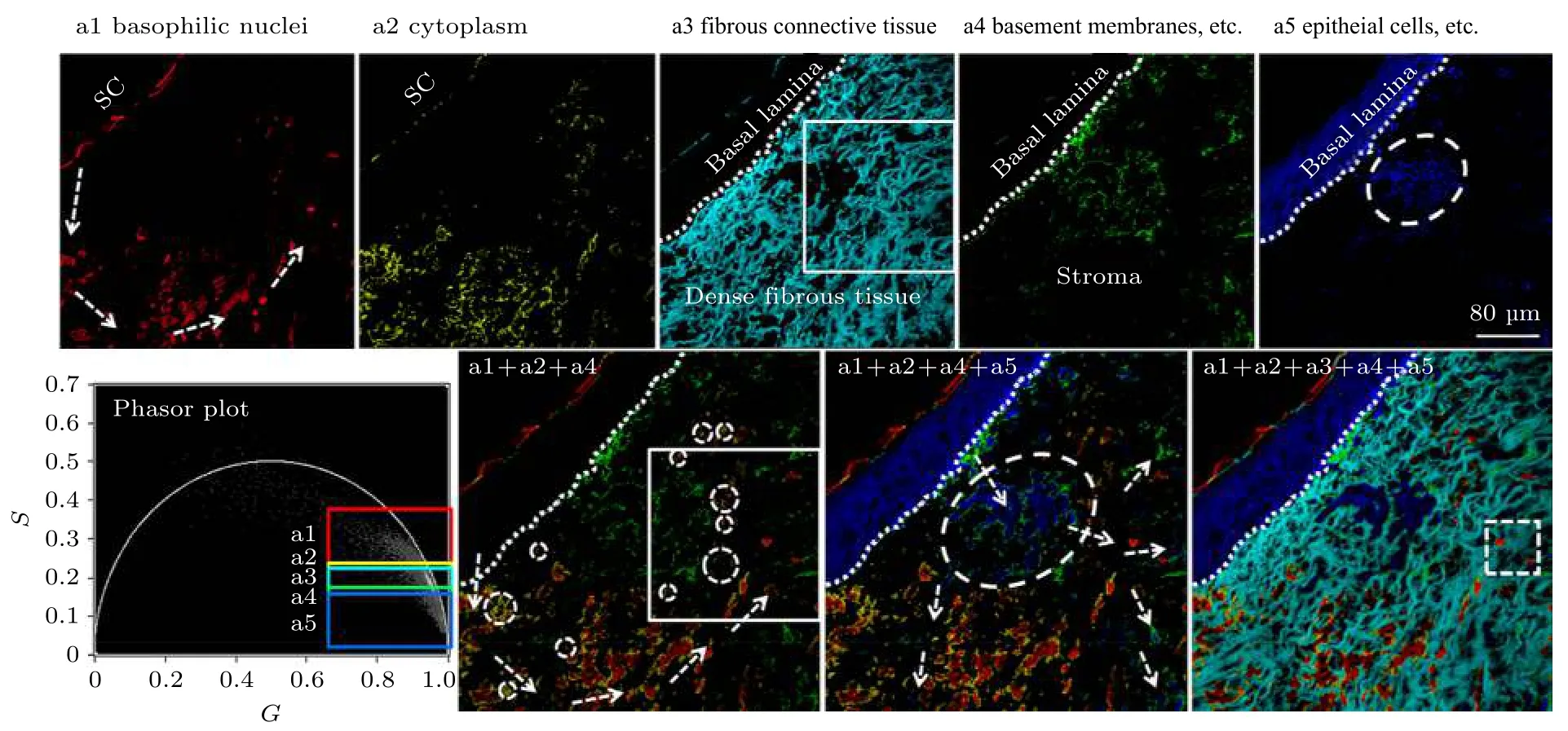
图7 Phasor-FLIM 聚类分析和伪彩色标记用于增强H&E 染色基底细胞癌(BCC)切片病理学特征的可视化, 可辅助病理诊断[36]Fig. 7. Phasor-FLIM clustering analysis and pseudo-color assignment was used to enhance visualization of pathological features of basal cell carcinoma (BCC) sections stained with H&E, assisting pathological diagnosis[36].
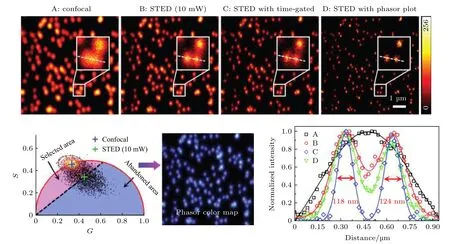
图8 Phasor-FLIM 聚类分析用于滤除受激辐射耗尽(STED)成像中环形擦除光区域的光子, 可辅助提升超分辨成像分辨率[39]Fig. 8. Phasor-FLIM cluster analysis was used to filter out the photons in the annular depletion region in stimulated radiation depletion (STED) imaging, improving the resolution of super-resolution imaging[39].
STED 技术是近年来发展起来的一种超分辨显微成像技术, 在“突破”分辨率极限和相关应用方面都取得了显著成果[42]. 该技术使用高强度环形擦除光使衍射极限范围内除中心点以外的荧光分子发生受激辐射而不产生荧光(称为“擦除”), 从而有效减小系统的点扩散函数获得超分辨率. 提高擦除光功率可进一步提高分辨率, 但代价是增加了光漂白、光毒性和反斯托克斯发射背景, 从而降低了信噪比, 并严重限制了STED 技术在活细胞成像中的应用. STED 中擦除光的作用, 是使处于激发态的粒子发生受激辐射而迅速跃迁回基态, 相当于缩短了这部分荧光分子的寿命. 因此, 受到擦除光照射的荧光分子与未受到擦除光照射的荧光分子会分布在相量图中的不同位置, 对寿命相量进行聚类分析, 可将两种状态下的荧光分子分离. 2015年, Lanzanò等[38]利用该原理, 将phasor-FLIM与STED 结合, 在较低擦除光功率的条件下通过滤除掉环形区域的光子实现了与较高擦除功率相当的分辨率. 2018 年, 深圳大学的Wang 等[39]也将phasor-FLIM 应用于STED, 通过只选择激发光斑中心未被擦除光照射的目标光子进行图像重构, 从而在不增加擦除光能量的前提下成功将 光 子 进 行 分 离, 将 分 辨 率 从150 nm 提 升到80 nm (如图8 所示). 类似地, Tortarolo 等[40]也利用PA 法实现了光子分离, 提出了pSTEDSPLIT 方法, 在不增加擦除光功率的前提下可有效提高分辨率.
4 总结与展望
FLIM 技术通过采集荧光探针分子的寿命信息进行成像, 具有特异性强、灵敏度高、可定量测量的优势, 常用于探测细胞微环境参量分布、能量代谢状态, 表征材料内部结构及性质等方面, 因而在生物医学、材料学等诸多领域有广泛的应用. 为了从采集到的大通量寿命数据中快速精准地获取样品内部的结构与功能信息, 发展一种简单快速而且实用的寿命数据分析方法在实际生物医学应用中具有重要的意义. 近些年兴起的PA 法在频域计算寿命, 无需拟合, 分析简便, 对科研人员的专业知识背景要求不高, 因此发展和应用均非常迅速.相比传统的NL-LS 拟合, 该方法不仅分析速度快,相同寿命精度下要求的采集光子数少, 间接缩短了数据采集时间, 有利于发展快速FLIM 成像技术,而且能将具有相似衰减特征的像素点以“相量簇”的形式呈现, 具有强大的数据可视化功能, 也便于对数据进行聚类分析等, 因而在基于NADH 的细胞代谢状态测量、基于FLIM-FRET 的蛋白互作研究、基于敏感探针的细胞微环境参量测量和辅助病理诊断、提升超分辨成像分辨率等方面均取得了很好的应用研究进展. 基于此, 本文详细阐述了PA 法的基本原理及其运用方法, 并在此基础上介绍了运用PA 法的phasor-FLIM 在上述几个方面的应用实例, 着重讨论了PA 法在这些FLIM 应用实例中的优势所在, 为相关领域的研究提供有益的参考.
然而, 尽管近年来phasor-FLIM 在实际应用中已经取得了许多重要的研究进展, 但与此同时还存在一些局限性. 例如, 虽然PA 处理时对采集光子数的要求要比传统拟合算法低很多, 但是在快速FLIM 成像时当采集的光子数较少或信噪比较差时, 其相量簇的分布就会比较杂散, 据此分析得到的结果可靠性往往不够高. 为了解决这一问题,目前已有报道将中值滤波、小波变换等图像处理方法应用于对低信噪比的寿命数据进行预降噪处理,以提高荧光寿命分析的精度. 此外, 为了获取可靠的荧光寿命计算结果, PA 法处理前通常需要利用系统的仪器响应函数加以校准, 相比无需校准的衰减曲线尾部拟合的方法要多一个步骤, 对非专业人员而言有时候不够便利. 但是即便如此, 相信随着生命科学对快速定量成像需求的日益增加以及PA 法的进一步发展完善, phasor-FLIM 一定会有越来越广泛的应用前景, 在生物医学等领域发挥越来越重要的作用.
