一种用于线粒体受激辐射损耗超分辨成像的新型探针*
2020-08-29张佳SamantaSoham王佳林王璐玮杨志刚严伟屈军乐
张佳 Samanta Soham 王佳林 王璐玮 杨志刚 严伟 屈军乐
(深圳大学物理与光电工程学院, 光电子器件与系统教育部/广东省重点实验室, 深圳 518060)
1 引 言
激光扫描共聚焦显微镜具有实时、非侵入、断层扫描、三维成像和分辨率高等优点, 是生物和医学等领域研究的重要工具[1]. 然而, 由于光学衍射极限的存在, 导致其空间分辨率无法突破半个波长, 限制了对细胞内超精细结构的研究. 打破衍射极限, 提高光学显微镜的分辨率, 从而揭示细胞内超精细结构的特征和动态过程, 已成为生命科学发展的迫切要求, 超分辨成像技术是解决这一问题的关键[2]. 通过科研工作者的不断努力, 近二十年来超分辨显微成像技术得到飞速发展, 分辨能力提高到亚细胞器和生物大分子尺度, 达到纳米量级的空间分辨率[2−15]. 虽然已报道的超分辨成像技术的种类很多, 但总体上可以将这些技术分为两类: 一类是基于光场调控的超分辨成像技术, 包括受激辐射损耗(stimulated emission depletion, STED)[9]、可逆饱和光学荧光跃迁(reversible saturable optical fluorescence transitions, RESOLET)[10]、基态光损耗(ground state depletion, GSD)[11]和结构光照明显微(structured illumination microscopy, SIM)[12]技术等; 第二类是基于单分子定位的超分辨成像技术, 包括光激活定位显微(photoactivated structured-illumination microcopy, PALM)[13]、随机光学重构显微(stochastic optical reconstruction microscopy, STORM)[14]和点 积 累 纳 米 成 像 显 微(point accumulation for imaging in nanoscale topography, PAINT)[15]等等. 在众多超分辨成像技术中, STED 是最早打破光学衍射极限的成像技术, 具有可直接获取图像、快速扫描、三维超分辨以及可深层成像等特点, 具有非常广泛的应用前景.
STED 技术通过纯光学方法实现对荧光团亮态和暗态的调控[16], 利用受激辐射效应来压缩发光点的点扩展函数(point spread function, PSF),从而绕过光学衍射极限限制. 通常情况下, 激发光斑为高斯型, 如果在激发光斑上套叠一个用于产生受激辐射的环形损耗光, 在重叠区域处于激发态的荧光分子将以受激辐射的形式迅速回到基态, 只剩下环形光斑中心区域的分子以自发辐射的形式发射荧光, 从而达到压缩点扩展函数的目的. 为了能有效迫使荧光团进入暗态, 激发光要先于损耗光(STED 光)约200 ps 到达样品, 且受激辐射过程必须先于自发辐射. 自发辐射通常在样品被激发后几个纳秒内(荧光团的激发态寿命)发生, 因此要在这个时间段内完成受激辐射过程. 由于时间范围很短, 以及荧光分子的受激辐射横截面很小, 要想完全耗尽重叠区域的荧光, 需要非常高的STED光强度. 另外, STED 系统的空间分辨率与STED光的强度成正比, STED 光强度越大, 系统的空间分辨率也就越高. 因此要达到高的空间分辨率, 一般情况下会导致样品的光漂白[17]和光毒性[18], 这对活细胞成像非常不利, 阻碍了STED 技术的应用和发展.
针对这些问题, STED 技术的发明人Hell 教授[18]于2013 年提出了利用时间门控探测技术, 在较低的能量下实现了分辨率的提升. 我们课题组于2018 年提出利用相图分析技术分离出具有长荧光寿命的光子, 来提高系统的空间分辨率, 或者在保持空间分辨率不变的情况下降低STED 光的功率[8]. 2017 年北京大学Liu 等[19]和华南师范大学Zhan 等[20]同时提出利用上转换纳米粒子实现STED 超分辨成像, 大大提高了抗光漂白特性. 同时也有许多其他量子点被用于STED 超分辨成像[21,22], 在保持高空间分辨率的同时具有很好的光稳定性, 并能承受高的激光功率和长的曝光时间.自适应光学像差校正技术也是降低STED 光强度和提高图像质量的有效方法之一[4−5,23]. 其他克服这些问题的方法还包括2013 年浙江大学Kuang 等[24]提出的一种类似于STED 的超分辨成像方法, 即荧光发射差分(fluorescence emission difference, FED)显微, 可实现低光功率超分辨成像. 虽然人们在STED 光学成像系统、方法和探针上做了很多改进, 也取得了很大进展. 但是系统和方法的改进毕竟有限, 量子点探针的靶向性和毒性依然是需要解决的难题. 虽然有商用的ATTO 系列STED 有机探针可以使用, 但这些探针只能用于制备固定样品, 染色过程很繁琐, 很难用于活细胞成像[25,26]. 因此, 非常有必要发展新型的具有较高的抗光漂白特性、低的光毒性、较好的生物靶向性和低的饱和擦除光功率, 可用于活细胞长时间成像的STED 探针.
线粒体通常被称为细胞的“动力工厂”, 是真核细胞最重要的细胞器之一. 线粒体最重要的作用是产生细胞中腺嘌呤核苷三磷酸(adenosine triphosphate, ATP), 为生物体提供能量, 是细胞进行有氧呼吸的主要场所. 线粒体具有典型的结构特征[27], 一般呈短棒状或圆球状, 在某些生物种类和生理状态下, 还可呈环状、线状、哑铃状、分杈状、扁盘状或其他形状. 成型蛋白介导线粒体以不同方式与周围的细胞骨架接触或在线粒体的两层膜间形成不同的连接, 可能是线粒体在不同细胞中呈现出不同形态的原因. 除了合成ATP 为细胞提供能量等主要功能外, 线粒体还承担了许多其他生理功能[28], 比如调节膜电位并控制细胞程序性死亡. 线粒体膜通透性的增加会诱导凋亡因子等分子释放进入细胞质基质, 破坏细胞结构. 线粒体在生物体中起着如此重要的作用, 生物学家们采用了多种方法来研究线粒体的精细结构和复杂的生物功能.
线粒体是对各种损伤最为敏感的细胞器之一.在细胞损伤时最常见的病理改变可概括为线粒体数量、大小和结构的改变, 可以通过观察线粒体的外形变化来判断细胞的健康状态. 多年来, 荧光显微镜是研究细胞动力学的有力工具, 已被用于对单个线粒体中特定蛋白的分析[29]. 但是线粒体的内膜尺寸小于光学衍射极限, 传统的荧光显微镜无法观察线粒体内膜的微结构以及一些相关的动态变化过程. 超分辨成像技术的出现, 为线粒体精细结构和功能的研究提供了非常好的工具[30].
本文找到了一种新型的可用于线粒体STED成像的有机探针. 该探针对线粒体的靶向性好, 具有较好的抗光漂白特性和较低的擦除光饱和强度,可用于活细胞长时间STED 超分辨成像. 在实验中, 对线粒体成像的最高分辨率可达62 nm. 该探针与STED 超分辨成像结合, 为活细胞线粒体精细结构和功能研究提供了新的手段.
2 基本原理
2.1 STED 显微镜的原理

1873 年德国物理学家Ernst Abbe 提出衍射极限的概念. 他指出, 由于光的衍射效应, 光学显微镜的远场分辨率不可能高于半波长, 衍射极限公式为λ为激发光波长,NA为物镜的数值孔径. 在很长一段时间里, 光学显微镜的最高分辨率被认为是无法突破衍射极限. 直到1994 年德国科学家Stefan W. Hell 基于受激辐射理论提出STED 超分辨成像方法, 其基本原理是, 首先使用一束光激发样品,然后使用另一束波长红移的环形光, 将激发光光斑周围的荧光损耗掉, 从而缩小激发光光斑, 以达到压缩有效点扩展函数的目的, 从而提高成像分辨率, 如图1 所示.
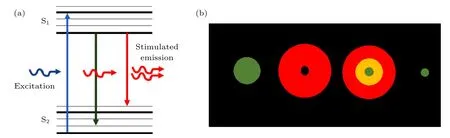
图1 STED 原理示意图 (a)受激辐射损耗能级图;(b)STED 光斑示意图Fig. 1. Schematic diagram of STED: (a) Diagram of energy level for stimulated emission depletion; (b) schematic diagram of STED light spot.
而且Hell[31]还通过总结大量的实验结果, 推导出了STED 显微镜的横向空间分辨率公式:
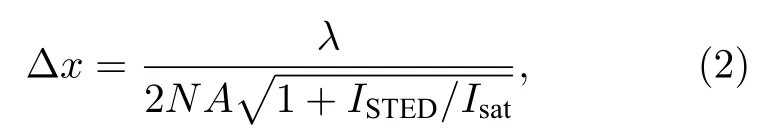
式中λ为激发波长,NA为物镜的数值孔径,ISTED为STED 光强度,Isat为饱和擦除光强度. 从(2)式可以看出, 横向分辨率与饱和擦除光强度Isat有关,Isat越低, 分辨率越高. 而饱和光强度Isat取决于材料本身的特性, 与荧光探针的受激辐射横截面积σ以及荧光染料的荧光寿命τ有关, 具体表达式为
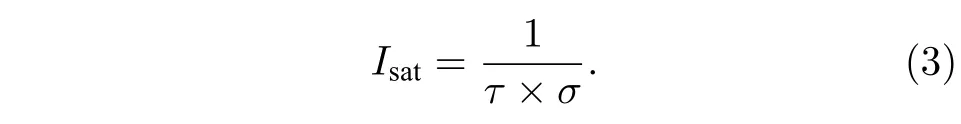
2.2 探针的机理分析
探针的化学结构和光谱表征结果如图2 所示.从图2 可见, 探针(命名为探针1)的激发峰值在578 nm 附近, 但是当探针1 和人血清蛋白(human serum albumin, HSA) 1∶1 混合后(命名探针2)吸收峰会蓝移到561 nm 附近(图2(b)所示). 图2(c)为两种探针的发射谱图, 可以看到两个探针的发射峰值都在683 nm 附近, 探针2 的发射谱完全覆盖探针1 的发射谱, 且其信号强度约为探针1 的10 倍. 由于两个探针的发射峰值都在683 nm 附近, 而探针2 的吸收峰发生了蓝移, 因此探针的斯托克斯红移由原来的105 nm 扩大到122 nm(如图2(d)所示). 通过加入HSA 使激发蓝移, 增大了激发和发射峰之间的红移, 斯托克斯红移较大的染料可以避免STED 光束对样品的二次激发, 在STED 成像中具有很大的优势.
HSA 是血液中最丰富的巯基化合物蛋白质,具有多种重要的生物学功能, 例如促进药物、脂肪酸和代谢物的运输, 同时在维持血液的渗透压中具有重要作用, 因此将HAS 与荧光染料结合, 有着重要的研究意义[32−35]. 已有报道表明小分子荧光探针与HSA 结合, 可以形成HSA-dye 纳米小颗粒[33],而且发现这些探针有助于提高信噪比, 主要是由于荧光探针与HSA 结合在生理条件和活细胞中会表现出对细胞器更高的选择性和灵敏度, 从而表现出荧光信号的增强, 同时具有较高的热稳定性和生物相容性[34−35], 该结论为探针2 的高性能表现在原理上提供了有力支撑.
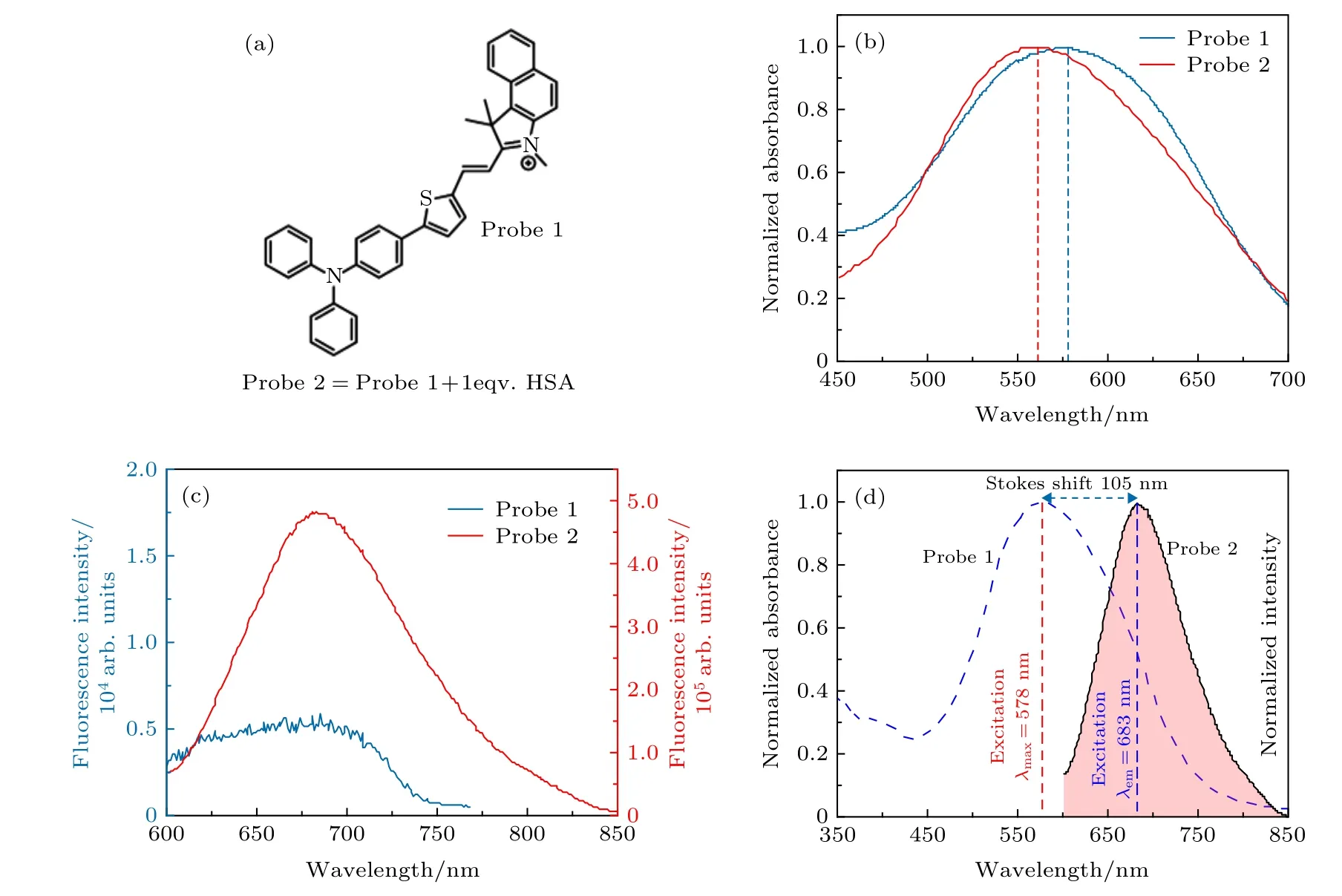
图2 目标探针的化学结构和光谱表征 (a)探针1 的化学结构; (b)探针1(蓝色)和2(红色)的激发谱; (c)探针1 (蓝色)和2 (红色)的发射谱; (d)探针1 的激发谱(蓝色)和2 的发射谱(红色)对比Fig. 2. Chemical structure and spectra characterization of target probe: (a) Chemical structure of probe 1; (b) excitation spectra of probe1 (blue)and 2 (red); (c) emission spectra of probe1 (blue) and 2 (red); (d) excitation spectrum of probe 1 (blue) and emission spectrum of probe 2 (red).
3 实验结果与讨论
3.1 共聚焦成像
本文制备的新型探针用于标记活细胞, 所使用的细胞均为HeLa 细胞. 染色方法为: 将状态较好的HeLa 细胞在培养箱(37 ℃, 5%CO2)中接种在30 mm 的共聚焦皿中, 探针1 与探针2 分别与活细胞在培养箱中共孵育15 min, 孵育好后在室温下用缓冲剂PBS 冲洗3 遍, 继而使用商用共聚焦显微镜(A1 R MP+, Nikon, Japan)记录图像, 结果如图3 所示. 相对于探针1 的共聚焦图像, 加了HSA 的混合液探针2 的共聚焦图像的荧光信号更强, 且定位更准确, 背景更加干净.
从图3 可以看出, 探针的两种形式都可以对线粒体进行标记, 但是相比较而言, 探针2 的定位效果更好, 图像的信噪比更高, 这与图2(c)的光谱结果一致, 因此选用探针2 对线粒体进行成像. 在此基础上, 对标记的条件进行了多项优化, 例如孵育时间和探针浓度等. 经过多次反复测试发现, 当孵育时间为15 min 时, 已有充足的探针分子进入细胞, 且具有良好的染色效果. 此外多次浓度测试结果表明, 在1 ml 培养基中, 使用1 µl 染料(染料原始浓度为0.2 mM)荧光图像效果最好, 即探针的最佳浓度为0.2 µM.

图3 用探针1 和探针2 标记的HeLa 细胞的共聚焦显微荧光图像, 比例尺为10 µm (a)探针1 的荧光成像; (b)探针2 的荧光成像Fig. 3. Confocal images of HeLa cells labeled with probe 1 and probe 2. Scale bar is 10 µm: (a) Confocal image of HeLa cells labeled with probe 1; (b) confocal image of HeLa cells labeled with probe2.
为了研究探针2 的定位效果, 使用商用的线粒体探针Mito Tracker Green FM(M7514, Thermo Fisher; 激发波长490 nm, 发射波长516 nm)和探针2 进行共定位实验. 把探针2 和Mito Tracker Green FM 同时放置在已接种好HeLa 细胞的共聚焦皿内, 置于细胞培养箱孵育15 min 后, 在室温条件下用PBS 进行洗涤, 可以减少背景干扰. 然后在商用的共聚焦显微镜下进行观察, 分别用488 nm的光激发Mito Tracker Green FM 和561 nm 的光激发探针2, 结果如图4 所示. 从图4(a)可以看到, 虽然商用的探针Mito Tracker Green FM 能够有效地标记线粒体, 但是线粒体周围还有较强的背景信号, 图像的信噪比较差. 图4(b)为探针2 标记线粒体的图像, 从图像上可以看到探针2 不仅能有效地标记上线粒体而且线粒体周围几乎没有背景信号, 这说明图像的信噪比要好于商用染料. 为了进一步研究探针2 的定位效果, 将探针2 与商用探针进行共定位对比, 图4(c)所示为两种染料共定位重叠后的图(绿色和红色叠加后呈黄色), 黄色区域越多说明探针2 的定位效果越接近商用染料, 此处用皮尔逊相关系数 Rr来表示探针和示踪剂的重合度, Rr值越大荧光共定位效果越好, 计算得到皮尔逊相关系数 Rr=0.769 , 该数值表明探针2 在线粒体的定位效果良好, 几乎与示踪剂Mito Tracker Green 重合. 而且在图4(c)中还可以看到图片的背景略显绿色, 这主要是商用染料背景信号较强造成的, 进一步说明探针2 不仅有接近商用染料的线粒体靶向性, 而且具有优于商用染料的信噪比.
3.2 STED 成像
首先需要确定探针2 的损耗光(STED 光)波长(本文使用的STED 系统中, STED 光可选择的波长有592, 660 和775 nm). 根据STED 的原理,STED 光的波长应尽量避开激发谱[36], 避免STED 光激发荧光. 参考图2 的结果, 探针2 的激发 峰 在561 nm 处, 发 射 峰 在683 nm 附 近.592 nm 与激发峰太近, 因此, STED 光可选的波长为660 和775 nm. 分别用1 µW 561 nm 的激发光, 20 mW 660 nm 的STED 光和20 mW 775 nm的STED 光激发样品, 结果如图5 所示, 从图5(a)可以看到, 当用561 nm 波长的激光激发样品时,荧光信号较强; 图5(b)是用660 nm 的光照射样品得到的结果, 荧光信号也比较强, 用其作为STED 光会对样品二次激发, 严重影响超分辨成像的质量, 因此660 nm 的光不宜作为探针2 的损耗光; 由图5(c)可以看出, 用775 nm 的光照射样品,几乎没有发射荧光, 也就是说, 775 nm 的光不会造成二次激发, 可以作为探针2 的损耗光.
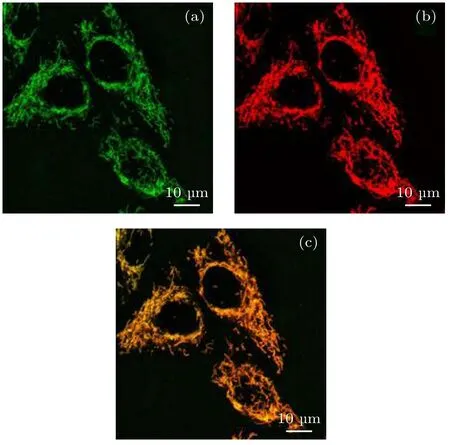
图4 用Mito Tracker Green FM 和 探 针2 共 处 理 的HeLa 细 胞 的 共 定 位 图 像,比 例 尺 为10 µm (a) Mito Tracker Green FM 标记的 细胞 图像; (b)探 针2 标记 的细胞图像; (c)图(a)和图(b)两者的重合Fig. 4. Co-localization images of Hela cells treated with Mito Tracker Green FM and Probe 2. Scale bar is 10 µm:(a) Image of Mito Tracker Green FM; (b) image of probe 2;(c) overlay of image (a) and (b).
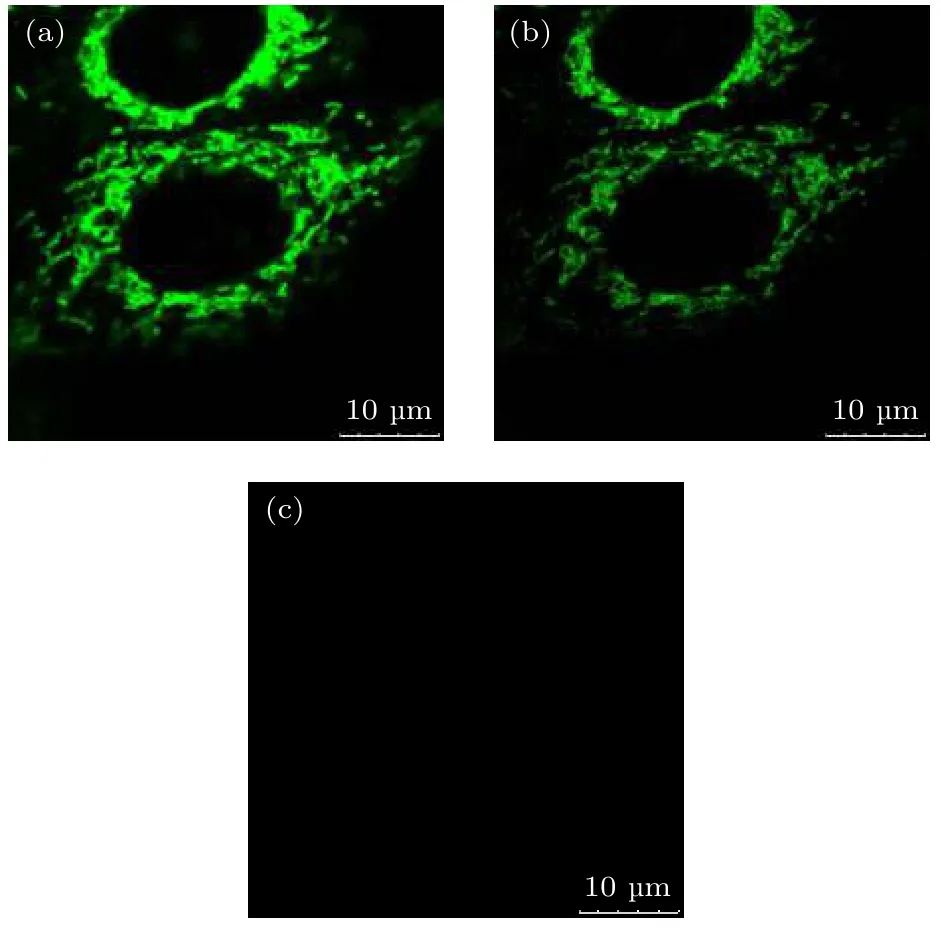
图5 三种不同波长的光单独照射样品时的细胞图像 (a) 561 nm 的光照射; (b) 660 nm 的光照射; (c) 775 nm 的光照射Fig. 5. Cell images illuminated by light of different wavelengths: (a) Illuminated by light of 561 nm; (b) illuminated by light of 660 nm; (c) illuminated by light of 775 nm.
接下来, 对探针2 进行STED 成像研究. 本实验所有的STED 超分辨实验均在商用的STED显微镜(Leica SP8, Leica, Germany)上完成, 该系统使用了80 MHz 且脉冲频率可调的超连续谱激光作为激发光. 根据探针的激发和发射谱(如图2所示), 以及图5 的结果, 探针2 的激发波长为561 nm, 选用波长为775 nm 的脉冲光作为STED光. 实验中选用100 × /NA 1.4 的STED 专用物镜 (HCX PL APO CS2 100× 1.40 oil, Leica Microsystems)进行成像, 探测器的光谱接收范围为650—750 nm.
将HeLa 细胞与探针2 孵育后进行STED 成像, 用功率为1 µW 的561 nm 激光激发样品, 用不同功率的775 nm 的STED 光作为损耗光, 成像结果如图6 所示. 结果表明, 当损耗光功率为19.75 mW 时, 图像的分辨率可以达到90 nm(如图6(b)和图6(e)所示). 与共聚焦图像(图6(a)和图6(d)所示)相比, 原本不能区分的线粒体内膜可以区分开来, 并且可以看到线粒体内部脊的细微结构. 进一步将损耗光功率增加到39.5 mW, 可以更清楚地观察到线粒体内部脊的结构(图6(c)和图6(f)所示), 最高分辨率可达62 nm.
在进一步的实验中, 评估了探针在STED 成像中的性能. 测量了探针2 在不同功率下的发射强度, 研究了发射损耗效率, 如图7(a)所示, 探针的发射强度随着损耗光强度的增强而迅速降低. 当功率为10 mW 时, 探针的受激辐射损耗比接近85%,而后荧光强度减弱速度明显变得缓慢; 当功率为30 mW 时, 达到95%的损耗效率, 高效的发射损耗比对提高探针的STED 纳米成像的横向分辨率非常有利, 至此功率的进一步增加并没有进一步提高损耗比. 为了研究探针2 在775 nm STED 光下的饱和受激辐射功率, 测量了不同功率下775 nm STED 光获得的横向分辨率, 结果如图7(b)所示.根据(2)式可以拟合计算得出, 探针2 在775 nm STED 光下的饱和功率为 Psat=3.5 mW (功率密度为1.1 MW·cm–2, 损耗光束的环形光斑区域面积3.18 × 10–9cm2).
3.3 抗光漂白测试
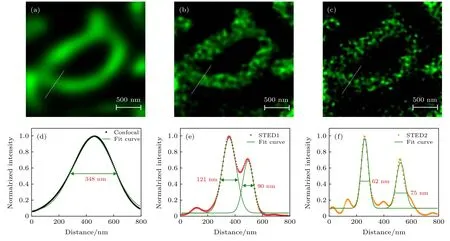
图6 用探针2 标记HeLa 的共聚焦和STED 图像, 比例尺为500 nm (a)共聚焦图像; (b)损耗光功率为19.75 mW 时线粒体的STED 图像; (c)损耗光功率为39.5 mW 时的线粒体STED 图像; (d)−(f)分别为图(a)−(c)中划线部分对应的信号曲线和分辨率Fig. 6. Confocal and STED images of HeLa cells labeled with probe 2. Scale bar is 500 nm: (a) Confocal image; (b) STED image of mitochondria obtained with 19.75 mW STED light; (c) STED image of mitochondria obtained with 39.5 mW STED light; (d)−(f)normalized signal intensity profiles along the lines in (a)−(c) respectively as well as the spatial resolutions.
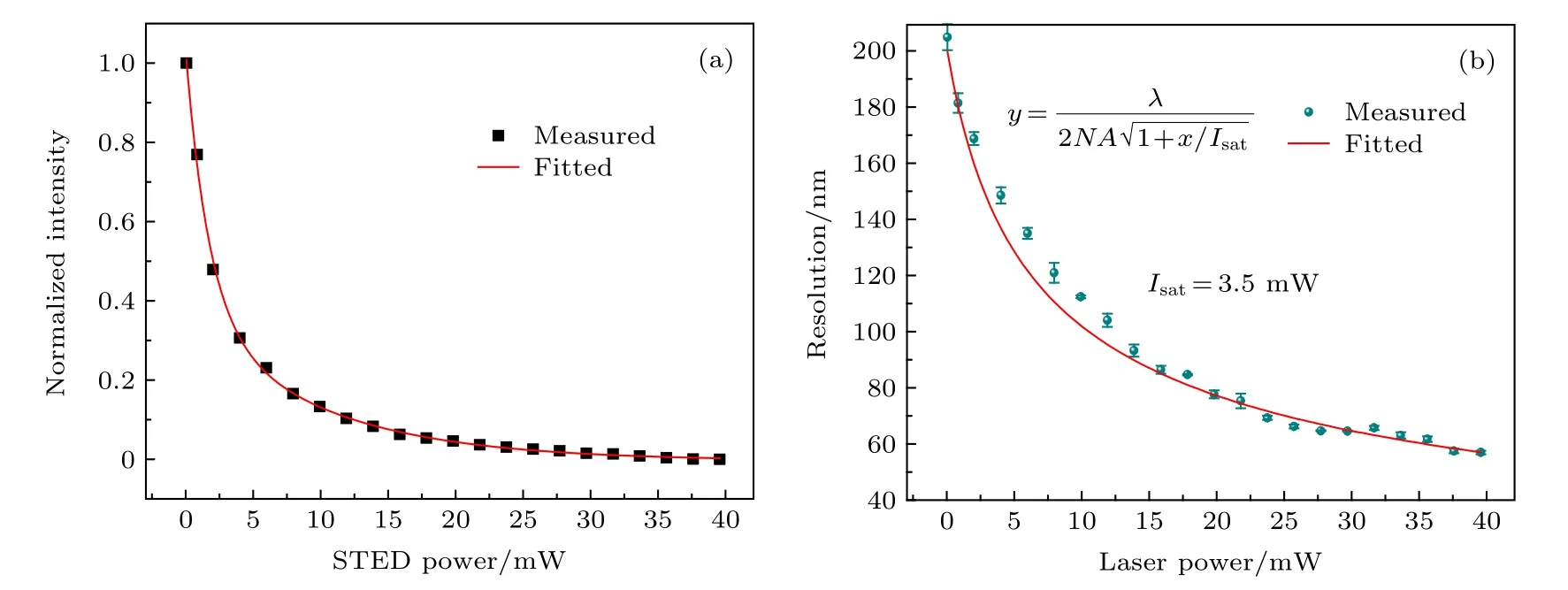
图7 STED 光功率对成像能力的影响 (a)探针2 的受激辐射损耗效率; (b)增加损耗功率情况下获得的STED 图像的分辨率Fig. 7. Effect of STED power on imaging performance: (a) Stimulated emission depletion efficiency of Probe 2; (b) resolution of STED images obtained at increased depletion power.
STED 成像对荧光探针的选择比共聚焦等其他成像技术有更高的要求, 抗光漂白特性是最重要的参考因素之一. 使用功率为19.75 mW 的STED光对染色处理好的样品进行多次扫描, 测试探针的抗光漂白特性, 结果如图8 所示. 图8 中的内插图给出了在第一次扫描后的荧光图像, 此时的荧光信号较强. 经过180 次扫描后, 依然可以清楚地看到完整的细胞形态. 经过长达360 次扫描后, 虽然细胞结构开始变得模糊, 但仍然可以看到细胞的荧光信号, 其信号强度相对第一次和180 次扫描后有明显减弱. 结果表明, 所制备的新型探针具有良好的抗光漂白特性, 适用于长时间STED 成像.
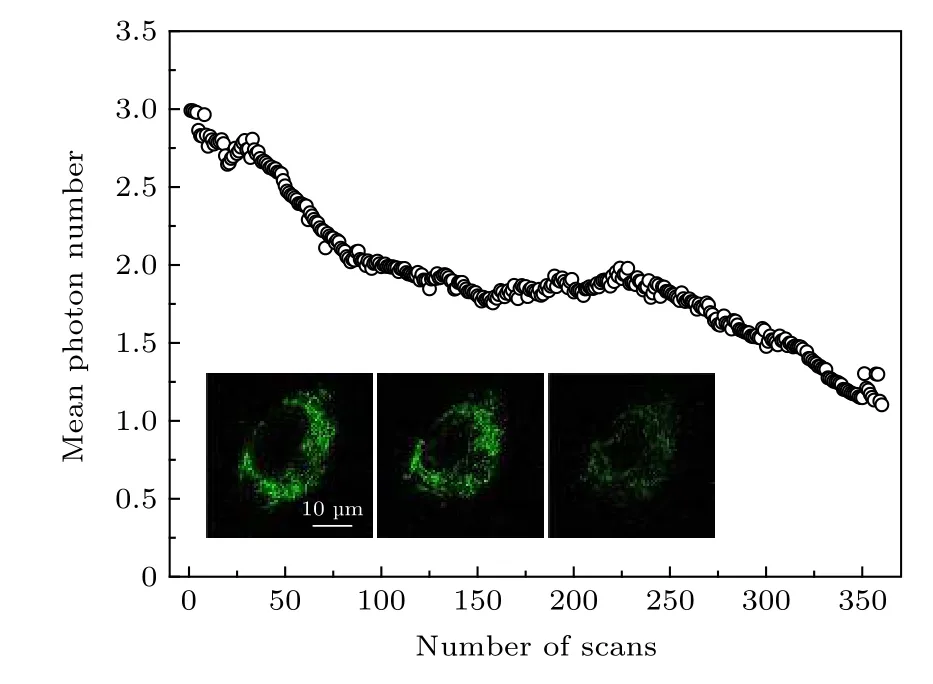
图8 探针的抗光漂白测试结果. 内插图分别为对单个细胞第1 次扫描、第180 次扫描和第360 次扫描后得到的图像, 比例尺为10 µmFig. 8. Results of bleaching test. Inset pictures are the images of single cell obtained after the first scan, 180 th scan,and 360 th scan. Scale bar is 10 µm.
4 结 论
本文找到了一种新型的可用于活细胞线粒体STED 成像的有机染料. 通过与商用的线粒体示踪剂对比研究发现, 该染料具有很好的线粒体定位效果. 利用该探针进行STED 超分辨成像, 发现其具有较低的饱和擦除光功率以及较好的抗光漂白特性, 最高可实现62 nm 的空间分辨率. 该探针非常适合于STED 超分辨成像, 为线粒体结构与功能的研究提供了有力工具, 在对线粒体相关疾病的研究中具有重要的意义和广阔的应用前景.
