牦牛SIRT1基因的克隆及其在不同发育阶段睾丸中的表达
2020-08-29秦文昌杨柳青周靖雯
殷 实,秦文昌,王 斌,杨柳青,周靖雯,李 键,2,3
(1.西南民族大学 生命科学与技术学院,四川 成都 610041;2. 青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;3. 青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041;4. 西南民族大学 现代生物技术国家民委重点实验室,四川 成都 610041)
组蛋白乙酰化是一种重要的表观遗传调控方式,参与了细胞内的多个生物学过程,例如调控基因转录以及染色质的构象等[1]。细胞内的组蛋白乙酰化水平由两类执行相反功能的酶,组蛋白去乙酰化酶(Histone deacetylases,HDACs)和乙酰基转移酶共同调节,其中HDACs负责去除组蛋白上已经乙酰化的赖氨酸残基,增加组蛋白表面的负电荷,进而增强组蛋白与DNA的结合能力,使染色质处于凝集状态并抑制基因转录,而乙酰基转移酶执行的过程则正好相反[2]。
精子发生是一个包含有丝分裂、减数分裂以及细胞分化的复杂生物学过程[3],涉及基因的转录调控、染色体构象的重塑以及组蛋白的替换等[4-5]。Sirtuin 1 (SIRT1) 属于烟酰胺腺嘌呤二核苷酸(Nicotine adenine dinucleotide, NAD)依赖性的Ⅲ 型HDACs Sirtuin 家族的成员之一[6],已有文献报道SIRT1参与了多个生物学过程,例如组蛋白修饰、基因表达、细胞周期调控以及衰老等[7-8]。目前多个敲除小鼠模型已被建立用来研究SIRT1在生殖系统的功能。全身性SIRT1敲除小鼠精子发生停滞,凋亡的粗线期精母细胞增多,支持细胞和间质细胞的成熟发生异常,睾丸内睾酮的含量降低[9],进入减数分裂前的生殖细胞特异性敲除SIRT1的小鼠睾丸变小,精子数量减少,凋亡细胞增多,生育力降低[10],这些结果提示SIRT1可能在睾丸的不同细胞中通过不同的信号通路影响个体的生殖能力。
牦牛是生活在青藏高原上的特有畜种,能够为牧民提供其必需的各种生产生活材料,因而对高原畜牧业的发展具有重要意义[11]。然而牦牛繁殖能力较低,野生牦牛的生殖能力不到40%[12],虽然雄性牦牛在2岁前即能发生跨背交配行为,但直到4~5岁其才发育至性成熟并进入配种高峰期[13]。因此,提高牦牛的生殖能力对于改善其生产性能,进而促进高原地区畜牧业的发展具有重要意义。本研究克隆了牦牛SIRT1基因,通过多种生物信息学软件预测了其编码蛋白的结构和功能,并检测了SIRT1在不同发育时期牦牛睾丸中的表达和定位,为进一步研究SIRT1在雄性生殖系统中的作用以及提高牦牛的生殖能力提供一定的试验数据。
1 材料和方法
1.1 组织样本的采集
样本采自成都市青白江区屠宰场,依据齿龄将牦牛划分为幼年组(0.5~1岁)、青年组(2~3岁)及成年组(4~5岁)。试验动物断颈放血后对其进行剖腹,随即用无菌剪刀采集各时间段牦牛(每组3头)睾丸组织,同时采集成年组肝脏、心脏、脾脏、脑、小肠、胃、睾丸和卵巢组织,来源于同一组的3个不同样本均视为生物学重复。取下的组织用无菌生理盐水冲洗后,再用无菌剪刀剪成1 cm×1 cm×0.5 cm大小的组织块,在-80 ℃条件下保存,另取各阶段的睾丸组织,放置于无RNA酶的4% PFA中常温下进行固定。
1.2 主要试剂和仪器
TRIzol购自Invitrogen公司;PrimeScriptTMRT Reagent Kit反转录试剂盒、Premix TapTMDNA聚合酶、SYBR®Premix Ex TaqTMⅡ试剂盒、pMD19-T载体由TaKaRa公司生产;DNA胶回收试剂盒由康宁生命科学有限公司生产;DEPC、感受态细胞DH5α和DNA Marker均购自天根生化科技有限公司;Real-time PCR Master(ROX) 购自 Roche 公司;cOmpleteTMProtease Inhibitor Cocktail购自Roche公司;SIRT1 抗体购自Sigma公司;β-actin购自Bioss 公司;CISH试剂盒购自上海歌凡生物有限公司;其他无特殊说明的试剂均为国产分析纯。
1.3 牦牛各组织总RNA的提取和反转录
依据TRIzol法从牦牛各个组织提取RNA,用紫外分光光度计测定RNA浓度和OD值,按PrimeScriptTMRT Reagent Kit 说明书所述方法合成cDNA并将其冻存于-20 ℃备用。
1.4 牦牛SIRT1基因的克隆测序
参考GenBank中黄牛SIRT1基因序列(登录号:NM_001192980.3),以牦牛肝脏cDNA为模板,利用Primer Premier 5.0软件设计PCR扩增引物(表1)。PCR扩增体系(25 μL):2×LA Taq Master Mix 12.5 μL;上、下游引物各1 μL;cDNA 模板1 μL;ddH2O 9.5 μL。反应条件:95 ℃预变性4 min;95 ℃变性30 s,62 ℃退火45 s,72 ℃延伸45 s,38个循环;72 ℃延伸7 min,4 ℃保存。使用1.5%琼脂糖凝胶进行电泳检测,将目的条带切下后进行DNA胶回收。16 ℃金属浴中将胶回收产物与pMD19-T载体连接15 h,之后与感受态细胞混合并在LB液体培养基中培养1 h,离心后将沉淀菌液均匀涂到含有0.1%氨苄的LB固体培养基上,置于37 ℃培恒温培养箱中12 h,选取白色单菌落接种于液态LB培养基中,于摇床振荡培养8 h后,选阳性菌株交由生工生物工程(上海)股份有限公司测序。
1.5 牦牛SIRT1基因生物信息学分析
通过 DNAMAN 8软件预测SIRT1基因的ORF(Open reading frame,开放阅读框)以及其编码的氨基酸序列,并进行同源性比对分析,通过ProtParam (https://web.expasy.org/protparam/)、ProtScale (https://web.expasy.org/protscale/)、NetPhos 3.1 (http://www.cbs.dtu.dk/services/NetPhos/)、NetOGlyc 4.0 (http://www.cbs.dtu.dk/services/NetOGlyc/)、NetNGlyc 1.0 (http://www.cbs.dtu.dk/services/NetNGlyc/)、 PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/)、Pfam (http://pfam.janelia.org/)以及SWISS_MODE (https://swissmodel.expasy.org/interactive) 分别预测牦牛SIRT1蛋白的基本理化性质、亲疏水性、磷酸化位点、糖基化位点、保守结构域、二级以及三级结构。
1.6 牦牛SIRT1基因组织表达谱
根据已克隆出的牦牛SIRT1基因序列设计实时荧光定量PCR引物(表1),以ACTB作为内参基因,内参基因引物根据GenBank中黄牛GAPDH基因序列(登录号:NM_173979.3)设计(表1),并通过实时荧光定量PCR仪检测该基因在各组织的表达量。反应总体系(10 μL):Real-time PCR Master(ROX) 5 μL、上下游引物各0.5 μL、cDNA模板1 μL、ddH2O 3 μL。反应条件:95 ℃预变性3 min;95 ℃ 变性10 s,60 ℃退火 31 s,72 ℃ 延伸30 s,其中退火和延伸共持续40个循环。每个样品重复检测3次。
1.7 色素原位杂交(Chromogenicin situ hybridization,CISH)
将在无RNA酶的4% PFA中固定的睾丸组织进行包埋切片,按照CISH试剂盒所述方法进行原位杂交,其中检测SIRT1的探针连接了地高辛,其序列为5′-TCATCACCAAACAGAAGGTTATCTCGGTA C-3′,一个具有来自线虫的非特异性序列连接了地高辛的探针作为阴性对照,其序列为5′-UUGU ACUACACAAAAGUACUG-3′。

表1 PCR引物序列及产物长度Tab.1 PCR primer sequences and product length
1.8 Western Blot检测SIRT1蛋白在牦牛睾丸不同发育阶段中的表达
将睾丸组织剪成细小的碎片,按每 20 mg 组织加入 150~250 μL 裂解液的比例加入裂解液(100 mmol/L Tris/HCl(pH值7.4)、3% 十二烷基硫酸钠、10 mmol/L 二硫苏糖醇、17.3% 甘油、0.15% 溴酚蓝及1% cOmpleteTM Protease Inhibitor Cocktail),匀浆器匀浆直至完全裂解,裂解后的样品4 ℃ 10 750 r/min离心15 min,取上清,BCA方法测定蛋白质浓度。按照20 μg的上样量进行蛋白定量,使蛋白浓度调整至一致,用12% 的十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE) 电泳2 h,90 V转膜50 min,5% 脱脂奶粉溶液室温摇床封闭2 h,加入SIRT1(稀释比例:1∶500)和β-actin 抗体(内参,稀释比例:1∶1 000),4 ℃孵育过夜后,TBST缓冲液洗涤3次,加入HRP标记的二抗(1∶5 000),室温孵育1 h,TBST缓冲液洗涤3次,加入ECL显影液进行显影。
1.9 统计学分析
数据统计采用One-way ANOVA (Tukey′s 多重比较检验) 。统计结果以mean±SEM 的方式表示,P<0.05 被认为具有显著性差异。
2 结果与分析
2.1 牦牛SIRT1基因的克隆及序列分析
利用DNAMAN软件对测序得到的SIRT1序列进行分析,结果表明,牦牛SIRT1基因的ORF包括1 866 bp, 编码621个氨基酸,编码序列的起始密码子为ATG,终止密码子为TAA (图1),将其基因以及编码的氨基酸序列与部分其他物种进行比对,发现其与黄牛(Bostaurus)的基因及氨基酸序列相似度最高,分别达到99.44%和98.04%,与表中其他物种基因和氨基酸的序列相似度也均达到90% 以上(表2),由此可见,SIRT1基因在物种进化过程中高度保守。

起始密码子ATG用方框标出;终止密码子TAA用*标出。The translation initiation codon ATG is boxed; The stop codon is marked by an asterisk.
2.2 牦牛SIRT1蛋白理化性质及结构预测
通过ExPASy在线工具对SIRT1蛋白的基本理化性质进行预测,结果表明,该蛋白分子量为68.99 ku,分子式为 C3034H4834N828O950S27,脂肪族系数、等电点以及不稳定系数分别为85.57,5.00 以及 49.40。SIRT1蛋白包含20种氨基酸,其中出现频率最高的前3位分别是 Glu(8.70%)、 Leu(8.53%)以及 Pro(8.05%)。 在所有氨基酸中,70个氨基酸(Arg+Lys)带正电荷,97个氨基酸(Asp+Glu)带负电荷,由此可得,SIRT1蛋白整体上带负电。亲疏水性分析表明,在其第108及109位氨基酸存在最小亲水指数,为-3.748,在其第124位氨基酸位点存在最大疏水指数,为2.511,平均亲水指数为-0.408,由此可知,该蛋白为疏水脂溶性蛋白。

表2 牦牛与部分其他物种SIRT1基因及氨基酸的序列同源性比对Tab.2 Alignment of SIRT1 gene and amino acid sequences between yak and some other species

A.预测的SIRT1二级结构,其中红色、黄色和灰色分别代表α-螺旋、β-转角以及无规卷曲;B.预测的SIRT1保守结构域;C.预测的SIRT1三级结构。A.Predicted secondary structure of SIRT1, red,yellow and gray stand for alpha helix, beta sheet and random coil, respectively;B. Predicted conserved domain for SIRT1;C.Predicted tertiary structure of SIRT1.
多个生物信息学软件预测表明,SIRT1 蛋白包含59个丝氨酸磷酸化位点、7个酪氨酸磷酸化位点、16个苏氨酸磷酸化位点, 43个O-糖基化位点以及2个N-糖基化位点。二级结构预测结果显示,SIRT1蛋白中α-螺旋、β-转角及无规卷曲分别占30.11%,9.82%,60.06%,同时该蛋白是一个不具跨膜结构及信号肽的非分泌蛋白(图2-A),另外,该蛋白含有一个保守的Sir2结构域(图2-B)。SIRT1蛋白的三级结构进一步验证了二级结构的预测(图2-C)。
2.3 牦牛SIRT1 mRNA的组织表达谱
利用qRT-PCR检测SIRT1mRNA在牦牛各组织中的表达,如图3所示,SIRT1mRNA在所检测的8个组织中均有表达,其中在睾丸、卵巢及肝脏中的表达较高,极显著高于心脏、胃、脾脏、小肠和脑中的表达。

相同字母表示差异不显著(P>0.05);不同字母表示差异极显著(P<0.01);One-way ANOVA (Tukey′s 多重比较检验)。图5同。
2.4 SIRT1在牦牛不同发育时期睾丸中的表达和定位
为了进一步研究SIRT1在牦牛睾丸中的作用,首先采用CISH检测SIRT1mRNA 在牦牛不同发育阶段睾丸中的定位,发现SIRT1mRNA广泛存在于各阶段牦牛睾丸中的精原细胞、精母细胞、支持细胞及睾丸间质细胞的胞质和胞核中,然而在幼年期及成年期睾丸的精细胞中未发现SIRT1的表达(图4),随后利用Western Blot检测 SIRT1蛋白在牦牛不同发育时期(幼年期、青年期以及成年期)睾丸中的表达,结果表明,SIRT1蛋白在幼年期牦牛睾丸中的表达量最高,随年龄增长其表达极显著下调(图5)。

SIRT1 mRNA在幼年期、青年期及成年期睾丸中的定位。绿色箭头(实线).精原细胞;绿色箭头(虚线).精母细胞;红色箭头(实线).支持细胞;红色箭头(虚线).间质细胞;黄色箭头(实线).精细胞。一个带有线虫非特异序列的探针被作为阴性对照(NC)。
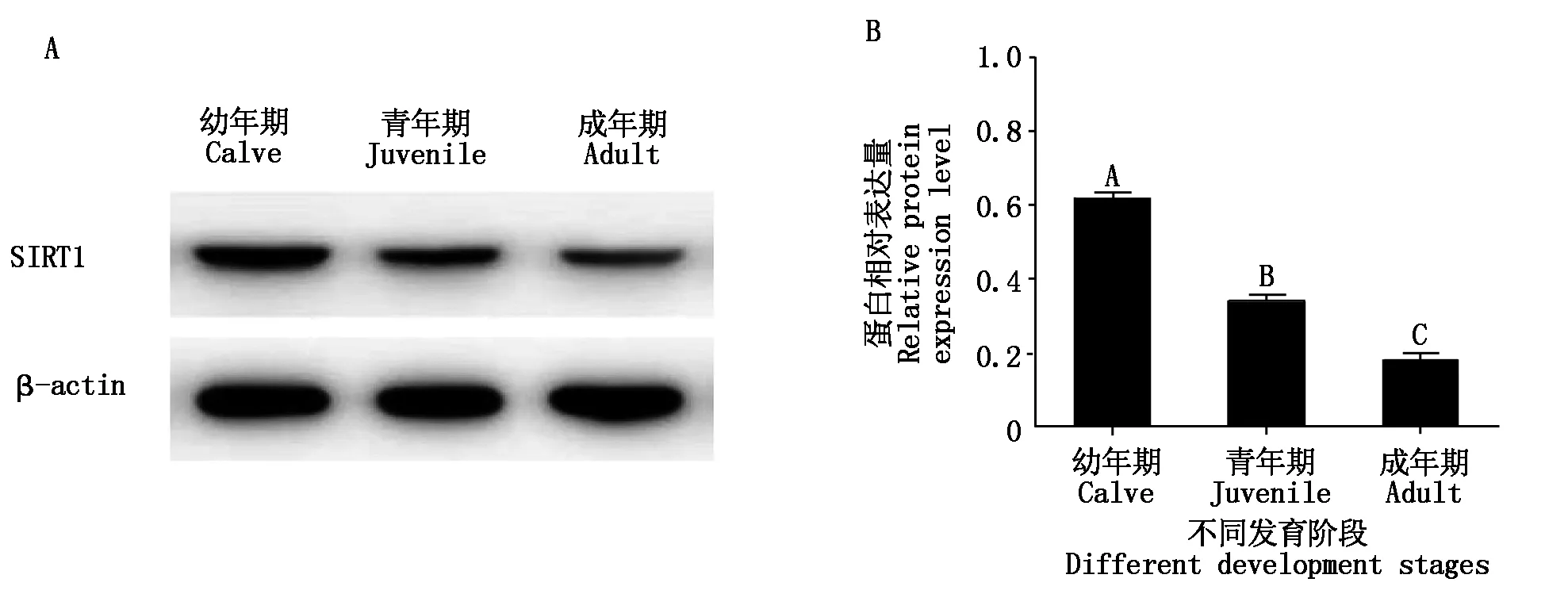
A.Western Blot分析SIRT1 蛋白在幼年期、青年期及成年期牦牛睾丸中的表达;B.通过光密度分析对A中结果进行定量。A.Western Blot analysis of SIRT1 in yak testis of calve, juvenile and adult stages;B.Protein levels in A were quantified by measuring optical density.
3 结论与讨论
组蛋白乙酰化是一种由组蛋白乙酰化酶和去乙酰化酶共同调控的,参与多个重要生物学过程的表观修饰方式[14-15]。SIRT1 属于NAD依赖的Ⅲ型去乙酰化酶,已有报道其对小鼠、大鼠及猪的生殖能力是必需的[16-18],然而牦牛SIRT1基因及蛋白的结构与功能,以及其在雄性牦牛生殖系统中的表达定位依旧未知。本研究克隆了SIRT1基因,对其编码蛋白的结构与功能进行了预测,并分析了其在不同发育时期牦牛睾丸中的表达定位。
序列比对结果表明,牦牛SIRT1基因序列和其他物种高度同源,表明该基因在进化过程中高度保守,这与其保守结构域的预测结果相吻合。预测的牦牛SIRT1蛋白包含一个保守的Sir2催化结构域,该结构域广泛存在于Sirtuins家族的不同成员中,负责结合NAD以及乙酰化的赖氨酸残基[19]。有文献表明, SIRT1的去乙酰化活性受到氧化及还原形式NAD (NAD+/NADPH)比例的影响[20],表明该结构域对SIRT1的功能是必需的。此外,蛋白结构的预测结果表明,牦牛SIRT1含有多个磷酸化及糖基化位点,提示该蛋白可能受到翻译后修饰的调控。有文献报道c-Jun氨基末端激酶 (c-Jun N-terminal kinase 2,JNK2)能够磷酸化人SIRT1 蛋白第27位的丝氨酸位点,这一过程可以增强肿瘤细胞中SIRT1的稳定性和表达,并可最终抑制肿瘤细胞的凋亡[21]。在人非小细胞肺癌细胞中发现O-糖基化可以增强SIRT1的去乙酰化酶活性,并保护细胞免受压力诱导的凋亡[22]。本研究预测的牦牛SIRT1蛋白结构对于未来寻找牦牛SIRT1的新功能和调控机制有一定的帮助。
组织表达谱的分析结果表明,SIRT1mRNA 广泛表达在各类组织中,除睾丸外,SIRT1还高表达于卵巢及肝脏。已有文献表明在多个物种中SIRT1对卵巢的功能是必需的。例如在大鼠中SIRT1通过调控叉形头转录因子O3(Forkhead box O3A,Foxoa3)的表达影响卵泡发育[23],在猪和大鼠的卵巢中SIRT1还可以调控雌激素的合成[24-25]。SIRT1在肝脏中的作用同样不可替代,通过对几种抑制脂肪肝疾病的转录因子进行去乙酰化,SIRT1可以调节肝脂代谢、控制肝氧化应激以及介导肝炎发生[26],牦牛卵巢及肝脏中高表达的SIRT1暗示其可能在这些组织中发挥重要的作用。
SIRT1的mRNA在牦牛睾丸的精母细胞、精原细胞、支持细胞及间质细胞中均有定位,提示SIRT1可能在这些细胞中发挥作用。在小鼠未分化的精原细胞中条件性敲除SIRT1会导致其睾丸变小、精子数量减少、凋亡细胞增多以及生育力下降,表明SIRT1 在精原细胞的分化中发挥重要作用[10],与其相比,全身性敲除SIRT1的小鼠出现了支持细胞和间质细胞的成熟障碍,同时睾丸内睾酮的含量降低[9],表明SIRT1在这些细胞中同样不可替代。需要指出的是牦牛睾丸的精细胞中缺少SIRT1的表达,这与小鼠中的结果一致[10]。研究表明:精母细胞向精子转变时核心组蛋白H3及H4 会被高度乙酰化,这一过程能够促使核小体形成宽松的结构, 使组蛋白易于被鱼精蛋白所替代[27]。推测精细胞中缺少去乙酰化酶SIRT1的表达很可能是为了保证组蛋白H3及H4 的高度乙酰化,从而保证组蛋白替换的顺利进行。
SIRT1蛋白在牦牛睾丸中高表达于幼年期,其表达随年龄的增长而持续降低,一个可能的解释是这一表达趋势与睾丸中的细胞组成有关,幼年期的牦牛睾丸中缺少成熟的精细胞,而随着个体年龄的增加,越来越多的生殖细胞完成减数分裂形成精细胞[28],因此,青年期和成年期睾丸中SIRT1 蛋白水平的持续下调很可能是由于这2个阶段睾丸中成熟精细胞比例的增高所致。
本研究成功的克隆了牦牛SIRT1基因,生物信息学预测表明,SIRT1蛋白是一个不存在跨膜区、无信号肽的疏水脂溶性蛋白质,并且其包含多个糖基化和磷酸化位点以及一个保守的Sir2结构域,SIRT1mRNA在牦牛睾丸组织中高表达,且定位于睾丸内除精细胞之外的各类细胞中。在不同年龄的牦牛睾丸中SIRT1蛋白的表达随其年龄的增长而持续下降,本试验为进一步研究SIRT1对牦牛雄性生殖系统的调控机制提供了一定的试验数据。
