诱变处理对鸢尾组培苗生理生化指标的影响
2020-08-28周琳张永春杨柳燕蔡友铭
周琳 张永春 杨柳燕 蔡友铭

摘要:以鸢尾组培苗为试验材料,比较不同诱变处理对鸢尾组培苗生理生化指标的影响。研究结果表明,不同诱变处理均导致丙二醛(MDA)和过氧化氢(H2O2)的积累、超氧阴离子自由基(O-2·)生成速率提高以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的增强,而且诱变剂量越高,这些生理生化指标的值越高。秋水仙素和60Co-γ诱变处理相比,高剂量(20.0、40.0 Gy)的60Co-γ对鸢尾组培苗造成的损伤更为明显,该处理下,鸢尾组培苗MDA含量和活性氧积累更明显,抗氧化酶活性也较高,但成活率较低。低剂量(2.5、5.0、10.0 Gy)的 60Co-γ 处理下,虽然各生理生化指标略高于或接近秋水仙素处理,但其成活率仍低于秋水仙素处理。不同诱变处理培养30 d后,均转接至新鲜继代培养基,转接后10 d鸢尾叶片生理生化各项指标均有所下降,表明对于诱变处理的材料,缩短其继代培养时间,可减少活性氧或有害物质的积累,提高其成活率。
关键词:鸢尾;组培苗;化学诱变;物理诱变;生理生化指标;成活率
中图分类号:S682.1+90.4+3 文献标志码: A文章编号:1002-1302(2020)13-0150-07
收稿日期:2019-07-29
基金项目:上海市科学技术委员会科研计划(编号:16391900200);上海市现代农业产业技术体系项目[编号:沪农科产字(2019)第8号];上海市科委研发平台建设项目(编号:18DZ2291400)。
作者简介:周琳(1989—),女,江苏无锡人,博士,主要从事花卉遗传育种研究。Tel:(021)62207245;E-mail:zhoulin6816@126.com。
通信作者:蔡友铭,博士,研究员,主要从事花卉育种与生产研究。Tel:(021)52231163;E-mail:zhangyc@saas.sh.cn。鸢尾属(Iris)为鸢尾科(Iridaceae)最大的属,该属植物具有花型多样、花色艳丽、花期较长等优点,有“宿根皇后”的美誉[1-2]。鸢尾属植物因其可观花和观叶、生态适应性广等特点,目前已被广泛应用于河道绿化、水质净化、生态保护、草坪镶边以及与常绿乔木配植形成花带等[1,3],且切花类型的鸢尾备受市场欢迎。此外,鸢尾属植物中的花菖蒲、马蔺、蝴蝶花等具有一定药用价值[4],是部分中草药的来源植物;细叶鸢尾、粗根鸢尾、中亚鸢尾等的根和根状茎中的甲醇提取物被证实具有体外抗炎活性[5]。因此,鸢尾属植物既是重要的观赏和药用植物,还可用于食品、纺织和化工领域,具有较好的经济效益和市场前景[6]。
鸢尾属植物全球有300多种,但多数资源分布于北温带地区。虽然,我国鸢尾属植物种质资源丰富,大概有60个种,但多数资源仍处于引种栽培阶段[7];而且鸢尾属植物种间杂交亲和性低,导致杂交育种工作进展相对滞后。相较于其他花卉,鸢尾属植物诱变育种研究相对滞后,研究报道多集中于辐射诱变育种方面,且诱变处理对鸢尾属植物生理生化的影响未得到充分关注[8-10]。因此,本试验以路易斯安那鸢尾组培苗为试验材料,研究不同剂量化学诱变和辐射诱变处理对鸢尾组培苗生理生化的影响,以期基于生理生化响应情况,筛选出合适的诱变剂量,提高诱变效率。
1材料与方法
1.1材料
试验于2018年3—8月开展,依托上海植物种苗组培专业技术服务平台,以路易斯安那鸢尾(Heather Stream)当年新萌发的幼嫩茎尖为外植体,参照祝剑峰等的外植体灭菌方法以及初代培养、继代培养的培养基配方[11]进行组织培养,获得鸢尾组培苗。鸢尾组培苗培养的光照度、光—暗周期和昼/夜温度分别为30~35 μmol/(m2·s)、12 h—12 h、20 ℃/15 ℃。
1.2处理方法
选择长势较为一致的鸢尾组培苗(苗高5 cm),用于不同诱变处理。使用秋水仙素(Colchicine,美国SIGMA)进行化学诱变处理,共设3个剂量梯度,分别为0.1%、0.2%和0.3%,将秋水仙素按照不同剂量处理添加至培养基中,培养24 h后,将组培苗转接至新的继代培养基中。通过上海束能辐照技术有限公司的60Co-γ射线进行辐射诱变处理,共设2.5、5.0、10.0、20.0、40.0 Gy共5个剂量,剂量率为1 Gy/min。对照组(培养基中未添加秋水仙素,且未进行60Co-γ辐射处理)、秋水仙素(0.1%、0.2%和0.3%)处理组和60Co-γ(2.5、5.0、10.0、20.0和40.0 Gy)處理组的鸢尾组培苗均为30株,重复3次。在试验期间,培养条件(培养基、光照度和周期、温湿度)与前期培养条件一致,于培养30 d时转接至新配制的继代培养基,培养基配方参考祝剑峰等的研究[11]。
1.3测定指标及测定方法
各处理(对照、化学诱变和物理诱变)均于培养0、5、10、15、20、30、40 d时取鸢尾组培苗叶片,按照各项生理生化指标[12-17]测试需求称质量后,冻存于 -80 ℃ 冰箱。参照李合生的硫代巴比妥酸法[12]测定丙二醛(MDA)含量;参照Wang等的方法[13]测定超氧阴离子自由基( O-2· )产生速率;采用刘俊等的方法[14]测定H2O2含量;参照Giannopolitis的氮蓝四唑(NBT)法[15]测定超氧化物歧化酶(SOD)活性;参照Aebi的紫外吸收法[16]测定过氧化氢酶(CAT)活性;参照Bergmeyer的愈创木酚法[17]测定过氧化物酶(POD)活性;各处理均于培养60 d时统计组培苗成活率。每个测定指标均设3次重复。
1.4数据统计分析
使用Excel 2010整理数据,采用SPSS 22.0统计软件进行ANOVA方差分析和差异显著性分析(Duncans新复极差法),使用Origin 8.5软件作图。
2结果与分析
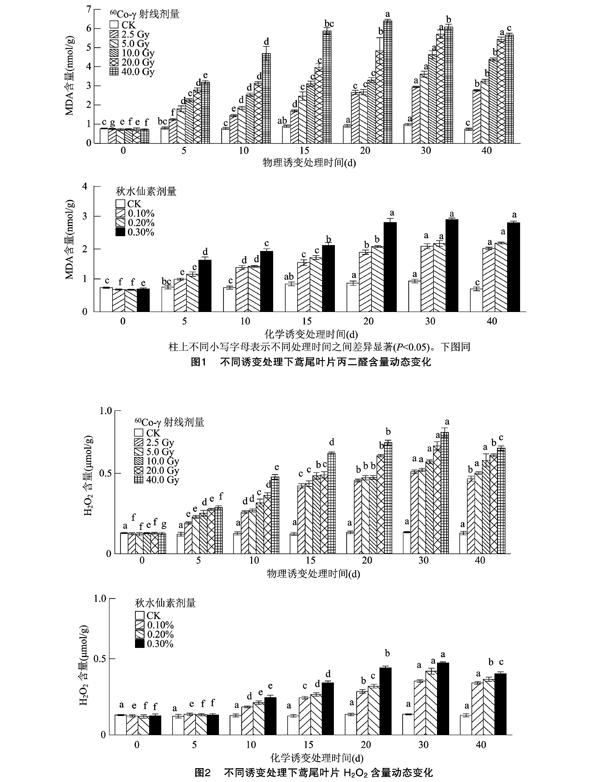
2.1诱变处理对鸢尾叶片丙二醛含量的影响
从图1可见,在培养0~40 d期间,对照组鸢尾叶片丙二醛(MDA)含量虽有波动,但其含量保持在0.77~0.98 nmol/g之间。秋水仙素和60Co-γ处理下,均表现为剂量越高则MDA含量越高;秋水仙素处理下,MDA含量变化范围为0.70~2.94 nmol/g,而60Co-γ处理的变化范围为0.72~6.39 nmol/g,高剂量(20、40 Gy)的60Co-γ处理下MDA含量明显高于相同时期的秋水仙素处理。不同剂量 60Co-γ 处理的叶片MDA含量随着培养时间的延长可显著增加,在培养30 d更换新鲜继代培养基后,有所降低,但在培养40 d时仍保持较高值。秋水仙素处理下,MDA含量变化趋势与60Co-γ处理一致,在培养40 d时仅略微下降,与培养30 d时差异不显著。值得关注的是,0.1%和0.2%秋水仙素处理,虽然处理剂量成倍增加,但在不同时期,0.2%秋水仙素处理的MDA含量仅略高于0.1%处理,两者差异不明显。
2.2诱变处理对鸢尾叶片H2O2含量的影响
由图2可知,对照组在培养0~40 d期间,鸢尾叶片H2O2含量在 0.137~0.151 μmol/g之间浮动,始終保持较低水平且变化不显著。不同剂量(2.5、5.0、20.0、40.0 Gy)60Co-γ诱变处理下,随着剂量的增加H2O2含量明显增加,大多处理于 30 d 时达到峰值,随着继代培养基的更新而降低;仅10 Gy处理在培养0~40 d期间H2O2含量始终保持增长。秋水仙素处理鸢尾时,不同浓度秋水仙素处理对H2O2含量的影响也表现为0~30 d期间增加,30~40 d期间下降。高浓度的秋水仙素处理下,H2O2含量明显高于低浓度处理,在培养15、20 d时,0.3%秋水仙素处理下H2O2含量明显高于0.1%和0.2%处理,在培养30、40 d时,0.3%处理的H2O2含量虽然仍高于0.1%和0.2%处理,但其差值相对减小。
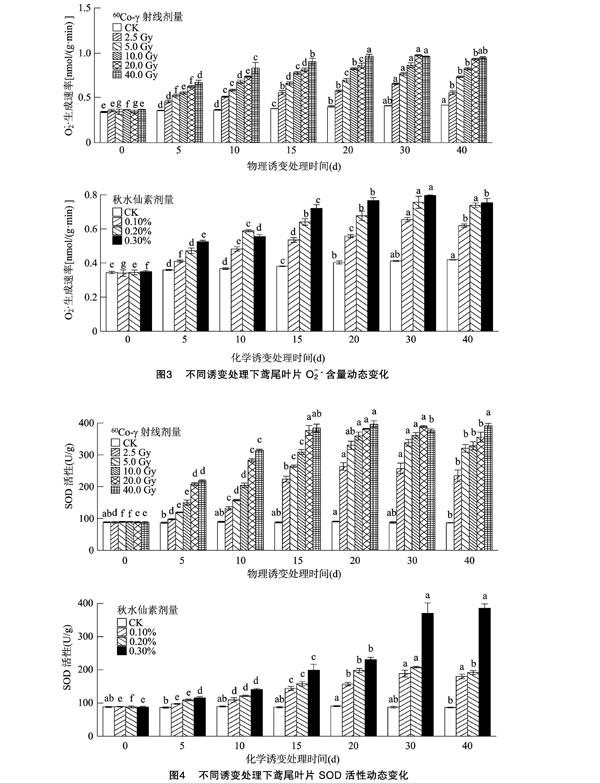
2.3诱变处理对鸢尾叶片 O-2· 生成速率的影响
如图3所示,对照组的 O-2· 生成速率变化范围为0.344~0.419 nmol/(g·min),随着培养时间的延长可显著提高。60Co-γ和秋水仙素处理下, O-2·生成速率变化范围分别为 0.345~0.979 nmol/(g·min)和0.341~0.796 nmol/(g·min)。秋水仙素诱变和 60Co-γ(2.5、5.0、10.0、20.0 Gy)诱变的 O-2· 生成速率均表现为在培养0~30d期间显著提高,在
30~40 d期间有所降低;40 Gy处理下在培养0~20 d 期间显著增加,在培养20、30、40 d时O-2· 生成速率分别为0.967、0.963、0.950 nmol/(g·min)。
2.4诱变处理对鸢尾叶片抗氧化酶活性的影响
2.4.1诱变处理对鸢尾组培苗SOD活性的影响由图4可见,对照组鸢尾叶片SOD活性在86.64~
90.78 U/g之间波动,60Co-γ和秋水仙素处理均导致鸢尾叶片中SOD活性增强,除了2.5、40.0 Gy处理以外,其余处理均表现为SOD活性在培养0~30 d 间显著增强,在30~40 d期间下降,且诱变剂量越高最终SOD活性越强。2.5 Gy处理下,SOD活性在培养0~20 d期间显著增加,在培养20~40 d期间下降;而40.0 Gy处理下,SOD活性除了在培养30 d时有所下降,整体保持增长的趋势,最终活性可达390.98 U/g。化学诱变处理下,在培养5~30 d 期间,不同取样时间的SOD活性总体显著增长;而 60Co-γ 处理下,在前期5~30 d期间SOD活性增长显著,但在培养30 d和40 d之间的SOD活性变化幅度相对较小。
2.4.2诱变处理对鸢尾组培苗CAT活性的影响在0~40 d期间,对照组CAT活性在68.01~71.05 U/g 间波动,但变化不显著(图5)。0.1%和0.2%秋水仙素处理及20、40 Gy处理下,鸢尾叶片中CAT活性在培养0~20 d期间显著增强,在培养20~40 d期间有所下降;其余处理均表现为在培养0~30 d期间CAT活性显著增强,在培养30~40 d期间降低。在20、40 Gy处理下,CAT活性于培养5 d时分别达到133.48、137.69 U/g,明显高于0.1%和0.2%秋水仙素处理的最高值,此外在40 d时,其活性分别为155.24、169.11 U/g,仍保持较高水平。
2.4.3诱变处理对鸢尾组培苗POD活性的影响由图6可知,相对于SOD和CAT,对照组POD在培养0~40 d期间活性变化更明显,其活性在663.00~707.26 U/g间波动,且在培养30 d时达到最高值,即707.26 U/g。除了20 Gy处理在培养20 d和 30 d 时POD分别为1 255.68、1 254.13 U/g以外,其余各处理均表现为在培养0~30 d期间POD活性显著增强,在培养30~40 d期间降低。20、40 Gy 处理下,POD活性变化与CAT相似,即在5 d时分别显著增强至804.09、823.28 U/g,在培养40 d时仍保持较高的水平,分别为1 152.17、1 151.87 U/g。
2.5诱变处理对鸢尾组培苗成活率的影响
不同诱变处理的鸢尾组培苗成活率见表1。秋水仙素和60Co-γ处理下,鸢尾组培苗成活率均表现为剂量越高成活率越低。不同剂量秋水仙素处理下,鸢尾组培苗成活率均在30%以上;不同剂量的60Co-γ处理导致鸢尾组培苗成活率较低,即使是2.5 Gy处理,其成活率也仅有21.11%,当剂量为20、40 Gy时,其成活率甚至低于5%。此外,0.1%秋水仙素处理的成活率高于50%,但0.2%和0.3%的秋水仙素处理的成活率分别为35.56%和32.22%,0.2%和0.3%处理的成活率差异不显著;5、10 Gy处理下,成活率较为相近,分别为13.33%和12.22%。
3结论与讨论
由于自然界中自发突变频率较低,且需长期积累, 而通过诱变技术(化学诱变和物理诱变)可获得较为丰富的种质材料,因此诱变育种已经成为加快植物种质资源改良和新种质选育的重要方法[18]。经过多年发展,观赏植物的诱变方法、材料和剂量的选择以及诱变机制已备受关注[19],然而,不同物种的诱变剂量存在较大差异;进行诱变处理时,剂量过低,不能达到诱变效果,剂量过高,则极易导致植株死亡,因此根据物种筛选合适的诱变剂量,达到既能得到较多变异,又不引起植株过度损伤或死亡,对于诱变育种效率的提高具有重要意义。目前已有多个物种通过诱变处理后生理生化指标的测定筛选出了合适的诱变剂量[20-22]。因此,本试验以路易斯安那鸢尾组培苗为试验材料,比较了不同诱变剂量对鸢尾组培苗生理生化指标以及成活率的影响,以期筛选出最佳诱变剂量,用于后期大量诱变处理,进而开展鸢尾新种质选育工作,提高诱变效率和诱变苗的成活率。
诱变处理对植物的MDA、活性氧含量和抗氧化酶活性的变化一直备受关注[23]。多数的研究结果显示,诱变育种均导致抗氧化酶活性的增强[20-22,24],表明诱变诱变处理可能导致组织产生了大量的活性氧,从而激发植物抗氧化系统来调控活性氧平衡。相较于抗氧化酶活性,诱变处理对MDA含量的影响上存在一定的争议,申晓慧等报道,紫花苜蓿在物理诱变处理后,MDA含量变化不明显[20,24],但温岚等在黄麻上的研究结果则表明,诱变导致了MDA含量显著增加[22]。本试验中,在化学诱变(秋水仙素)和物理诱变(60Co-γ)2种不同的诱变处理下,均表现为高剂量下鸢尾叶片的MDA、H2O2含量以及O-2· 生成速率、抗氧化酶活性(SOD、CAT和POD)较高,由此可见2种诱变处理均对鸢尾组培苗造成了伤害,导致了MDA、H2O2和 O-2· 的大量积累,从而激发抗氧化酶活性的增强,且剂量越高植株损伤越大。2种诱变方式相比,高剂量(20、40 Gy)的 60Co-γ 处理下,鸢尾组培苗各项生理生化指标均明显高于秋水仙素处理,且成活率极低;低剂量(2.5、5.0、10.0 Gy)处理下,鸢尾组培苗生理生化指标则略高于或接近于秋水仙素处理;并且60Co-γ处理鸢尾組培苗整体成活率明显低于秋水仙素处理,可见60Co-γ对鸢尾组培苗造成的损伤比秋水仙素更为严重。此外,虽然生理生化指标存在一定差异,但0.1%和0.2%秋水仙素处理的成活率差异不显著,5.0、10.0 Gy 60Co-γ处理成活率较为相近,可见诱变剂量虽然成倍增加,但剂量较低时,仍能保持一定的成活率;然而,诱变处理可能对植株造成长期的影响,其成活率虽然相近,但对于后续生根、炼苗、移栽等的影响仍需深入研究。不同诱变处理下,MDA、H2O2含量和 O-2· 生成速率基本表现为随着培养时间的延长而显著增加,在转接后有所下降;抗氧化酶活性变化趋势基本一致。值得关注的是,植物存在抗氧化系统以平衡活性氧[25-56],抗氧化酶可通过酶促反应清除活性氧[27-28],但本试验中,随着SOD等抗氧化酶活性的增强, O-2· 生成速率和H2O2含量仍持续增长,仅在转接至新培养基后有所下降。因此,对于诱变处理的组培苗,转接至新培养基可缓解诱变处理造成的伤害,因而可适当缩短诱变处理后的继代培养时间,以减少MDA、H2O2等的积累。
本试验对不同诱变处理下,鸢尾组培苗生理生化指标以及成活率进行了初步统计分析,结果发现,不同剂量诱变处理均引起鸢尾叶片中活性氧的积累,对其造成损伤。鸢尾组培苗适于低剂量的化学诱变(0.1%和0.2%秋水仙素)和物理诱变(2.5 Gy 60Co-γ)处理;高剂量的诱变处理则导致植株受损严重且成活率较低。此外,为缓解诱变处理对组培苗的伤害,可适当缩短组培苗的继代周期,以减少有毒有害物质的积累,从而提高诱变处理组培苗的成活率。
参考文献:
[1]童俊,毛静,董艳芳,等. 鸢尾属部分种质资源遗传多样性的SRAP分析[J]. 湖北农业科学,2019,58(4):88-92.
[2]史言妍,高亦珂. 鸢尾属植物育种研究进展[J]. 黑龙江农业科学,2010(8):155-158.
[3]尹新彦,储博彦,李金霞,等. 鸢尾属植物育种研究进展[J]. 北方园艺,2016(8):193-196.
[4]云雪林,杨碧仙. 贵州莺尾属植物种质资源及观赏药用价值[J]. 贵阳学院学报(自然科学版),2009,4(3):15-17.
[5]杨阳,张绪阳,常利华,等. 5种鸢尾属药用植物甲醇提取物体外抗炎活性研究[J]. 中南药学,2019,17(2):199-203.
[6]姬常平. 德国鸢尾(Iris germanica L.)引种栽培与繁殖技术的研究[D]. 哈尔滨:东北农业大学,2013.
[7]毛立彦,於艳萍,宾振钧,等. 国内鸢尾属植物的抗逆性研究进展[J]. 农业研究与应用,2016(6):53-58.
[8]Rather Z A,Jhon A Q. Effect of 60Co gamma rays on Dutch iris[J]. Journal of Ornamental Horticulture(New Series),2000,3(2):71-74.
[9]林兵,钟淮钦,黄敏玲,等. 60Co-γ射线对荷兰鸢尾的辐照效应[J]. 核农学报,2010,24(1):50-54.
[10]刘春贵,李风童,孙叶,等. 60Co-γ射线对路易斯安那鸢尾种子的辐射效应研究[J]. 核农学报,2018,32(1):1-7.
[11]祝剑峰,李芬,袁宇明,等. 鸢尾组织培养快速繁殖技术研究[J]. 江西农业学报,2015,27(5):25-28.
[12]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:259-261.
[13]Wang A G,Luo G H. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J]. Plant Physiology Communications,1990,26:55-57.
[14]劉俊,吕波,徐朗莱. 植物叶片中过氧化氢含量测定方法的改进[J]. 生物化学与生物物理进展,2000,27(5):548-551.
[15]Giannopolitis C N,Ries S K. Superoxide dismutases:I. Occurrence in higher plants[J]. Plant Physiology,1977,59(2):309-314.
[16]Aebi H. Catalase in vitro[J]. Methods in Enzymology,1984,105:121-126.
[17]Bergmeyer H U. Methods of Enzymatic Analysis[M].2nded. New York:Academic Press,1974,1205-1214.
[18]张瑞成,李魏,潘素君,等. 化学诱变在种质资源改良上的应用[J]. 分子植物育种,2017,15(12):5189-5196.
[19]马爽,李文建,周利斌,等. 观赏植物诱变育种的研究现状和展望[J]. 核农学报,2007,21(4):378-382.
[20]申晓慧,冯鹏,李如来,等. 不同诱变处理对紫花苜蓿生理生化指标的影响[J]. 农学学报,2018,8(10):70-75.
[21]杨建胜,孙万仓,刘自刚,等. 化学诱变剂EMS对白菜型冬油菜‘陇油7号形态及生理生化的影响[J]. 西北农业学报,2015,24(3):75-81.
[22]温岚,龚友才,陈基权,等. EMS和60Co-γ射线辐照复合诱变黄麻突变体苗期生理生化特性研究[J]. 中国麻业科学,2014,36(5):226-231.
[23]刘建霞,张梦丽,李慧,等. 苦荞麦种子与幼苗对叠氮化钠诱变的响应[J]. 江苏农业科学,2019,47(10):85-88.
[24]申晓慧,姜成,李如来,等. 零磁空间诱变对紫花苜蓿品种生长特性的研究[J]. 核农学报,2018,32(4):633-638.
[25]辛松林,秦 文,孙传红,等. 腐皮镰孢霉菌侵染及保鲜剂处理对秋葵相关抗性酶的影响[J]. 江苏农业学报,2018,34(5):1161-1168.
[26]白英俊,李国瑞,黄凤兰,等. 活性氧与植物抗氧化系统研究进展[J]. 安徽农业科学,2017,45(36):1-3.
[27]陈天,刘云根,王妍,等. 外源磷对砷胁迫下挺水植物抗氧化酶系统的影响[J]. 江苏农业学报,2019,35(5):1040-1046.
[28]Miura C,Sugawara K,Neriya Y,et al. Functional characterization and gene expression profiling of superoxide dismutase from plant pathogenic phytoplasma[J]. Gene,2012,510(2):107-112.朱雨晴,薛晓萍. 遮阴对花果期番茄植株生长及干物质分配的影响[J]. 江苏农业科学,2020,48(13):157-163.doi:10.15889/j.issn.1002-1302.2020.13.031
