白芨工厂化育苗组培快繁技术体系的构建
2020-08-28李志红徐静雅旦真次仁段金华侯典云
李志红 徐静雅 旦真次仁 段金华 侯典云


摘要:白芨的野生资源濒临匮乏,其种子自然萌发比较困难,因此传统的白芨种植方法已不适于市场需求。以白芨种子为材料,探究白芨种子萌发、生根及组培苗移栽驯化的最佳方法。白芨种子萌发最佳培养基为MS+蔗糖30 g/L+琼脂8 g/L+马铃薯10 g/L,增殖培养基为MS+蔗糖30 g/L+琼脂9 g/L+KT 1.0 mg/L+NAA 0.2 mg/L,最佳生根培养基为MS+NAA 0.2 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+琼脂9 g/L+马铃薯25 g/L,马铃薯可促进白芨组培苗根的生长,组培苗驯化的最佳处理为预先将培养瓶开瓶进行适应性锻炼,2~3 d后把组培苗移至炼苗基质中,这样可提高白芨组培苗的成活率。白芨工厂化育苗体系的建立可有效地扩大白芨的种植规模,缩短育苗时间,从而更好地利用和保护白芨野生资源。
关键词:白芨;组织培养;快速繁殖;种子萌发率;组培苗;丛生芽;生根率;成活率
中图分类号:S567.23+9.043 文献标志码: A文章编号:1002-1302(2020)13-0080-04
收稿日期:2019-08-30
基金项目:国家自然科学基金(编号:1404829);西藏自治区重点科技计划(编号:2015-ZD-NM-0)。
作者简介:李志红(1996—),女,河南新乡人,硕士,主要从事药用植物分子生物学研究。E-mail:1600356814@qq.com。
通信作者:侯典云,博士,副教授,硕士生导师,主要从事药用植物资源评价与利用研究。E-mail:dianyun518@163.com。白芨[Bletilla striata(Thunb.)Reichb.f.]为兰科多年生草本植物,其干燥块茎入药,具有收敛止血、消肿生肌的功效,可用于治疗吐血、外伤出血、皮肤皲裂等症[1],还具有很高的园林观赏价值[2]。现代药理研究表明,白芨具有抗菌[3]、止血[4-5]、促进创伤愈合[6]、抗肿瘤[7-8]等作用。研究表明,白芨的主要化学成分是多糖、三萜及皂苷等[9-10]。白芨在我国分布较为广泛,在云南、广西、甘肃、贵州等地均有发现[11]。近年来市场对白芨的需求量不断加大,导致野生白芨遭到过度的开采,野生资源急剧减少,现已是国家重点保护的野生药用植物[12]。但白芨的常规种植却受到很大的限制,每个白芨蒴果内大约有几万颗种子,种子细小且无胚乳,自然条件下出苗率只有万分之一[13]。目前主要是依靠人工栽培的方法来增加白芨的产量,但这种方法不仅周期长,且白芨苗易染病害,不能满足大规模栽培的需要[14]。利用组织培养技术对白芨外植体进行离体培养,不仅可实现工厂化育苗选育白芨优良品种,而且可保护白芨野生资源[15]。
1材料与方法
1.1材料处理
选取未开裂的白芨成熟蒴果,用75%乙醇棉球擦拭表面后,在超净工作台内,用75%乙醇浸泡 30 s 后取出,用0.1%的氯化汞溶液浸泡6 min后,用无菌水冲洗5次,每次30 s,最后用无菌滤纸吸干蒴果表面水分。在无菌条件下将白芨种子均匀接在培养基上,置于培养室内进行约10 d的暗培养,当种子出绿时,可转为光培养,培养时间为15~20 d。
选取表面完整无病毒、无发芽迹象的普通市售马铃薯,切块煮熟后,用纱布过滤,弃滤渣后备用。
1.2种子萌发最适培养基筛选
取白芨无菌种子于表1中的各组MS培养基中培养,每组培养基均添加30 g/L蔗糖,8 g/L琼脂,培养基pH值调至5.8~6.0,筛选白芨种子萌发最佳培养基,查看培养7、30 d时种子情况,计算接种30 d时的萌发率。萌发率以培养基的底面积计算。
1.3增殖继代培养
继代培养的关键影响因素是植物激素之间的配比[16],本研究所用增殖培养基为MS培养基,并向其中添加3%蔗糖,0.9%琼脂,1.0 mg/L激动素(KT),0.2 mg/L NAA,调节pH值为5.5~6.0。
在超净工作台内,将无菌种子萌发所获得的丛生芽小苗分株接种在增殖培养基上,置于培养室内培养,约50 d后获得3~5 cm的白芨丛生苗。
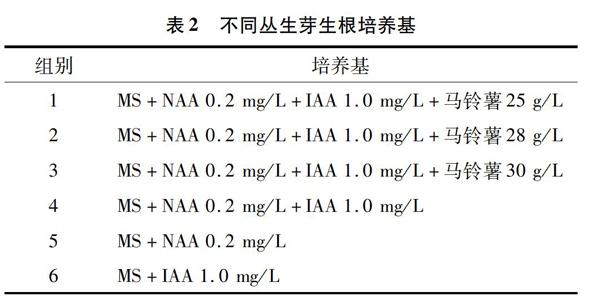
1.4丛生芽生根培养
将4 cm左右的丛生芽转接到表2所示培养基中进行生根培养,各培养基均添加蔗糖30 g/L,琼脂9 g/L,pH值调至5.8~6.0。每组培养基接种300株,接种30 d后统计丛生苗生根的株数,计算生根率。
1.5白芨无菌苗驯化
制作炼苗基质时需将中位泥炭土灭菌,然后将中位泥炭土、珍珠岩以及碎木屑按照体积比 5 ∶2 ∶3 的比例混合后,加入灭菌的蒸馏水拌匀,使其含水量为50%~55%,然后将所制作的炼苗基质装入育苗盘中, 放在遮阳率为50%的拱棚中备用,控制拱棚中的湿度为50%~55%,温度为 15~25 ℃。
注:IAA为吲哚-3-乙酸。
挑选生长健壮、根系较发达的白芨组培苗,打开培养瓶瓶盖,向瓶内喷洒无菌水,每瓶喷洒约 6 mL,置于培养室内2~3 d后,将组织培养瓶移出培养室再放置2~3 d。从培养瓶中取出白芨组培苗,并用蒸馏水清洗根部残留的培养基后,置于 0.2 mg/L 的NAA中浸泡30 s,需注意通风晾苗,以防根茎发霉[17]。将白芨苗种植于表3所示的炼苗基质中,炼苗90 d后移栽至大田种植,并計算炼苗成活率。
2结果与分析
2.1不同培养基对白芨种子萌发的影响
不同培养基对白芨种子萌发的影响见图1和图2。当MS培养基中无马铃薯和外源激素NAA时,接种30 d后的白芨种子萌发率仅有60%,低于添加马铃薯或NAA后的萌发率,而添加马铃薯的培养基内的种子萌发率均远高于添加NAA的培养基。通过对比组1和组5、组2和组6可以看出,在加入马铃薯后如果再次添加NAA反倒不利于白芨种子的萌发。因此,本试验所用的种子萌发培养基无需添加外源激素,即可有效促进白芨种子的萌发,且与添加激素的培养基相比,能够取得更高的萌发率。
2.2丛生芽生长
白芨丛生芽继代培养以MS培养基为基础培养基,向其中添加外源激素KT和NAA以促进丛生芽的生长。白芨丛生芽的生长结果见图3,可以看出,白芨丛生苗生长茂密, 叶翠绿且宽,长势较好,表明
外源激素KT和NAA有利于提高白芨丛生苗的质量,促进白芨生长与增殖。
2.3不同培养基对丛生芽生长及生根的影响
不同培養基对丛生芽生根的影响见图4和图5。由图5可知,在生根培养基中添加马铃薯后,白芨丛生芽生根率高于未添加马铃薯的生根培养基,表明马铃薯对白芨生根有明显的促进作用,可使白芨丛生芽生根率较高,根系较发达。因此本试验中MS+NAA 0.2 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+琼脂 9 g/L+马铃薯25 g/L为白芨丛生芽生根的最佳培养基。
2.4白芨组培苗炼苗、驯化
不同炼苗培养基对白芨组培苗成活率的影响
如图6所示。采用表3中组1所述的炼苗基质时,白芨组培苗成活率可达98%,远高于其他3组。组1的配比较其他3组更为合理,保证了炼苗过程中的水分和营养物质供应以及透气性,提高了白芨组培苗驯化的成活率。组1的组成成分易获取,若将其运用在白芨的工厂化育苗中,可降低白芨的培育成本。
3讨论
在白芨种子萌发试验中,外源激素NAA和有机添加物马铃薯泥起到了明显的促进作用,接种后 30 d,未加激素和有机添加物的MS基础培养基中的种子萌发率不高,而同时加入马铃薯和NAA培养基中的白芨种子萌发率反倒低于单独添加马铃薯或NAA的培养基。因此,本试验中最佳的白芨种子萌发培养基为MS+蔗糖30 g/L+琼脂 8 g/L+马铃薯10 g/L。笔者所在实验室还发现,在5 ℃条件下储存的种子萌发率比 -20 ℃ 条件下的高,说明5 ℃的温度条件较温和,可保护种子的生物活性,使得种子萌发率较高。
白芨组培苗移栽的成活率由生根条件决定。研究表明,外源激素NAA更适合诱导生根[18]。本试验研究发现,在生根诱导培养基中添加有机物马铃薯,会促进白芨组培苗的生根。白芨组培苗在培养瓶内的生长主要依靠培养基提供养分,因此炼苗过程前的开瓶、喷洒无菌水可增强白芨无菌苗对外界环境的适应性[19]。研究发现,对外界环境的适应性锻炼促进了兰科植物组培苗的生长及移栽成活率[20]。本试验以中位泥炭土、珍珠岩和碎木屑作为白芨组培苗的移栽介质。中位泥炭土是介于高位和低位之间的过渡性泥炭,透气性好,保水,富含营养物质。当中位泥炭土、珍珠岩、碎木屑按体积比 5 ∶2 ∶3 混合时,不仅能增强培养基质的排水能力,还能加大基质间的孔隙,防止土壤硬结,有助于组培苗根系的呼吸和对营养物质的吸收,进而促进组培苗的生长[21]。
白芨喜温暖、阴凉和较湿润的环境,不耐寒,怕积水。因此大田种植期间,切忌向育苗床频繁洒水,水分过多会导致地下块茎的腐烂。由于组培苗移栽初期新根系尚不发达,且土壤疏松透气,排水良好,因此移栽初期的养分供应以叶面喷施为主。可选择喷施对白芨产量影响最大的氮肥[22]。
本试验以白芨种子为材料,通过诱导种子萌发、增殖和生根,成功建立了白芨工厂化育苗快繁体系,并获得了大量可用于大田种植的组培苗,为种植户提供了优良种苗及技术支持。最佳诱导种子萌发的培养基配比为MS+蔗糖30 g/L+琼脂 8 g/L+马铃薯10 g/L,接种30 d内种子萌发率可达100%;增值继代培养基为MS+蔗糖30 g/L+琼脂9 g/L+KT 1.0 mg/L+NAA 0.2 mg/L;生根培养基为MS+NAA 0.2 mg/L+IAA 1.0 mg/L+蔗糖 30 g/L+琼脂9 g/L+马铃薯25 g/L,生根率可达99%。向培养基内添加马铃薯等有机添加物可促进白芨种子的萌发与根的生长。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:95.
[2]陆峻波,刘亚辉,杨永红,等. 从文献分析看我国白芨研究进展[J]. 云南农业大学学报(自然科学版),2011,26(2):288-292.
[3]彭芙,万峰,熊亮,等. 白及抑菌作用及其活性部位的初步研究[J]. 时珍国医国药,2013,24(5):1061-1063.
[4]万大群,赵仁全,刘海,等. 白及的成分、药理作用和临床应用研究进展[J]. 中国药业,2017,26(2):93-96.
[5]董莉,董永喜,刘星星,等. 白芨多糖对大鼠血小板聚集、凝血功能及TXB_2,6-keto-PGF_(1α)表达的影响[J]. 贵阳医学院学报,2014,39(4):459-462.
[6]俞林花,聂绪强,潘会君,等. 白及多糖对糖尿病溃疡创面愈合的作用研究[J]. 中国中药杂志,2011,36(11):1487-1491.
[7]孙爱静,庞素秋,王国权. 白及化学成分与抗肿瘤活性研究[J]. 中国药学杂志,2016,51(2):101-104.
[8]左霞,常明泉,陶平德,等. 白及在肿瘤治疗中的应用[J]. 中南药学,2015,13(1):58-60.
[9]He X R,Wang X X,Fang J C,et al. Bletillastriata:Medicinal uses,phytochemistry and pharmacological activities[J]. Journal of Ethnopharmacology,2017,195:20-38.
[10]王爱民,王永林,郑林,等. 白及药材中多糖的含量测定[J]. 中国中药杂志,2009,34(22):2963-2965.
[11]任风鸣,刘艳,李滢,等. 白及属药用植物的资源分布及繁育[J]. 中草药,2016,47(24):4478-4487.
[12]傅立国. 中国植物红皮书——稀有濒危植物 (第一册)[M]. 北京:科学出版社:1992,494-495.
[13]张佳宁,田茂琳,周祥云,等. 濒危名贵药材白芨组培繁育技术研究[J]. 甘肃科技,2016,32(24):122-124.
[14]林福林,杨昌云,杨薇薇,等. 中药白芨的现代研究概况[J]. 中国医院药学杂志,2013,33(7):571-573.
[15]王跃华,陈燕,刘曼,等. 培育优质白芨苗条件筛选研究[J]. 江苏农业科学,2018,46(20):165-167.
[16]王高鹏,孟淑霞,程超民,等. 白及组培苗繁育组织继代培养研究[J]. 现代园艺,2018(8):9-10.
[17]孟彪,苗桂林,许东东,等. 白及组培苗移栽技术研究[J]. 辽宁中医药大学学报,2014,16(2):56-58.
[18]林伊利,李伟平,马丹丹,等. 白及组培快繁的实验研究[J]. 中华中医药学刊,2012,30(2):336-339,450.
[19]王月英,陈义增,曾爱平,等. 基质及炼苗处理对蝴蝶兰组培苗落地和成苗生长的影响[J]. 浙江农业科学,2004(1):16-18.
[20]贾守海. 如何提高组培试管苗移栽的成活率[J]. 民营科技,2011(11):136.
[21]卢珏,王宇峰,金涛,等. 基于底泥堆肥的园林绿化基质生产研究[J]. 杭州师范大学学报(自然科学版),2019,18(4):411-417.
[22]李姣红. 白芨营养特性与施肥效应研究[D]. 贵阳:贵州大学,2007.张谋草,张俊林,赵玉娟,等. 温度变化对陇东地区玉米不同器官生长率和产量的影响[J]. 江苏农业科学,2020,48(13):84-90.doi:10.15889/j.issn.1002-1302.2020.13.017
