高压氧治疗对慢性脑缺血大鼠认知功能的影响及其作用机制
2020-08-28周磊应英范茂丹郑成刚衣洪杰刘青乐
周磊,应英,范茂丹,郑成刚,衣洪杰,刘青乐
慢性脑缺血(chronic cerebral ischemia,CCI)是一种以脑血流灌注不足、脑血流量降低为特征的病理状态,能够引起全脑或局部脑组织区域性代谢障碍,常表现为进行性的认知功能缺损[1-4]。轴突生长抑制因子Nogo-A是一种广泛分布于神经系统的髓鞘蛋白,是维持大脑结构完整和功能稳定的重要调节因子,被认为是迄今发现最强的神经再生抑制物,其表达增强,损伤神经的再生修复能力降低。Nogo-A参与调节脊髓损伤、多发性硬化症、阿尔茨海默病、外伤性脑出血、癫痫等多种中枢神经系统疾病神经损伤后的病理生理过程,与认知功能关系密切[5-9]。高压氧(hyperbaric oxygen,HBO)治疗能够改善一氧化碳中毒、缺血性卒中、外伤性脑出血等脑损伤后的认知功能障碍。但HBO治疗是否能通过调节Nogo-A蛋白的表达,改善CCI相关认知功能障碍目前鲜有报道。本研究通过模拟CCI病理生理过程,建立CCI大鼠动物模型,评估HBO治疗后大鼠学习记忆等认知功能的变化,通过观察海马组织神经元结构改变,在分子水平检测Nogo-A mRNA及Nogo-A蛋白的表达水平,探讨HBO治疗是否能够改善CCI相关认知障碍。
1 研究对象与方法
1.1 实验材料及分组
1.1.1 实验动物 雄性SD大鼠240只,体质量160±20 g[购于海军军医大学实验动物中心,动物生产许可证号:SCXK(沪)2017-0002]。所有大鼠入组前均采用Morris水迷宫实验进行为期5 d的适应性训练,每日2次,剔除连续3 d未能找到隐蔽平台的大鼠,用备用大鼠补充。
1.1.2 实验试剂 包括Nogo-A抗体(北京中杉金桥有限公司),β-actin抗体(美国Bioworld公司),BCA蛋白定量分析试剂盒(美国Pierce公司),组织用RNA提取试剂盒、反转录试剂盒(Roche公司),十二烷基硫酸钠、甘氨酸(武汉谷歌生物有限公司)。
1.1.3 实验仪器 包括Morris水迷宫(北京硕林苑科技有限公司),全自动核酸分离纯化系统(Roche公司),凝胶成像系统(美国Bio-Rad公司),动物高压氧舱(DWC450-1150型)。
1.1.4 实验分组 根据随机数字法将大鼠分为假手术组、CCI组、HBO组,每组80只。
1.2 慢性脑缺血模型制备 将CCI组和HBO组大鼠按永久性结扎双侧颈总动脉方法建立CCI模型[10]。10%水合氯醛腹腔注射麻醉后,将大鼠取仰卧位固定于动物手术台中央。取颈部正中切口,分离颈部血管及伴行神经,依次结扎右侧颈总动脉近心端、远心端后离断血管。再用相同方法离断左侧颈总动脉。建模成功的标志为大鼠出现意识障碍,翻正反射消失。建模不成功或建模过程中死亡的大鼠用备用大鼠重新建模补充。假手术组大鼠在建模时操作方法相同,但仅分离左、右两侧颈总动脉,不结扎、也不离断颈总动脉。
1.3 治疗方法 HBO组大鼠在CCI建模成功苏醒12 h后进行HBO治疗,治疗前纯氧洗舱10 min,后匀速加压10 min,舱内压力达到0.2 MPa,稳压时间60 min,最后20 min匀速减压至常压,每日1次,持续治疗28 d。假手术组与CCI组不予治疗。
1.4 实验检测方法 建模成功后,每组分为4个检测时间点:7、14、21及28 d,每个时间点20只大鼠,采用Morris水迷宫实验测定各时间点大鼠学习、记忆能力,检测前均进行3 d训练,每天训练4次,记录各时间点大鼠逃逸潜伏时间和穿越平台次数(穿越平台次数仅取第28天)。建模28 d认知能力评估后处死大鼠,每组随机选取4只大鼠海马组织进行HE染色,8只大鼠海马组织RT-PCR法检测Nogo-A mRNA表达水平,8只大鼠海马组织Western blot法检测Nogo-A蛋白表达水平。
1.4.1 Morris水迷宫实验 将大鼠放入水中,记录其在120 s内找到并爬上平台的时间,超过120 s记录为120 s,每只大鼠在每个时间点测试2次,取均值作为逃逸潜伏时间测定结果。然后撤出平台,任选一相同入水点将大鼠放入水中,记录其在120 s内穿越原平台位置的次数,仅测试1次。每组大鼠取检测结果的平均值作为最后的测定结果。
1.4.2 HE染色 腹腔注射10%水合氯醛处死大鼠,断头取脑组织进行HE染色。选取海马组织平面,光学显微镜下观察海马组织结构和神经元形态变化。
1.4.3 RT-PCR法检测Nogo-A mRNA表达水平 取大鼠海马组织,经液氮冷冻后,研钵研磨。加入Tri试剂匀浆后,依次用氯仿、异丙嗪及无水乙醇分离、沉淀、洗涤溶解RNA,以提取总RNA备用。将提取的总RNA用琼脂糖凝胶电泳鉴定后,在42 ℃ 30 min、85 ℃5 min条件下用RT试剂盒将总RNA逆转录为cDNA。以Nogo-A引物(上游引物:5`-AGTCTTGGGAAGGGAAGGATAGTGA-3`,下游引物:5`-CTTTCGGTTGCTGAGGTA-3`)依次在94 ℃ 4 min 1个循环,94 ℃ 30 s、57 ℃30 s、72 ℃ 1 min 35个循环,72 ℃ 6 min条件下,扩增122bp建立PCR反应系。以β-actin为内参,将PCR扩增的产物进行电泳,目的基因Nogo-A mRNA的表达量以Nogo-A/β-actin的比值进行计算。
1.4.4 Western blot法检测Nogo-A蛋白表达水平 取大鼠海马组织洗净,充分裂解、冰浴后,以3000 r/min离心30 min提取总蛋白。采用BCA法对Nogo-A蛋白进行定量。总蛋白经煮沸、上样、电泳、转膜、封闭、浸泡、摇床后,分别依次加入Nogo-A抗体及β-actin,4 ℃孵育过夜。加入辣根过氧化物酶标记的二抗,室温孵育1 h。加入ECL化学发光显影液,充分显影。用Image-proplus 6.0图像程序分析软件对电泳条带进行灰度扫描分析,以Nogo-A/β-actin的比值代表Nogo-A蛋白相对表达量。
1.5 统计学方法 使用SPSS 21.0统计软件进行数据分析。符合正态分布的计量资料以表示,组间均数比较采用单因素方差分析,当方差分析有统计学差异时,进一步采用SNK-q检验进行不同组间的两两比较,界值设定为0.05。P<0.05为差异有统计学意义。
2 结果
2.1 认知能力评估 逃逸潜伏时间比较:三组间7、14、21及28 d各时间点的逃逸潜伏时间整体差异均具有统计学意义(P=0.0062、P=0.0023、P<0.0001、P<0.0001)。进一步两两比较显示,CCI组、HBO组各时间点逃逸潜伏时间均较假手术组延长(均P<0.05),HBO组各时间点逃逸潜伏时间较CCI组缩短(均P<0.05)(表1)。
穿越平台次数比较:三组间28 d穿越平台次数整体差异具有统计学意义(P=0.0015)。进一步两两比较显示,CCI组、HBO组穿越平台次数较假手术组减少(均P<0.05),HBO组穿越平台次数较CCI组增加(P<0.05)(表1)。
2.2 HE染色 假手术组大鼠海马组织神经元呈椭圆形,排列整齐,分布均匀,层次清晰,间隙致密,细胞结构正常,形态完整,核膜完整,核仁清晰。与假手术组相比,CCI组、HBO组大鼠海马组织神经元出现不同程度的损伤,神经元数量减少,排列疏松,间隙增大,层次紊乱,部分神经元出现坏死、凋亡,细胞间质水肿,胞核固缩溶解。HBO组大鼠海马组织神经元损伤程度较CCI组轻(图1)。
2.3 Nogo-A mRNA表达水平 大鼠海马组织Nogo-A mRNA的表达量在假手术组、CCI组、HBO组中分别为0.29±0.02、1.02±0.02、0.67±0.01,CCI组、HBO组Nogo-A mRNA表达水平均较假手术组升高(均P<0.05),HBO组较CCI组下降(P<0.05)。
2.4 Nogo-A蛋白表达水平 大鼠海马组织Nogo-A/β-actin的比值在假手术组、CCI组、HBO组中分别为1.00±0.02、5.28±0.31、3.01±0.17,CCI组、HBO组大鼠海马组织中Nogo-A表达水平均较假手术组升高(均P<0.05);HBO组大鼠海马组织中Nogo-A表达较CCI组下降(P<0.05)(图2)。

表1 各组大鼠学习记忆能力比较

图1 各组大鼠海马组织病理变化(HE染色×200)
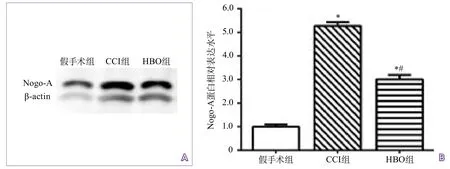
图2 各组大鼠海马组织Nogo-A蛋白表达水平比较
3 讨论
慢性脑缺血是以脑组织长期低灌注为特征的临床综合征。脑组织长期低灌注造成脑细胞结构和功能改变引起神经元损伤和脑白质病变,最终导致神经退行性病变及认知功能障碍[11-15]。研究发现,CCI相关认知功能障碍的发生与血脑屏障破坏、神经递质代谢紊乱、炎症损伤、氧化应激、免疫损伤、线粒体功能障碍、自由基损伤等机制相关[16-17]。如何改善CCI相关的认知功能障碍,逆转引起认知功能下降的病理生理过程,找到治疗认知功能障碍的分子靶点是亟待解决的课题。CCI发生的实质是脑组织因血流低灌注处于长期的缺血缺氧状态,而高压氧是治疗神经系统缺血缺氧性疾病的重要手段。涂杳然等[18]研究发现,HBO治疗能够通过下调Nogo-A及NgR表达减轻脑水肿,促进神经功能恢复。但高压氧能否改善慢性脑缺血引起的认知功能障碍的研究报道较少。
Morris水迷宫实验是常用的评估大鼠认知功能的方法[19]。本研究利用Morris水迷宫实验观察CCI大鼠建模后28 d内的认知能力变化及HBO治疗的干预作用。研究发现,CCI大鼠在建模3周左右进入慢性脑缺血期[20-21]。本研究中,在建模后4个时间点(7、14、21、28 d),CCI组大鼠均出现不同程度的认知功能下降,且没有恢复的趋势。这可能与永久性结扎双侧颈总动脉造成神经系统损伤较重,缺血缺氧状态一直未改善,随时间延长,脑细胞发生缺血缺氧损伤甚至坏死有关。同时,还观察到在上述4个时间点,HBO治疗均可以减轻慢性脑缺血导致的认知功能下降,提示HBO治疗在CCI后早期干预中改善了脑组织的缺血缺氧状态,使得部分脑细胞功能得以恢复,从而改善了认知功能。
本研究进一步探索了CCI大鼠海马组织形态及HBO治疗改善CCI大鼠认知功能的分子机制。研究发现,学习、记忆等认知功能下降是CCI的主要表现之一[22-23]。本研究中,大鼠海马组织HE染色结果提示CCI导致大鼠海马组织形态改变,结构出现异常,而HBO治疗可以减轻这种形态改变,减少神经元坏死或凋亡。
Nogo是Reticulon家族成员,主要编码Nogo-A、Nogo-B、Nogo-C 3种蛋白质,广泛分布于哺乳动物神经系统,在成年后中等强度表达于海马组织、大脑皮质等区域[24-28]。脑缺血损伤后神经可塑性下降是影响神经功能恢复的重要因素。Nogo-A蛋白在神经系统损伤后,其表达上调,导致神经可塑性下降,再生修复能力降低。史蕙青等[29]研究发现,慢性大脑缺血大鼠海马组织中Nogo-A表达量在15 d左右达到高峰,之后逐渐下降,但在30 d中仍高于假手术组。这与本研究相似,本研究发现建模28 d,Nogo-A mRNA及Nogo-A蛋白的表达水平在CCI组、HBO组大鼠海马组织中均较假手术组明显升高。提示Nogo-A蛋白可能参与了CCI后认知功能下降的病理过程。同时,本研究还发现,HBO组大鼠海马组织中Nogo-A mRNA及Nogo-A蛋白的表达水平较CCI组明显下降。结合海马组织形态和大鼠认知功能评估结果,提示HBO治疗可能通过抑制Nogo-A蛋白的表达,减少海马组织神经元坏死、凋亡改善CCI大鼠的认知功能。
综上所述,本研究结果提示HBO治疗能够改善CCI大鼠认知功能,其机制可能与降低CCI大鼠海马组织中Nogo-A mRNA、Nogo-A蛋白的表达水平相关。这为临床治疗CCI相关认知功能障碍提供了新的思路和治疗靶点。但是,本研究由于样本量较少,未能在各个时间点取大鼠海马组织进行Nogo-A mRNA、Nogo-A蛋白检测,未能呈现慢性脑缺血及HBO治疗干预后Nogo-A蛋白的动态变化。
【点睛】本研究发现高压氧治疗能够改善慢性脑缺血大鼠的认知功能,其机制可能与降低海马组织Nogo-A mRNA、Nogo-A蛋白的表达水平有关。
