棉花离体不定根系的发生对色素腺体密度和棉酚含量的影响
2020-08-27欧二绫赵懿琛赵德刚
欧二绫,赵懿琛,阳 腾,赵德刚,2
(1.贵州大学 山地植物资源保护与种质创新省部共建教育部重点实验室,贵州省农业生物工程重点实验室,生命科学学院,茶学院,贵阳 550025;2.国家农业部植物新品种DUS测试贵阳分中心,贵州省农业科学院,贵阳 550006)
棉花(Gossypiumspp)属于锦葵科棉属植物,是世界上最重要的经济作物之一[1]。棉属植物能产生一种特有的植保素—棉酚(Gossypol),棉酚是棉花所特有的一种多酚羟基联萘醛类次生代谢物,经由甲羟戊酸途径(MVA)在细胞质中合成[2],在法尼基二磷酸合成酶(FPS)的催化作用下经异戊烯基焦磷酸(IPP)生成法尼基二磷酸,再经杜松烯合酶(CADS)、转录因子(GaWRKY1)以及杜松烯-8-羟化酶(GaCYP706B1)等几种关键酶的催化作用下代谢合成棉酚[3]。棉酚的生物合成有多种酶和转录因子的参与。近年来,研究发现棉酚在抗生育、抗氧化、抗癌、抗病毒和抗菌等方面具有卓越的功效[4-8]。因此对于棉酚的功能、作用以及活性研究也在逐渐增加[9-13]。
已有研究通过测定种子萌发后的子叶、根系和离体根系无性系的棉酚动态变化,得知棉酚含量在根系中逐渐增加并积累,证明棉花根系是棉酚主要合成部位,并由根系向地上部分输送,储存至地上部分的色素腺体中[14-15]。
为了进一步明确棉酚是否只在根系合成,棉酚的合成机制,以及与色素腺体的关系。本研究利用组培技术获得无菌种子苗、无根幼苗和有根幼苗以及生根数不同的幼苗,对它们的色素腺体密度、棉酚含量以及棉酚生物合成关键基因表达量进行分析。以期阐述棉花根系与色素腺体密度和棉酚含量之间的关系,为发掘更多棉酚生物合成关键基因和腺体合成相关基因,通过构建干涉载体或CRISPR/cas9系统编辑创制植株有酚,种子低酚的棉花新种质提供理论基础。
1 材料与方法
1.1 试验材料
试验选用的‘中S9612’(Gossypouimhirsutum)种子由中国农业科学院棉花研究所惠赠,该材料属有腺体高酚陆地棉品种。
1.2 试验方法
1.2.1 不同生根状态幼苗培育 陆地棉‘中S9612’棉籽经浓硫酸脱绒后,清水漂洗干净,种子浸泡4~5 h至种壳变软,于超净台中剥去种壳。种仁使用0.1%的升汞溶液消毒10 min后,无菌水清洗4~5次,无菌吸水纸吸干表面水分,接种于1/2 MS培养基(1/2 MS+30.0 g·L-1蔗糖+8.0 g·L-1琼脂)上。获得无菌苗后,根据1/2MS培养基和吲哚丁酸(IBA)促生根的特性,将生长至2~3片真叶的无菌苗,切取子叶以上 5~7 cm带真叶幼苗,分别放置于添加不同质量浓度(0、0.05、0.1、0.5和1.0 mg·L-1)IBA的1/2 MS培养基(1/2 MS+30.0 g·L-1蔗糖+ 8.0 g·L-1琼脂+不同质量浓度IBA)中,培养基pH均为5.8~6.0,121 ℃灭菌20 min。于 28~32 ℃,光照为2 000 lx的植物培养室培养。切口部位开始膨大并产生少量白色愈伤组织,5 d后开始产生不定根,20 d后获得5种生根状态不同的高酚棉幼苗材料,统计各处理组的生根情况用于后续试验。其中生根率=生根数/接种株数×100%,平均不定根数=不定根数/接种株数。
1.2.2 无根幼苗、有根幼苗与无菌种子苗培育 按“1.2.1”方法培育‘中S9612’种子萌发,待无菌苗生长至2~3片真叶时,将部分材料切取子叶以上5~7 cm带真叶幼苗置于未添加任何激素的MS培养基(4.43 g·L-1MS+30 g·L-1蔗糖+8 g·L-1琼脂)中,培养基pH为 5.8~6.0,处理材料部分伤口愈合,产生白色愈伤组织,部分生根,取有根幼苗和无根幼苗新长出茎段和叶片与无菌种子苗的茎段和叶片进行后续试验。
1.2.3 茎叶腺体密度观察 将获得的无根幼苗、有根幼苗以及不同生根状态幼苗各取4片大小较为一致的叶片(从上往下数第2片真叶),平铺于体式显微镜下观察腺体,每片叶片取5个视野的平均值作为叶片腺体密度的值,取样部位分别为蜜腺右、蜜腺左、中脉中、左脉中、右脉中[16];茎段取生长状态一致的各4段,将茎段剖开,去除内部组织留取表皮,平铺于体式显微镜下观察腺体,每个茎段随机选取5个视野的平均值作为茎段腺体密度值;采用Excel 2007、Oringin 8.5统计处理数据。
1.2.4 棉酚含量测定 采用超高效液相色谱法(UPLC)测定棉酚含量[17]。称取棉酚标准品0.1 g±0.1 mg溶于乙腈-0.2%磷酸水溶液中,配制成浓度分别为0.1、0.5、1、5、20、50 μg·mL-1的标准品溶液,0.22 μm的水性滤膜过滤,-20 ℃避光保存。棉花样品经45 ℃低温烘干至恒量,研磨破碎后过60目筛,称取0.1 g±0.1 mg溶于乙腈-0.2%磷酸水溶液,超声震荡提取15 min后, 1 000 g离心5 min,上清经0.22 μm的水性滤膜过滤,-20 ℃避光保存。
UPLC购自Thermo Fisher Scientific有限公司,色谱柱Hypersil GOLDTM C18柱(100 mm× 2.1 mm,1.9 μm);乙腈-0.2%磷酸为流动相;检测波长235 nm;进样量10 μL。
1.2.5 棉酚合成关键基因表达量测定 棉酚合成关键基因引物序列根据NCBI公布的棉花杜松烯合酶基因(CDN1,GenBank登录号: U88318.1)、WRKY转录因子(WRKY1,GenBank登录号:KF031069.1)、细胞色素P450单加氧酶基因(CYP706B1,GenBank登录号:AF332974.1)的CDS序列设计3对对应的荧光定量PCR引物,内参为棉花管家基因EF-1ɑ(表1)。引物合成委托英潍捷基(上海)贸易有限公司合成,且将引物溶解稀释成10 μmol·L-1的使用浓度。
总RNA的提取按照试剂盒RNAiso Plus(Takara,大连)提供的方法进行,微量核酸测定仪(Nanophotometer,广州)对RNA的质量和浓度进行检测,再经12 mg/mL琼脂糖凝胶电泳检测RNA的完整性;cDNA反转录合成按照反转录试剂盒High Capacity cDNA Reverse Transcription Kit(Takara,大连)提供的方法进行。再以cDNA为模板,使用EF-1ɑ基因引物(表1)进行内参PCR扩增,检测cDNA质量能否用于后续试验,反应程序为:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,25个循环,72 ℃ 10 min,扩增产物经12 mg/mL琼脂糖凝胶电泳检测。
将可用cDNA 10倍稀释作为模板,以内参基因EF-1α为参照,用3对荧光定量PCR引物(表1),参照SYBR Premix Ex TaqTM(Takara,大连)试剂盒说明进行Real time-PCR。反应程序为:50 ℃ 2 min,95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 45 s,25个循环,72 ℃ 10 min。每个样品做3次生物学重复,3次技术重复,试验数据的处理及分析采用ΔCT法。目的基因相对含 量=2-平均ΔCT, ΔCT=CT(样本/对照)-CT内参。

表1 引物及序列Table 1 Primers
2 结果与分析
2.1 不同生根状态幼苗色素腺体密度和棉酚含量
2.1.1 幼苗色素腺体密度 利用不同质量浓度IBA诱导获得一系列不同生根状态的幼苗(表2和图1)。从表2和图1可看出,随着IBA质量浓度的升高,幼苗生根率增加,平均不定根数也增多。随后进一步分析根系对色素腺体密度的影响,结果如图2所示,不定根多的幼苗茎叶腺体密度显著高于不定根少的。茎的腺体密度在平均不定根数1.7和2.3之间产生显著差异,叶的腺体密度在平均不定根数为2.4和3.1时逐渐趋于平稳。不同生根状态幼苗茎、叶的腺体密度总体趋势是:一定范围内,平均不定根数增多,茎、叶中色素腺体密度变大,随着不定根增加,无菌苗茎、叶的腺体密度逐渐趋于平稳,结果进一步证实腺体密度和不定根的多少不相关。
2.1.2 幼苗棉酚含量 从图3中可看出,平均不定根数为1.1和1.7的幼苗棉酚含量分别为 1.55 mg·g-1、1.65 mg·g-1,平均不定根数为2.3、2.4、3.1的幼苗棉酚含量分别为2.47 mg·g-1、2.00 mg·g-1、2.12 mg·g-1。幼苗棉酚含量在平均不定根数1.7和2.3之间产生显著差异,且平均不定根数为2.3的幼苗棉酚含量显著高于1.7的幼苗。一定范围内,随着诱导生根IBA质量浓度的升高,幼苗不定根根量增多,棉酚含量也增加,随后趋于平稳。结果表明棉酚含量随一定范围内生根数的增加而增加,但棉酚含量与生根数不成线性正相关。这与上述色素腺体密度的变化趋势一致,说明根系对色素腺体密度和棉酚含量的影响可能是同步的。
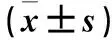
表2 不同生根状态幼苗Table 2 Seedlings with different rooting states

A.0 mg·L-1 IBA;B.0.05 mg·L-1 IBA;C.0.1 mg·L-1 IBA;D.0.5 mg·L-1 IBA;E.1 mg·L-1 IBA
不同的小写字母表示P<0.05,下同

图3 不同生根状态幼苗的棉酚含量Fig.3 Content of gossypol in seedlings with different rooting states
2.2 无根幼苗与有根幼苗色素腺体密度和棉酚含量
为了明确根系是否为棉酚的唯一合成部位,以及根系是否对腺体有影响,对无根幼苗和有根幼苗的茎段和叶片进行腺体密度观察统计。在相同的放大倍数下,茎段中的色素腺体呈不规则分布,体积较大(图4-A和图4-B);而叶片中的色素腺体分布较均匀,体积较小(图4-C和图4-D)。幼苗在无根状态下(图5),茎叶色素腺体密度显著低于有根幼苗。同时,无根幼苗茎叶棉酚含量显著低于有根幼苗,根系中的棉酚含量远远高于其他部位。

A.无根幼苗茎色素腺体;B.有根幼苗茎色素腺体;C.无根幼苗叶色素腺体;D.有根幼苗叶色素腺体

图5 无根幼苗与有根幼苗腺体密度和棉酚含量变化Fig.5 Changes in density of pigment glands and content of gossypol of rootless seedlings and rooted seedlings
2.3 不同生根状态幼苗全株棉酚合成关键基因表达量
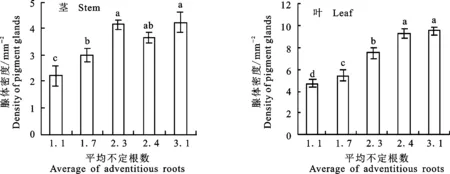
棉酚含量除了与根系和腺体密度相关外,棉酚生物合成关键基因也是重要的影响因素之一。因此,测定不同生根状态幼苗中棉酚生物合成关键基因表达量,并对其进行分析。如图6所示,GhCDN1和GhWRKY1基因表达量随平均不定根数的增加而增加,说明GhCDN1和GhWRKY1表达趋势与棉酚含量变化趋势基本一致。对棉酚具有反馈调节作用的GhCYP706B1基因表达量随平均不定根数的增加而降低,GhCYP706B1表达模式与棉酚含量变化趋势相反。
2.4 种子无菌苗不同组织棉酚合成关键基因表达量
为了解根系为何是棉酚主要合成部位,对未处理的种子无菌苗各组织棉酚生物合成关键基因表达量进行测定。结果如图7所示,未处理种子无菌苗中,GhCDN1、GhWRKY1和GhCYP706B1表达量均在根中最高,叶次之,茎最低,且根的表达量与茎叶均差异显著。
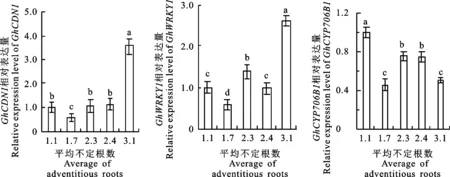
图6 不同生根状态幼苗棉酚合成关键基因相对表达量Fig.6 Relative expression level of key genes for gossypol biosynthesis in seedlings with different rooting states
2.5 无根幼苗和有根幼苗不同组织棉酚合成关键基因表达量
明确根系为棉酚主要合成部位后,为了解其他部位是否也合成棉酚,比较无根幼苗与有根幼苗不同组织的棉酚合成关键基因表达量。从图8可看出,无根幼苗地上部分GhCDN1、GhWRKY1和GhCYP706B1表达量均高于有根幼苗。有根幼苗根系棉酚含量显著高于茎叶,与种子无菌苗根系棉酚含量最高实验结果一致。推测地上部分可能存在棉酚的生物合成,合成棉酚含量较根系弱,不能引起棉酚含量发生显著变化。
3 讨 论
棉酚的生物合成受羟甲基戊二酰CoA还原酶[18]、法尼基二磷酸合成酶[19]、杜松烯合酶[20-21]、杜松萜烯-8-羟化酶[22]、脱氧半棉酚-6-O-甲基转移酶[23]、转录因子GhWRKY[24]、细胞色素P450还原酶和单加氧酶[25-26]、Dirigent蛋白[27]等酶和转录因子的调控。Tian等[28]研究发现,棉酚的积累通常伴随着杜松烯合酶CDN基因和细胞色素P450单加氧酶CYP706B1基因的激活,GhWRKY1主要是结合杜松烯合酶并调控其活性参与棉酚合成调控的转录因子[29],此3种基因在棉酚的积累过程中相当活跃。故以GhCDN1、GhWRKY1和GhCYP706B1作为棉酚生物合成的关键基因进行分析。本研究结果表明,棉酚合成与根系之间有着密切的关系,在不同生根状态幼苗中,测定全株幼苗的棉酚含量,平均不定根数多的幼苗棉酚含量高于平均不定根数少的,GhCDN1和GhWRKY1的表达量在平均不定根数多的幼苗中升高,GhCYP706B1的表达量反而降低,分析原因可能与倍半萜烯烃对(+)-δ-杜松烯-8-羟化酶CYP706B1的活性具有抑制作用有关[26],导致GhCYP706B1表达量降低。有根幼苗茎叶的棉酚含量高于无根幼苗,测定幼苗各组织关键基因表达量也发现,3个关键基因均在根系中表达最高,证明棉花的根系确实是棉酚主要合成部位,这与祝水金等[14]和Smith[15]的研究结果一致。
图7 种子无菌苗不同组织棉酚合成关键基因相对表达量Fig.7 Relative expression level of key genes for gossypol biosynthesis in different tissues of sterile seedlings
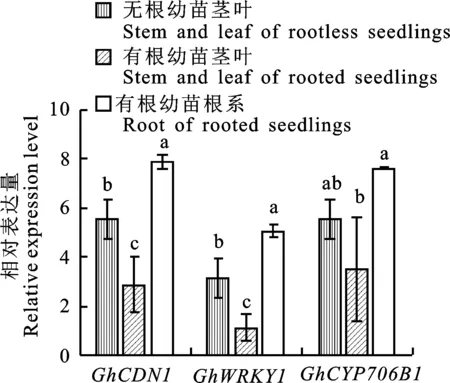
图8 有根幼苗与无根幼苗棉酚合成关键基因相对表达量Fig.8 Relative expression level of key genes for gossypol biosynthesis in rooted and rootless seedlings
Ma等[30]认为,腺体的发育途径与棉酚合成途径是相互独立的,但控制腺体发育形成相关基因又能与参加次生代谢物合成的TPSs、WRKY、CDN1基因的启动子区域发生互作,影响棉酚含量。在种子无菌苗中,除根系外,GhCDN1、GhWRKY1和GhCYP706B1在叶中的表达量最高,棉酚含量也高于茎,可能与腺体有关,茎的腺体体积较大,分布不规则,叶的腺体体积较小,分布较均匀,统计结果表明叶的腺体密度远高于茎,而腺体又能对棉酚含量产生影响,故叶的棉酚含量高于茎。在无根幼苗中,茎叶的基因表达量较有根幼苗高,棉酚含量却低于有根幼苗,由于根系是棉酚的主要合成部位,缺失根系的幼苗合成棉酚能力下降,存在于地上部分的腺体与棉酚合成相关基因的启动子区发生互作导致基因表达量升高,只是没能引起棉酚含量发生显著变化,这与祝水金等[14]认为控制色素腺体的基因可能同时影响棉酚合成能力的猜测相符合。腺体是储存棉酚的场所[15],在不同生根状态幼苗中,当平均不定根数为2.4、3.1时,对应的棉酚含量较平均不定根数为2.3的棉酚含量有所下降,而茎叶的腺体密度并没有相应的降低,表现为腺体密度和棉酚含量不成显著正相关,这与前人的研究结果一致[30]。
考虑到激素对基因表达的影响,比较添加 0 mg·L-1IBA培养基上生长幼苗与无根幼苗的基因表达量,发现添加0 mg·L-1IBA培养基上生长的幼苗地上部分3个关键基因的表达量显著低于无根幼苗,但棉酚含量显著高于无根幼苗,腺体密度无显著差异,更加证明根系对棉酚含量起决定性作用,棉酚合成关键基因表达量的高低不仅与棉酚含量相关,腺体也是其中一个影响因素。本研究明确根系、棉酚和腺体三者之间的关系,证实利用激素诱导生根的方式用于证明根系、棉酚与腺体之间的关系是可行的。后期可利用有腺体低酚棉与无腺体低酚棉进行类似研究,进一步探究腺体与棉酚的关系。
