果胶降解菌的筛选、鉴定及发酵产酶条件优化
2020-08-26姜立春杨彩萍陈佩瑶胡榆琳武炳秀阮期平
姜立春,杨彩萍,陈佩瑶,胡榆琳,何 静,武炳秀,罗 静,阮期平
(绵阳师范学院分子生物学与生物制药重点实验室,四川绵阳 621006)
0 引言
果胶是一种包含在陆生植物初生细胞壁中的杂多糖,是植物细胞壁的重要组成部分.果胶酶是一系列催化果胶物质的半乳糖醛酸长链残基的糖苷键水解酶的总称,属于复合酶[1].根据果胶酶对底物作用的不同方式可分为四大类:果胶酯酶、裂解酶、原果胶酶和聚半乳糖醛酸酶[2].果胶酶在生物领域应用较为广泛.在酿造中,分解植物材料,因此有助于从麦芽中提取香精;由于果胶的存在,致使酒产生烟雾或浑浊,果胶酶可打破这种现状,使酒澄清;在纺织业中,果胶酶可将果胶分解为低分子的水溶性寡聚物,从而提高纺织材料的吸收性能和白度,避免纤维破坏[3].此外,果胶酶通过分解茶叶中的果胶,用于茶的发酵,以及通过避免乳化作用的形成,而用于油脂萃取果胶酶原生质体融合技术与植物病理学方面[4].
果胶酶可以从微生物(如细菌和真菌等)或植物中的分离获得[5],但来源于植物的果胶酶产量低且不容易分离、提取与纯化,进而很难大规模生产.目前,微生物已成为生产果胶酶较好的生物资源,包括枯草芽孢杆菌(Bacillussubtilis)、黑曲霉(Aspergillusniger)、米根霉(Rhizopusoryzae)、囊酵母(Zygoascussp.)等[6-8],其中黑曲霉也已成为工业生产果胶酶较为常见的真菌菌株[9],但果胶酶的产量较小且酶活不理想远不能满足国内市场日益增长的需求.为此,选育适合于工业化生产的果胶酶高产菌,是提高我国果胶酶制剂的质量与降低成本的基础与关键.
本试验旨在通过以果胶作为唯一碳源的选择性培养基,从腐烂的水果中,筛选出具有较高果胶降解能力的菌株,再通过后续产酶条件优化试验,获取高产果胶酶的生产菌株,以期为工业化生产果胶酶提供试验依据.
1 材料与方法
1.1 材料
香蕉、苹果、橘子、柚子的果肉及果皮的腐烂部分.
1.2 培养基
果胶琼脂培养基[7]:K2HPO41.0 g,MgSO40.5 g,NaNO33.0 g,果胶2.0 g, FeSO4·7H2O 0.01 g,蒸馏水1.0 L,pH5.5,琼脂20.0 g.
PDA培养基:马铃薯200.0 g去皮,切块煮沸30 min,然后用纱布过滤,再加葡萄糖20.0 g及琼脂15.0~20.0 g,溶化后补足水至l.0 L,pH值自然.
液体发酵培养基:K2HPO40.01 g,MgSO40.05 g,NaNO30.3 g,FeSO40.001 g,蔗糖0.5 g,水0.1 L,pH 5.8.
牛肉膏蛋白胨斜面培养基:牛肉膏3.0 g,NaCl 5.0 g,蛋白胨10.0 g,蒸馏水l.0 L,pH自然,琼脂15.0~20.0 g.
1.3 试验方法
1.3.1 分离与纯化 称取大约1.0 g香蕉、苹果、柚子等水果的果肉及果皮的腐烂部分,置于盛有100 mL无菌水的锥形瓶中,用玻璃棒搅匀,即得10-2菌悬液.继续稀释,分别得到10-3、10-4、10-5、10-6、10-7的菌悬液.用移液枪吸取0.1~0.2 mL 10-4、10-5、10-6、10-7菌悬液至果胶琼脂培养基平板,每个稀释度设3个重复,用无菌涂布器涂抹均匀.然后将所有平板放入28℃恒温培养箱中倒置培养3~5 d.待菌落长出纯化后,对单菌落进行编号.
1.3.2 初筛 分别挑取少许菌苔,点接于果胶琼脂培养基的平板上,于28℃发酵培养3~5 d.用游标卡尺测量单菌落的直径(d),再将配制好的卢戈氏碘液缓缓倾倒于平板上,静置6 min,倒掉卢戈氏碘液,用生理盐水进行洗涤,测量其变色圈直径(D),计算后者与前者的比值(D/d).
1.3.3 复筛 选择比值相对较大的菌株,将其接种于PDA斜面培养基上,28℃培养3 d.用接种环从斜面上刮取适量菌株于盛有30 mL液体发酵培养基的250 mL锥形瓶中,于28℃ 150 r/min振荡培养72 h.将发酵液装入离心管中,于4℃,3 000 r/min离心5 min,得到的上清液即为粗酶液.测定各菌株的酶活,选取酶活相对较高的菌株进行后续实验.
1.3.4 酶活测定
(1) D-半乳糖醛酸标准曲线 取10支试管,分别加入0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL的半乳糖醛酸标准溶液(浓度为1.0 mg/mL),再向各管中加蒸馏水至2.0 mL,分别加3.0 mL DNS试剂,沸水浴10 min.将各试管从沸水中取出,用流水冷却至室温,加蒸馏水定容至20 mL.以未加半乳糖醛酸标准溶液的试管为空白对照,于540 nm处测定OD540值.每管设3个平行.以半乳糖醛酸的含量为横坐标,OD540值为纵坐标,绘制标准曲线.
(2)酶活测定方法 分别取粗酶液0.5 mL于5支试管中,另外再取5支试管,分别加入2.5 mL 1.0%果胶溶液.将其中一支装有0.5 mL粗酶液的试管置于沸水浴中10 min,灭活(空白对照),然后将其余下的4支试管和装有2.5 mL 1.0%果胶溶液的5支试管均置于50℃的恒温水浴锅中5 min.然后将酶液(包括灭活的酶液)与果胶溶液混匀,于50℃水浴反应30 min.取1.0 mL反应液于具塞试管中,再加入2.0 mL DNS试剂,接着沸水浴10 min.取出后用流水冷却至室温,加蒸馏水至20 mL,摇匀,于4℃ 3 000 r/min离心5 min,再在540 nm处测定OD值.每个反应设3个平行.在此条件下,将1 mL酶液每分钟水解果胶生成1 μg半乳糖醛酸定义为一个酶活力单位[10].酶活力计算公式:X=(A-A0)×N×3×1 000/K×t,各字母表示的含义,A:酶样吸光度;A0:酶空白样吸光度;N:酶液稀释倍数;3:测定酶活时,取了反应液的1/3;1 000:1mg D-半乳糖醛酸为1 000 μg;K:标准曲线的斜率;t:反应时间.
1.3.5 菌株鉴定
(1) 形态观察 将筛选出的目的菌株在28℃下培养3~5 d,观察菌落形态.将已灭菌的PDA培养基倒入无菌平皿,待培养基冷却凝固后,用无菌镊子夹取已灭菌的盖玻片,以45°角插入培养基中(深度约占盖玻片长度的1/2),然后用接种环将菌株点接于盖玻片一侧的底部.将平板放入28℃恒温培养箱中倒置培养3~5 d.观察时,用镊子将盖玻片取出,置于载玻片上,滴加一滴棉蓝染色液于盖玻片上,在显微镜下观察其显微结构.
(2)分子鉴定
①DNA提取 将目的菌株接种于PDA液体培养基中,28℃摇床振荡培养72 h.再对发酵液进行离心,弃去上清液,用无菌水洗涤菌丝体,再用无菌滤纸将水分吸干.取100 mg左右的菌丝体于研钵中,加入液氮,将其迅速研磨成粉末状.采用常规SDS法提取基因组DNA[11],略有修改,-20℃保存备用.
②PCR扩增 采用通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4 (5’-TCCTCCGCTTATTGATATGC-3’)对其ITS-rDNA区进行扩增.反应体系为:10×PCR buffer 2.5 μL,25 mmol/L MgCl22.0μL,2.5 mmol/L dNTP 3.0 μL,5 U/μL Taq DNA酶0.25μL,正反向引物(10 mmol/L ITSl和ITS4)各1.0 μL,DNA模板2.0 μL,用ddH2O补至25μL.扩增反应体系为:95℃预变性2.5 min,94℃变性30 s,58℃退火30 s,72℃延伸70 s,共32个循环.循环结束后,于72℃延伸8 min.取1.5 μL PCR产物于1.0%琼脂糖凝胶电泳中进行检测,阳性扩增子送至成都擎科生物技术公司测序.
③生物信息学分析 将测得的序列在NCBI数据库使用BLAST软件进行比较,使用默认设置查找最相似的序列,并按E分数排序.用CLUSTAL X排列最相似的代表序列,并用默认设置进行多重比对.然后通过MEGA 7.0软件,构建出系统进化树.构建采用邻位相连法,Bootstrap采用P-distance,随机种子数1 000.
1.3.6 发酵产酶优化试验 初始培养条件为:温度30 ℃,时间60 h,初始pH为6.0,摇床转速150 r/min,接种量2%(v/v),装液量80 mL/250 mL.通过单因素试验考察了发酵时间、碳源、氮源、初始pH、接种量、温度对菌株JX20产果胶酶活力的影响.
(1)发酵时间 初始发酵时间调整初始为12、24、36、48、60、72、84、96、108 h,其它发酵条件为初始发酵条件.分析发酵时间对菌株JX20产果胶酶活力的影响.
(2) 碳源及其浓度 发酵时间为60 h,考察碳源分别为葡萄糖、淀粉、麦芽糖、蔗糖、果糖、乳糖、玉米粉、麦麸,其它发酵条件为初始发酵条件.分析碳源及其浓度对菌株JX20产果胶酶活力的影响.
(3) 氮源及其浓度 发酵时间为60 h、碳源源取上述实验确定的最优结果,考察氮源分别为牛肉膏、蛋白胨、酵母膏、豆粕、(NH4)2SO4、NH4NO3、柠檬酸铵,其它发酵条件为初始发酵条件.分析氮源及其浓度对菌株JX20产果胶酶活力的影响.
(4) 初始pH 发酵时间为60 h、氮源、氮源取上述实验确定的最优结果,考察初始pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,其它发酵条件为初始培养条件.分析初始pH对菌株JX20产果胶酶活力的影响.
(5) 接种量 培养时间60 h、氮源、氮源、初始pH取上述实验确定的最适结果,考察接种量分别为0.5%、1%、2%、4%、6%、8%、10%(v/v),其它发酵条件为初始发酵条件.分析接种量对菌株JX20产果胶酶活力的影响.
(6) 发酵温度 发酵时间为60 h、氮源、氮源、初始pH与接种量取上述实验确定的最适结果,考察发酵温度分别为25、28、31、34、37、40 ℃.分析发酵温度对菌株JX20产果胶酶活力的影响.以上试验每组3个平行,用软件Excel 2016绘制出发酵产酶条件优化的各个因素图.
(7)响应面法优化 根据上述单因素试验的结果,确定响应面法优化的最优区间.用Design-Expert软件设计4因素3水平响应面实验,探究发酵温度、麦芽糖浓度、酵母膏浓度以及初始pH等影响因素对果胶酶活力的影响,从而优化发酵条件.
2 结果与分析
2.1 菌株筛选
2.1.1 初筛 通过选择性培养基分离筛选到21株能产生果胶酶的菌株,加入卢戈氏碘液后,菌落周围出现了明显的透明圈,分别用游标卡尺测量菌落(d)与透明圈(D)的直径,并计算其比值.其比值大于2.0有菌株JX02、JX07、JX08、JX12、JX17、JX20,故选取这6个菌株进行液体摇瓶发酵,然后测酶活进行复筛.
2.1.2 复筛 将透明圈直径与菌落直径比值大于2.0的6个菌株JX02、JX07、JX08、JX12、JX17、JX20接种于液体产酶培养基进行摇瓶培养,72 h后,测定其发酵粗酶液的果胶酶活力.其中编号为JX20的菌株酶活为124.87 U·mL-1,相对于其它5种菌株来说,酶活力最高,故最终选取菌株JX20进行后续试验.
2.1.3 菌株的鉴定 将菌株JX20点接于PDA培养基上,观察其形态变化.结果发现该菌株生长速度较快,菌落正面初期为白色,培养时间稍长后,孢子变为黄绿色,且黄绿色部分越来越多.该菌落呈丝绒状,中央有白色凸起,有放射状沟纹.与培养基结合较牢固,不易挑取.菌落不透明,无渗出液,背面略带黄色.在插片法所得的盖玻片上滴加棉蓝染色液后,于镜下观察,菌丝有分隔,分枝较多,分生孢子梗由一根直立的菌丝形成,分生孢子为球形,分生孢子头呈放射状,顶囊近球形,产生数条放射状的分生孢子链.为此,初步鉴定其为曲霉属菌株.
PCR扩增产物进行测序,其有效长度为594bp.将测定得到的ITS-rDNA序列与GenBank数据库中的已知序列进行同源性比对和分析,寻找与目的基因序列同源性较高的分类地位的菌株,然后从数据库中选取相关种属菌株的的ITS-rDNA序列,采用N-J法构建系统发育进化树,结果如图1所示.从系统发育树看出菌株JX20与与曲霉属菌株的ITS序列同源性最高,且与黄曲霉(AspergillusflavusAG20 KG482648)聚于同一个分支上,且亲缘关系最近,同源性达到99%以上.结合菌株JX20菌落和菌丝形态特征,确定菌株JX20为黄曲霉(AspergillusflavusJX20).
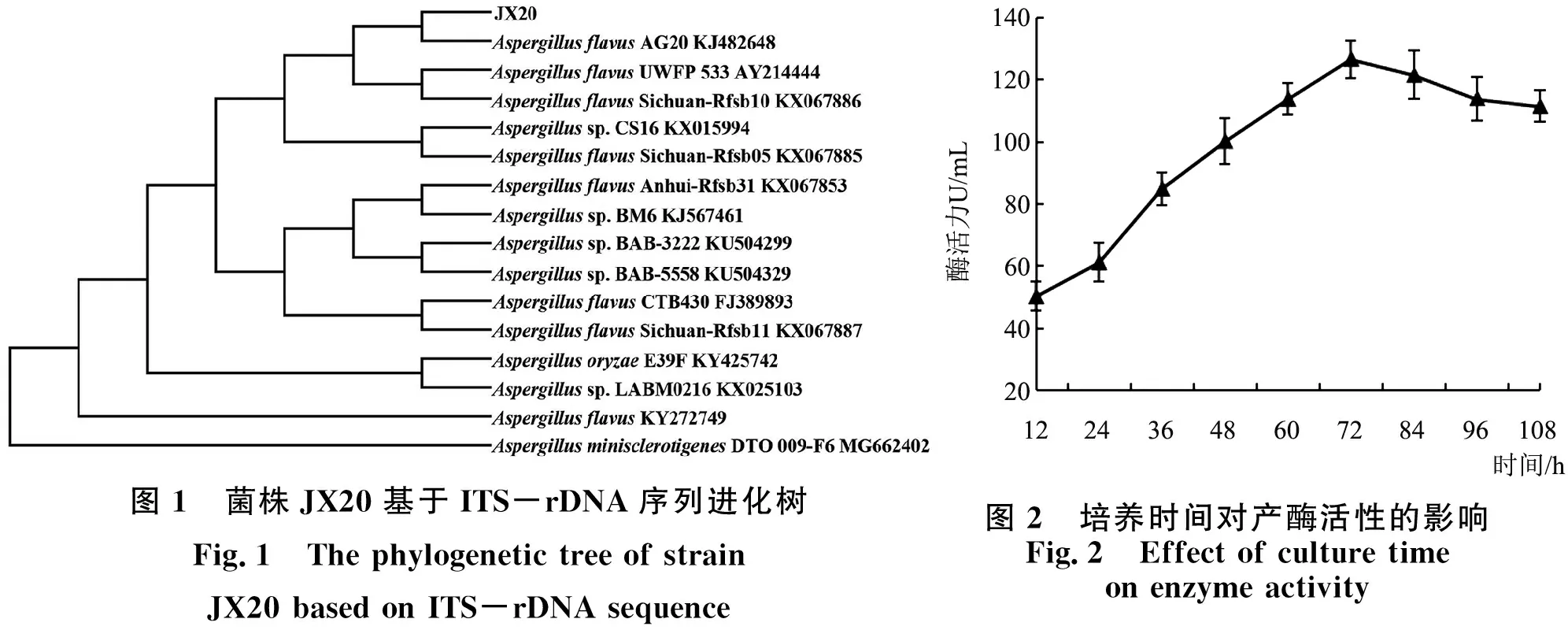
图1 菌株JX20基于ITS-rDNA序列进化树Fig.1 The phylogenetic tree of strain JX20 based on ITS-rDNA sequence图2 培养时间对产酶活性的影响 Fig.2 Effect of culture time on enzyme activity
2.2 发酵产酶条件优化
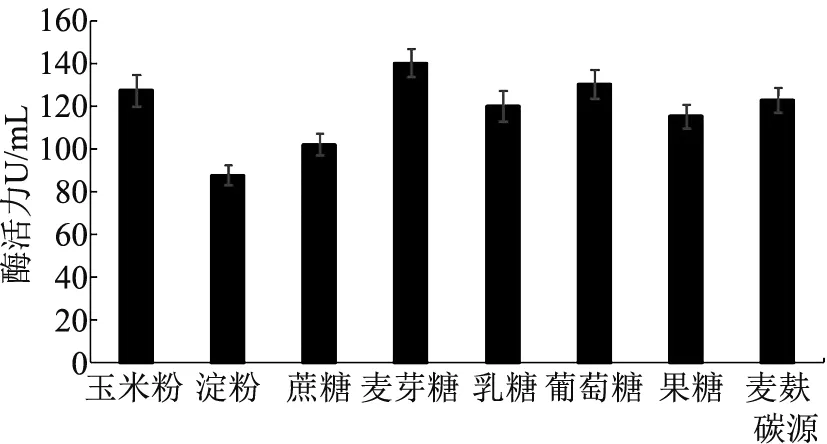
图3 碳源对产酶活性的影响Fig.3 Effect of carbon source on enzyme activity
2.2.1 发酵时间对菌株JX20果胶酶活性的影响 根据1.3.6(1)方法,分析发酵时间对产酶活性的影响,其结果如图2所示.该菌株在12~24 h酶活力变化不大,随着时间的延长酶活力持续升高,并于72 h达到峰值,为126.68 U/mL,之后酶活力开始缓慢下降.菌株JX20在培养初期,液体培养基内的营养物质主要用于菌体的生长需要,发酵产物积累较少.当酶活性达到峰值后,随着发酵时间的持续延长,酶活性开始略微降低,可能是由于营养物质的耗尽以及代谢产物的大量积累,导致菌体自溶[8].因此,选取72 h作为发酵产酶时间.
2.2.2 碳源及其浓度对菌株JX20产果胶酶的影响 根据1.3.6(2)方法,在培养基中分别加入1.0 %不同的碳源,分析碳源对产酶活性的影响,其结果见图3.当选择麦芽糖作碳源时,产果胶酶活力最高达到140.23 U/mL,而玉米粉、麦麸和葡萄糖作为碳源时,酶活力呈现下降趋势.当淀粉和蔗糖作为碳源时,酶活性降低比较明显.因此,菌株JX20培养的最适碳源为麦芽糖.
为考察麦芽糖不同浓度对产酶活性的影响,其结果如图4所示.随着麦芽糖浓度的增加,该菌的果胶酶活性逐渐升高,当其浓度为10 g/L时,其活性达到最高值,为140.23 U/mL;当麦芽糖浓度高于1.0 %时,其酶活性有所降低.取0.5%~1.5%的浓度范围进行优化发酵条件.
2.2.3 氮源及其浓度对菌株JX20产果胶酶的影响 根据1.3.6(3)方法,在发酵培养基中分别加入1.0 %的不同氮源,分析氮源对菌株JX20产果胶酶的影响,其结果见图5.微生物的生长代谢离不开氮源,氮源是组成蛋白质和核酸的重要物质.当氮源为无机氮(NH4)2SO4和NH4NO3时,果胶酶活性均较低,且低于108.59 U/mL;而氮源为有机氮时,菌株JX20发酵液的果胶酶活性相对于无机氮来说均有明显增高,当酵母膏作为氮源时,果胶酶活性达到峰值,为151.41U/mL.因此,菌株JX20的最适培养氮源为酵母膏.

图4 麦芽糖浓度对产酶活性的影响Fig.4Effect of maltose concentration on enzyme activity图5 氮源对产酶活性的影响Fig.5 Effect of nitrogen source on enzyme activity
为确定酵母膏不同浓度对发酵产酶活性的影响,其结果见图6.随着酵母膏浓度的增加,菌株JX20产果胶酶活性逐渐升高,当其浓度为20 g/L时,其酶活性达到峰值,为162.53U/mL;当酵母膏浓度高于2.0 %时,其酶活性有所降低.因此,酵母膏浓度为15 ~20 g/L 是优化的最佳范围.
2.2.4 培养基初始pH对菌株JX20产果胶酶活力的影响 根据1.3.6(4)方法,分析不同初始pH值对产果胶酶活性的影响,结果如图7所示.菌株JX20随着pH值的增大所产果胶酶活性逐渐增加,当pH值为5.0时酶活性达到峰值,为172.37 U/mL.而随着pH值的进一步增大,果胶酶的酶活反而下降明显,说明菌株JX20在弱酸性的条件下,比较适合产酶,pH值过高或过低对产酶都会产生很大的抑制作用.因此,优化发酵条件的最适pH值为4.5~5.5.
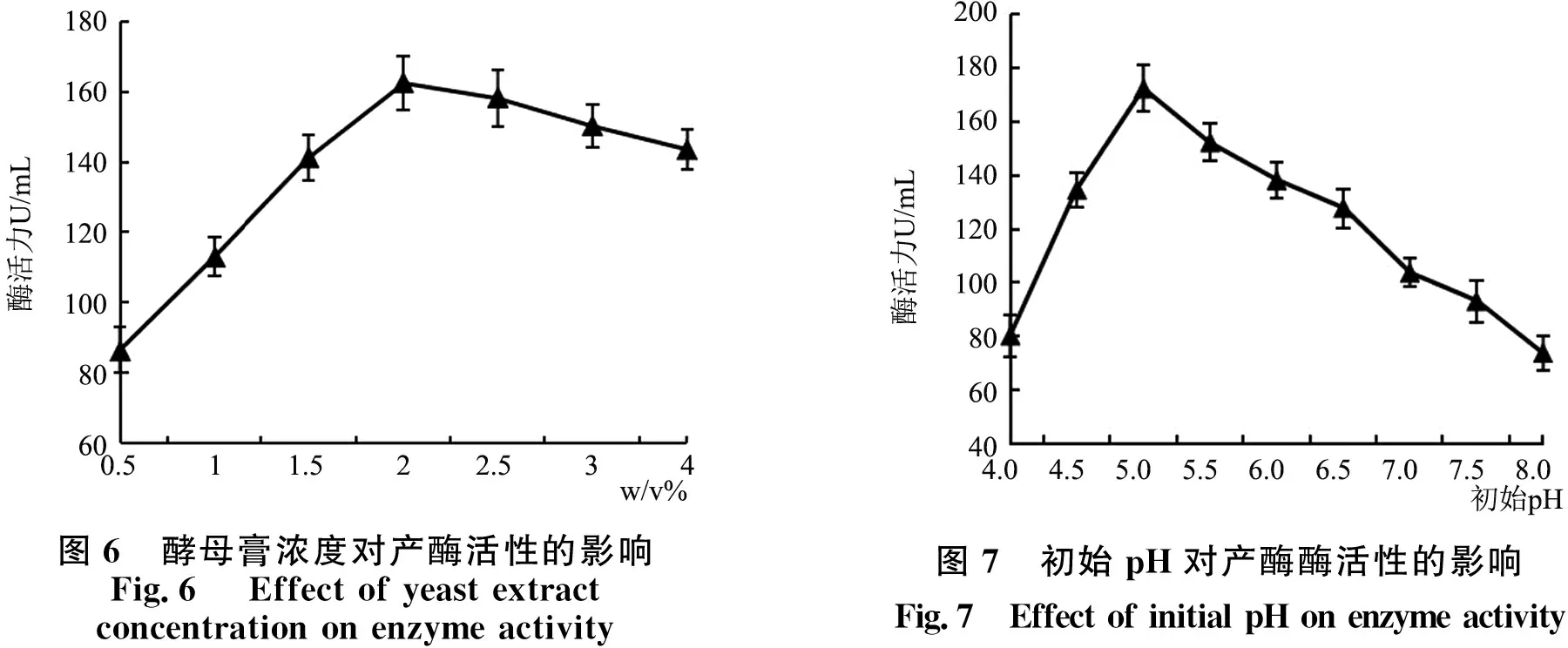
图6 酵母膏浓度对产酶活性的影响Fig.6 Effect of yeast extract concentration on enzyme activity图7 初始pH对产酶酶活性的影响Fig.7 Effect of initial pH on enzyme activity
2.2.5 接种量对菌株JX20果胶酶活力的影响 根据1.3.6(5)方法,分析不同接种量对产果胶酶活性的影响,结果如图8所示.当接种量在0.05-2.0%(v/v)时,随着接种量的增加,菌株JX20所产果胶酶的酶活明显升高;当接种量2.0%(v/v)时,其酶活性达到峰值,为180.33 U/mL.此后,随着接种量的增大酶活性略微下降,可能是由于接种量的增大导致发酵液中菌体浓度迅速过高,导致菌体生长过度旺盛,营养物质消耗过快,而溶氧却不足,导致代谢受抑制,最终产酶能力降低.因此,菌株JX20的最适接种量为2.0%.
2.2.6 发酵温度对菌株JX20果胶酶活力的影响 根据1.3.6(6)方法,分析发酵温度对菌株JX20产果胶酶活性的影响,结果由图9所示.当温度在20~31℃时,随着温度的升高,菌株JX20所产果胶酶的活性逐渐升高;当温度为31℃时,其酶活达到峰值,为202.66 U/mL,而当温度进一步升高时,酶活性反而下降比较明显,可能是因为温度过高,不利于菌株JX20代谢产酶.因此,优化发酵条件的最适发酵温度范围为28℃~34℃.

图8 接种量对产酶活性的影响Fig.8 Effect of inoculation amount on enzyme production activity图9 培养温度对产酶活性的影响Fig.9 Effect of culture temperature on enzyme production
2.2.7 响应面试验设计及最优条件的确定 根据上述果胶酶发酵试验的结果,用Design-Expert软件设计4因素3水平的响应面实验,以果胶酶酶活力大小作为考察指标,响应面试验设计的因素水平与试验结果如表1和表2所示.


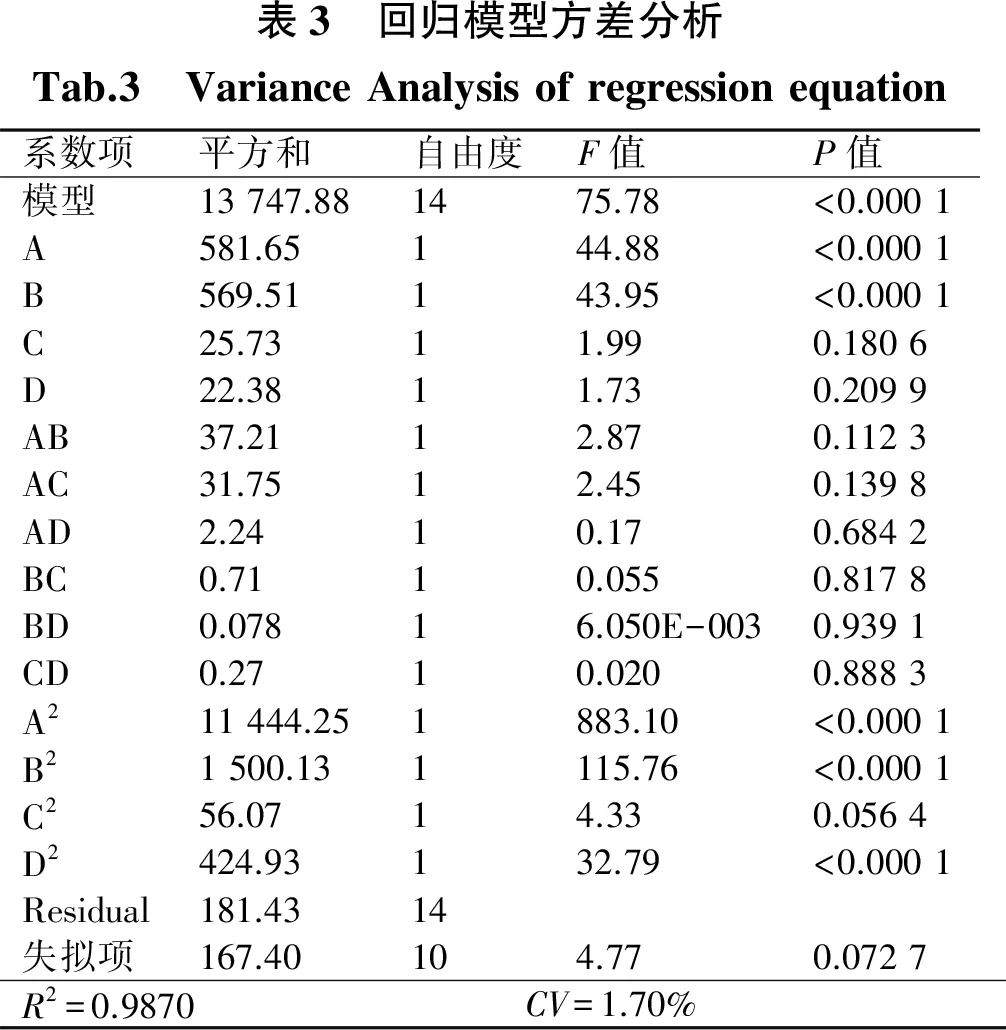
利用软件对试验数据进行分析得到以酶活性为响应值的回归线方程(表3)为:Y=237.87+9.21A+5.82B-1.94C+1.81D+1.53AB+2.82AC-0.75AD+0.21BC+0.070BD-0.26CD-42.00A2-3.80B2-2.94C2-8.09D2(R2=0.987 0,P<0.000 1).
由表3可知,回归方程的R2=0.987 0,近似为1,表明其拟合度较好.而CV=1.70%表明试验的重复性较高.而回归方程的P<0.000 1,说明对结果差异极显著;而失拟项的P>0.05,说明失拟项不显著.发酵条件的四个因素对酶活性的影响大小为A>B>C>D;一次项A、B,二次项A2、B2、D2都极显著,其他因素都不显著.利用Design-Expert软件绘制温度、麦芽糖浓度、酵母膏浓度以及初始pH四个因素之间的交互作用对酶活性影响的响应面如图10.

图10 两因素交互作用对果胶酶活力的影响Fig.10 Interaction effects of two factors on pectinase activity
根据响应面坡度的陡峭程度、等高线的密集程度及其成椭圆形的程度表示两因素交互作用影响大小的原则,由图10可知,温度与麦芽糖浓度之间所形成的交互作用最强,而初始pH与麦芽糖浓度所形成的交互作用最弱.结合方差分析可知各因素交互作用大小为AB>AC>AD>BC>CD>BD.
最后综合响应面结果分析出的果胶酶活力最优条件为麦芽糖0.95 %,酵母膏1.87 %,初始pH 5.06,培养温度为31.34℃.在此条件下进行3次重复性实验,其果胶酶酶活力为245.38 U/mL.结果与预测值基本符合,表示该模型与实际情况基本吻合,拟合良好.
3 结论与讨论
本研究从橘子、香蕉、苹果、柚子的果肉及果皮的腐烂部分等多份样品中筛选出一株高产果胶酶的菌株,利用无机盐培养基等作为摇瓶培养基材料,对菌株进行培养发酵,结合单因素法与响应面法对发酵条件进行优化从而得到酶活最适的条件.研究表明:发酵优化条件为麦芽糖0.95 %,酵母膏1.87 %,接种量2.0%,初始pH 5.06,发酵周期为72 h,培养温度为31.34 ℃,在此条件下,该菌的果胶酶活力达到245.38 U/mL;发酵条件对酶活力影响的大小顺序为:培养温度>麦芽糖浓度>酵母膏浓度>初始pH;以果胶酶活力为目标函数的模型为:Y=237.87+9.21A+5.82B-1.94C+1.81D+1.53AB+2.82AC-0.75AD+0.21BC+0.070BD-0.26CD-42.00A2-3.80B2-2.94C2-8.09D2(R2=0.987,P<0.000 1).最后对其进行形态学鉴定,并结合ITS-rDNA测序结果,确定该菌株为黄曲霉菌(Aspergillussp.).
本试验采用果胶酶卢戈氏碘液透明圈法分离果胶酶产生菌,获得果胶酶活力较高的野生菌株JX20.试验研究发现菌株JX20果胶酶的适宜pH是偏酸性,在pH5.0时其酶活性最高,当pH4.5~6.0时,仍具有较高的酶活性,所以在果皮发酵分解过程中,菌株JX20仍然具有较高果胶酶活性,这将为在酸性条件下降解果皮提供了可能.菌株JX20果胶酶属酸性,多用于水果榨汁和果汁澄清,且目前固体发酵的果胶酶酶活明显高于液体发酵产果胶酶的酶活[12].我国果胶酶生产工业领域以固体发酵生产为主,虽然产酶的酶活较高,但其杂蛋白较多分离纯化成本高,且产品的质量与产量达不到要求,因此需更进一步对液体发酵的研究[13].虽然通过发酵条件优化处理,使得果胶酶活力有所提高,但野生菌株的产酶活力相对活性较低,可将该菌株JX20通过诱变选育或者基因工程改良获得产果胶酶活性更高的优良菌株.
