18F-FDG PET/CT 在硬化性肺泡细胞瘤诊断中的价值
2020-08-26邵明岩徐荣
邵明岩,徐荣
(江西省人民医院,南昌大学附属人民医院,核医学科,南昌 330006)
硬化性肺泡细胞瘤 (pulmonary sclerosing pneumocytoma, PSP)是少见的良性肿瘤,占肺内良性肿瘤的3%-5%,多数无明显临床症状,个别病人可有咳嗽、咳痰或咯血,临床诊断困难,常规胸片及CT 上缺乏典型的影像征象常表现为孤立性肺结节,不易与其他肺部良、恶性病变鉴别,因此常被误诊[1,2]。 近年随着功能成像的发展,18F-氟脱氧葡萄糖正电子发射体层成像(18F-fluorodeoxyglucose positron-emission tomography,18F-FDG PET)/CT 已广泛应用于肺肿瘤良恶性的鉴别,PET/CT 不仅可以显示PSP 的解剖结构, 还可以从代谢、 血流灌注、功能等方面显示PSP 的特征。 本文回顾性分析确诊为PSP 的25 例病人的临床及PET/CT 影像资料, 探讨PSP 的PET/CT 影像特征及代谢表现,提高PET/CT 对PSP 的诊断率。
1 资料与方法
1.1 一般资料 回顾性收集2015 年12 月-2019 年12 月江西省人民医院确诊为PSP 的病人25 例,其中男 9 例,女 16 例;年龄 31-75 岁,平均(50.1±12.5)岁。 临床表现为胸闷2 例,咳嗽、咳痰并咯血1例,胸痛3 例,其余无明显呼吸系统症状。PSP 病人中既往有肾移植、胃底贲门癌(未治疗)、糖尿病、不明原因肋骨骨折病史的各1 例。 按PSP 的放射性摄取增高情况,以肺本底SUVmax(是指病变以外正常肺组织的最大标准化放射性摄取值) 为界值,分为高于肺本底(A 组)及低于或等于肺本底(B 组)2 组,其中 A 组 14 例,B 组 11 例。见表 2。纳入标准:⑴术前均行PET/CT 检查及CT 检查;⑵临床、病理资料完整。排除标准:⑴空腹血糖>10mmol/L;⑵各种原因导致扫描图像质量差、伪影大,影响图像分析及诊断。
1.2 设备与方法18F-FDG PET/CT 检查采用美国GE 公司生产的 Discovery-64CT 和 MINItrace 回旋加速器,18F-FDG 由 TRACERLab FX-FN 合成器完成,FDG 的放化纯度>96%。检查前病人空腹4 h 以上,测量身高、体质量和血糖,血糖控制在10 mmol/L 以下;经肘静脉注射18F-FDG,剂量0.15 mCi/kg体质量,在安静、暗光的休息室静卧40-60 min,检查前饮水800-1000 mL, 检查前排空尿液。 根据PET/CT 扫描计划,扫描7 个床位,先行CT 扫描,再行PET 图像采集。 具体参数:管电压120 kV,管电流 20-200 mA, 采用 FORE-Iterative 重建,FOV为50cmx50cm,发射扫描采集时间25 min,轴向间隔 4.25mm,层厚 3.75 mm,矩阵 128×128,病人仰卧位双手上举, 扫描范围从颅顶至股骨上1/3 段,图像融合通过AW4.6 工作站重建横断面、冠状面、矢状面影像。
1.3 图像分析 采用兴趣区(ROI)分析及半定量分析法,通过Xeleris 及AW4.6 工作站勾画PSP 病灶ROI,直接测定肺本底及PSP 的标准化放射性摄取值 (standard uptake value, SUV), 一般取 SUVmax值,SUVmax 值是反应组织的核素最大摄取量,克服了不同检查时注射剂量差异、 注射显像时间间隔差异及不同患者体内放射性分布差异等因素,使得结果更加准确稳定,重复性及可比性好,所有代谢参数 (肺本底 SUVmax、PSPSUVmax) 均为AW4.6 工作站提供的一键测量模式完成。CT 值、病变最长径均由1 名医师在AW4.6 工作站应用自带测量工具直接测定。 由本院有经验的1 名PET-CT主任医师和1 名主治医师同时双盲阅片, 意见不同时由科室集体讨论决定。
1.4 统计学分析 采用SPSS17.0 统计软件进行数据分析。 符合正态分布的计量资料以均数±标准差()表示,2 组间比较采用 t 检验;计数资料以例(%)表示,2 组间比较采用 χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 PSP 的 PET/CT 表现 25 例 PSP 病人均表现为孤立性边缘清晰的高密度影,其中浅分叶6 例,周围型 20 例,中央型 5 例。 其中左肺 12 个病灶,分别为左肺上叶 8 个,占比32.0%(8/25),病变最长径 8.9-10.6mm;左肺下叶 4 个,占比 16.0%(4/25),病变最长径(10.8-20.1)mm;右肺13 个病灶,分别为右肺上叶 7 个,占比28.0%(7/25),病变最长径9.8-21.2mm,右肺下叶 6 个,占比 24.0%(6/25),病变最长径10.2-29.5mm;25 例PSP 病变最长径均值16.1±5.8mm。PSP 的CT 伴随征象主要有有砂粒状钙化、囊变、周围空气潴留征(典型可表现为空气新月征)、尾征,其中15 例伴有周围空气潴留征,9例显示尾征,11 例显示边缘或内部的砂粒状钙化,12 例显示病灶内可见小斑片状稍低密度影, 全部病变均未见毛刺或空洞。PET/CT 显像中 25 例PSP病变,SUVmax 平均 2.4±2.3, 肺本底 SUVmax 平均1.0±0.8;其中 A 组(SUV 高于肺本底)14 例(56.0%),SUVmax 值 3.7±2.4,CT 值 (40.2±13.7)Hu ;B 组(SUV 低于或等于肺本底)11 例 (44.0%),SUVmax值 0.8±0.2,CT 值(42.6±15.9)Hu。所有高摄取的 PSP均呈结节状摄取增高,摄取较均匀,2 组的CT 伴随征象见表1。
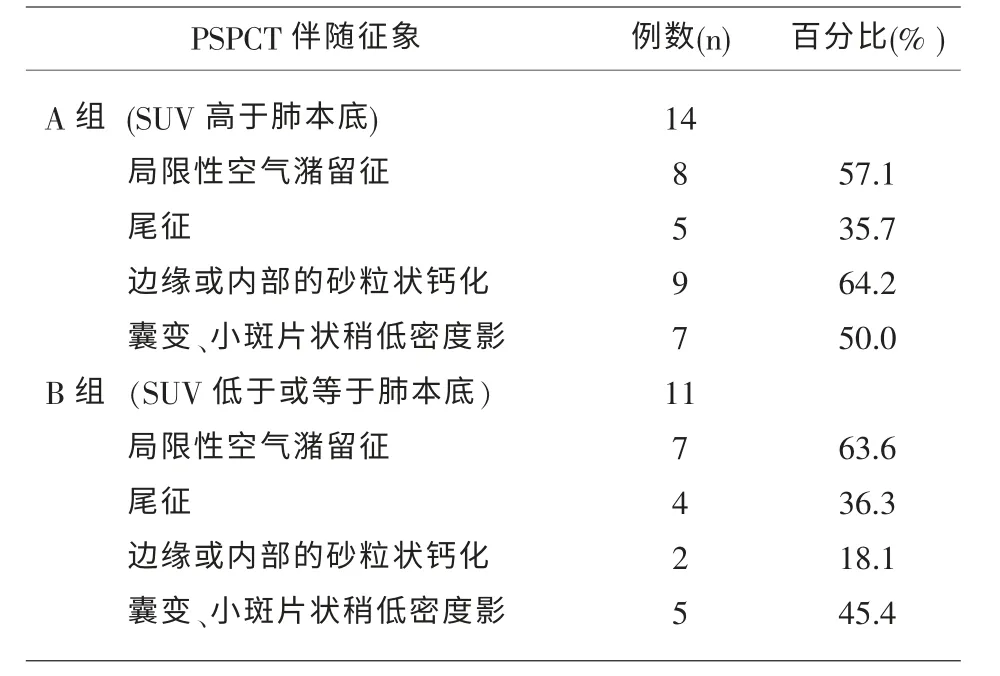
表1 PSP的CT伴随征象
2.2 2 组间 PSP 最长径、CT 值及 CT 伴随征象参数的比较 2 组间 SUVmax 与 PSP 的最长径, 两者差异有统计学意义 (P=0.014);2 组CT 值差异无统计学意义(P=0.746);SUVmax 高于肺本底者钙化(64.2%)发生率较低于肺本底者(18.1%)高(P=0.021),差异有统计学意义,见表2。 囊变、周围空气潴留征、尾征两者差异无明显统计学意义(均P>0.5)。
3 讨论
硬化性肺泡细胞瘤是临床上少见的良性肿瘤,由肺硬化性血管瘤 (pulmonary sclerosing hemangioma,PSH)演变而来,最早由 Liebow 和 Hubbell 等于 1956 年报道。 2015 年 WHO 将 PSP 归入肺腺瘤,为一种肺细胞起源肿瘤,通过免疫组织化学和免疫电镜研究,PSP 由类似Ⅱ型肺泡上皮及圆形细胞构成,PSP 组织学可含有实性、乳头状、硬化及出血(血管瘤样区)四种结构。PSP 一般无明显临床症状,多为偶然发现,仅少数病人有咳嗽、咳痰、痰中带血或咯血、胸背痛等。 本组大多数PSP 病人为偶然发现,有呼吸系统症状的6 例,包括胸闷、胸痛、咳嗽、咳痰及咯血;PSP 以女性为多,男女发病比例文献报道可高达 1:8,但多数在 1:4 左右[3-7],肿瘤内类固醇性激素受体的表达特别是黄体激素受体的表达说明了PSP 好发于女性的原因;PSP 发病年龄范围较宽,好发于 15-76 岁[5,7],平均年龄多在 50岁左右。 本组病例女性较多,平均年龄50.4 岁,基本与文献[3]报道一致,但PSP 病人男女比例约1:2左右,高于文献[3]报道,可能与PET/CT 不如CT 普及有关, 也可能与本中心受检者的性别构成比有关。
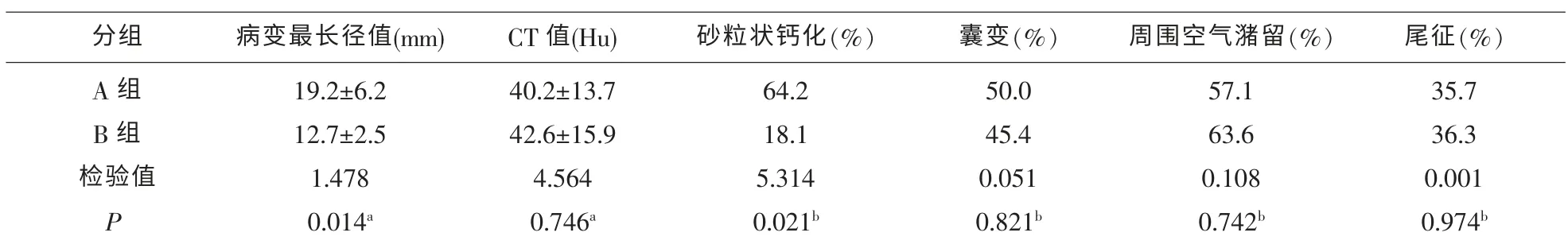
表2 2组间PSP病变最长径、CT值及CT伴随征象参数的比较
PSP 由于临床症状及影像表现均不典型,术前诊断较困难。 随着PET/CT 的普及,越来越多的应用于PSP 的诊断中,PET/CT 作为新型的功能代谢显像,能够从分子水平揭示PSP 的代谢、氧耗、血流灌注及生化等,既往PET/CT 相关研究表明PET/CT 对PSP 诊断具有一定的价值,PET/CT 不仅能显示PSP 的代谢信息,同机CT 还能显示PSP 解剖结构,PSP 的同机CT 影像主要表现为圆形或类圆形、边缘光整、清晰的结节或肿块;部分病例可以表现为浅分叶,本组有6 例表现为浅分叶,浅分叶可能是肿瘤内部不同的组织成分不均匀生长的结果。PSP 可多单发,个别可多发[1,2,8],约占 4%[9],有学者根据PSP 的发病部位分为周围型和中央型,中央型发生在段或段以上支气管旁, 周围型发生在段以下支气管旁或胸膜下,周围型多见,中央型少见,本组 25 例 PSP 均为单发;20 例(80%)为周围型与文献[9]报道大致相符,此外文献报道PSP 多发于胸膜下, 以纵隔胸膜旁及叶间裂胸膜更多见,与本组病例相符,本组病例还显示PSP 无明显肺叶分布优势。本研究发现PSP 的CT 伴随征象主要有⑴钙化:PSP 病理示钙化灶旁可见胆固醇结晶, 提示胆固醇结晶可能是钙化的来源, 肿瘤内部密度一般较均匀,钙化常见,可占PSP 的40.0%以上[5];本组 PSP 均为小于 3cm 的结节,有 11 例(44.0%)存在钙化,钙化均在病灶的周边,均为点样或砂粒状,见图1,与文献[5]一致;⑵囊变:另外本组有12 例显示病变内有小斑片样的稍低密度区,史等[5]通过病理对照研究发现低密度区为瘤体内充满黄色液体的囊变区, 囊变可能与出血有关,PSP 囊变的发生率可能≥20.0%[11]。⑶尾征:是病灶近肺门一侧的尾状突起,与该肿瘤血供丰富、肺门血管趋向性生长有关,见图1。⑷周围空气潴留征:肿瘤周围可有局限性空气潴留, 在部分层面上可表现为典型的空气新月征,见图1。该征文献报道出现率高低不一,该影像征象的出现目前推测有多种机制[12]。从本组病例表现的PSP 周围空气潴留征来看, 多近似局限性肺气肿的表现, 因而认为邻近支气管压迫阻塞形成活瓣样结构可能为主要的机制, 空气新月征据报道有一定的特征性,但据笔者观察,周围型肺癌周围亦见有空气潴留, 也可表现典型空气新月征, 能否作为鉴别特征, 尚需更多病例观察研究。
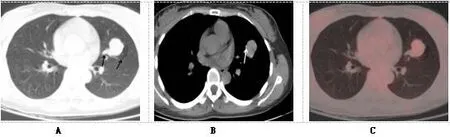
图1 病人女,34岁,PSP。A 图为CT横断面肺窗,B 图为CT横断面纵隔窗,C 图为PET横断面。左肺上叶卵圆形结节,29×20mm,浅分叶,尾征及空气新月征(A,箭头),边缘见砂粒样钙化(B,箭头),FDG摄取增高(C),SUVmax为2.1
PSP 的 PET/CT 可表现为高 FDG 摄取,低或等FDG 摄取,其中高FDG 摄取的病灶均呈结节状摄取增高,有学者认为PSP 病灶对FDG 的摄取程度与病灶大小和病灶的构成成分比例有关,特别是内皮细胞成分[13]。 本研究 25 例中,A 组中 14 例(56.0%)FDG 摄取高于肺本底,B 组中 11 例 (44.0%)FDG 摄取低于或等于肺本底,2 组间 SUVmax 与PSP 的最长径,两者差异有统计学意义(P=0.014;与CT 值两者差异无统计学意义(P=0.746),2 组间 CT伴随征象中,SUVmax 高于肺本底者沙粒状钙化(9/14,64.2%)发生率较低于肺本底者(2/11,18.1%)高(P=0.021),差异有统计学意义,囊变、周围空气潴留征、 尾征两者差异无明显统计学意义 (均P>0.5)。 分析原因是由于PSP 的大小和密度与组织病理学的构成有关, 病理上,PSP 光镜下瘤细胞为立方细胞和多角形细胞,典型者分为血管瘤样区、乳头区、实体区和硬化区,史景云等[10]研究发现较小病灶以血管瘤型和乳头型为主, 较大病灶以实体型和硬化型为主,而且随着病变逐渐增大,期内密度分布欠均匀,易形成沙粒状钙化。 囊变、周围空气潴留征、尾征等征象,无临床特异性,肺癌、结核、真菌等均可出现此征。以往由于对PSP 的PET/CT 表现认识不足,PET/CT 更多误诊为恶性肿瘤,误诊率可高达62.50%[10],这可能与PSP 表现出恶性肿瘤代谢特点和使用SUVmax>2.5 判定恶性肿瘤的标准有关[9], 随着越来越多的PET/CT 关于PSP报道,PSP 准确率有了明显的提升。
PSP 由于临床症状及影像特征不典型,PSP 需要和错构瘤、结核球、霉菌球转移瘤、炎性假瘤及肺癌鉴别,PSP 多表现为实性,边缘光滑、无毛刺,边缘部分可出现点状钙化;PET/CT 上可表现为低代谢及高代谢, 高代谢PSP 的SUVmax 多数低于2.5,延迟显像SUVmax 减低,与肺癌有一定的鉴别价值。 由于本研究样本较小,PET/CT 显像剂单一,本研究具有一定的局限性。
综上所述,PSP CT 上多表现为边缘清晰的孤立性肺结节,PET/CT 可表现为高、 低、 无 FDG 摄取,PET/CT 显像有助于 PSP 的诊断,PET/CT 显像高于肺本底者,PSP 发生钙化率也随着较高, 结合临床表现及影像征象,可提高PSP 的诊断准确率。
