人工耳蜗植入术后中耳乳突感染的手术治疗
2020-08-26刘维马妍佳杨曙赖若沙谢鼎华伍伟景
刘维 马妍佳 杨曙 赖若沙 谢鼎华 伍伟景
中南大学湘雅二医院耳鼻咽喉头颈外科(长沙410000)
对于无法从常规助听器中获益的重度和极重度感音神经性聋患者,人工耳蜗植入技术可以使患者重新获得听力。随着人工耳蜗技术的发展成熟,以及人工耳蜗植入手术台次的增多,术后并发症的发生、治疗和预后逐渐引起国内外专家的重视。Bradford Terry等[1]对2003年至2013年间的88篇相关文献进行了分析,提出除前庭并发症、设备故障及味觉障碍外,术后感染也是人工耳蜗植入的常见远期并发症。本文分析我科2015年1月至2019年10月因中耳乳突感染而入院治疗的人工耳蜗植入术后患儿的临床特征、手术方式及预后,旨在评估早期外科干预的效果,为处理该类疾病提供一些借鉴。
1 资料与方法
1.1 研究资料
病例来源于2015年1月至2019年10月因人工耳蜗植入术后中耳乳突感染而入住中南大学湘雅二医院并进行外科治疗的患儿,随访资料完整的共9例,均为语前聋。所有患儿均单侧植入,其中男4例,女5例,植入年龄最小1岁4个月,最大5岁4个月,平均年龄2.89岁。
所有患儿在人工耳蜗植入术前一月内均无上呼吸道感染史,术前30分钟以及术后5-7天内使用抗生素,常规使用美洛西林或头孢类抗生素。术中电极植入均顺利。术后无头皮下血肿形成。术后2天拍摄反斯氏位X线片电极位置均正常。9例患儿的人工耳蜗植入体包括科利耳CI24RE(CA)Freedom 3例、CI422 1例,MED EL公司SONATA 2例、PULSAR CI100 1例,美国HiRes 90K 2例。
9例患儿的临床特征见表1。出现中耳乳突感染的时间最早为人工耳蜗植入术后1月,最晚为术后3年4月,平均11.4月。早期症状为发热、耳痛,继而耳流脓或耳后红肿。其中6例为感染症状出现一周以内入院的急性感染。另3例经过院外抗感染治疗,穿刺引流和冲洗,迁延不愈发展成慢性感染。入院时分别为病程1个月、2个月、和反复耳后流脓达1年。该3例耳后瘘管形成,部分皮肤坏死,其中2例出现植入体部分外露。
1.2 治疗方法
急性中耳乳突感染者,住院后立即给予静脉注射抗生素治疗,行耳部CT,穿刺抽取脓液做细菌培养+药敏试验。如通过足量广谱抗生素治疗,体温未控制,或者耳后皮肤出现明显红肿,耳后沟肿胀,甚至局部脓肿形成,及时行中耳乳突病灶清除术。常规做耳后切口,引流乳突腔分泌物,清除肉芽组织,反复生理盐水和稀释后的络合碘液冲洗乳突腔。如感染未累及植入体,则尽量保护植入体与植入体床的原本位置,并注意术中保护电极。为避免造成电极损伤或内耳感染,在乳突病灶彻底清除的基础上,不再开放面隐窝进入鼓室腔。彻底清创后切口行一期缝合,必要时放置小号引流管1-2天。应避免敞开切口引流或长期放置引流管,以免继发感染。
对于耳后瘘管形成甚至植入体外露的慢性感染者,行病灶清除及转移皮瓣修复术,将瘘管周边坏死皮肤连同病变组织一并切除。如植入体未暴露,清创后直接转周围健康头皮皮瓣修复;如累及植入体外露,则需清除植入体周围肉芽组织,必要时加深植入体床,稀释络合碘反复冲洗干净,沿原位置放入植入体,尽可能保证植入体和电极的相对位置不发生变化。转周围健康带蒂皮瓣修补缺损,逐层对合缝合,凡士林纱布覆盖伤口加压包扎。
2 结果
6例急性中耳乳突感染,均在积极抗感染同时经病灶清除术后治愈。随访2个月至4年10个月,未见感染复发。
3例病程1个月以上的慢性感染者,均经病灶清除和转移皮瓣修复术。1例因乳突腔反复感染于外院行“清创”手术,1年后再次出现感染,耳后形成瘘管,保守治疗2月无效,我院行清创+皮瓣修复。术中清除乳突腔内肉芽组织,切除坏死皮肤,修剪出蒂位于下方的宽蒂半圆形皮瓣,对合缝合。术后随访2年,无再感染。另2例中,1例为低体重儿,发育营养状态欠佳,行皮瓣修复术后感染复发,皮瓣局部坏死,最终再次手术取出植入体,感染控制后于术后6个月再次行同侧人工耳蜗植入术,随访无感染复发。1例病程迁延1年后方来就诊,行病灶清除及皮瓣修复术后,感染复发,皮瓣坏死,手术取出植入体后皮肤愈合好,感染未再复发。
分泌物细菌培养结果:1例检出金黄色葡萄球均感染,1例检出肺炎链球菌感染,4例送检未检出致病菌,可能与起病早期使用抗生素干扰有关。另有3例未能取得分泌物送检。
例1,男,2岁5个月行左侧人工耳蜗植入术。术后3年因左侧中耳乳突感染于外院行局部清创引流术。1年后再次出现耳后红肿,破溃及瘘管形成,外院保守治疗2个月无效而就诊。查体见左乳突区瘘管及皮肤坏死,有直径约1.5cm大小类圆形皮肤缺损(图1a)。植入体未见外露。全麻下行病灶清除及皮瓣修复术。术中标记坏死切除范围,皮下注射生理盐水(含少许肾上腺素),切除坏死皮肤(图1b)。设计皮瓣形状,美兰标记(图1c),修剪出蒂位于下方的宽蒂半圆形皮瓣,对合缝合(图1d),凡士林纱条覆盖切口,略加压包扎。术后恢复好。随访1年,未见复发。

图1 乳突区慢性感染皮瓣修复。a.术前;b、c.术中清创及皮瓣设计;d.术后一周Fig.1 Flap repair of chronic infection of the mastoid and middle ear.a.Preoperative;b and c.Intraoperative debridement and flap design;d.One week after operation.
例2,男,因“溶血性黄疸”致双耳极重度感音神经性聋,2岁半行右侧人工耳蜗植入术。术前CT显示双侧中耳乳突炎,抗炎治疗1个月后接受耳蜗植入手术。术中见鼓室有少量黏液性分泌物,抽吸干净,继续植入。术后按时开机,恢复顺利。术后4个月出现耳后红肿,继而破溃,创口反复流脓,外院抗感染治疗,局部清洗换药,仍流脓不愈。入我院查体见乳突区瘘管形成,脓性分泌物溢出。局部皮肤缺损,植入体部分外露。全麻下行病灶清除+皮瓣修复术。术中见乳突区突出皮肤表面肉芽,挤压有脓性分泌物,沿肉芽菱形切除病变组织,刮匙彻底刮除植入体附近皮瓣内侧病变组织,不移动植入体,创面依次以双氧水、盐水、稀释络合碘、庆大盐水冲洗。4-0丝线缝合植入体上方切口,于创面外后侧设计相应大小菱形皮瓣,美兰标记,皮瓣长与蒂部宽约为1.5:1。副肾盐水浸润后,切开皮肤皮下,于帽状腱膜层充分游离至皮瓣转移后,原供瓣区可直接缝合,无明显张力。创面彻底止血后,将皮瓣转移至原残余创面,4-0丝线固定皮瓣,供瓣区直接拉拢4-0丝线间断缝合,留置引流管一根。创面稍加压包扎。术后一期拆线出院。2个月后,局部红肿复发,植入体再次外露。再次清创手术,取出植入体。感染控制,皮肤愈合好。
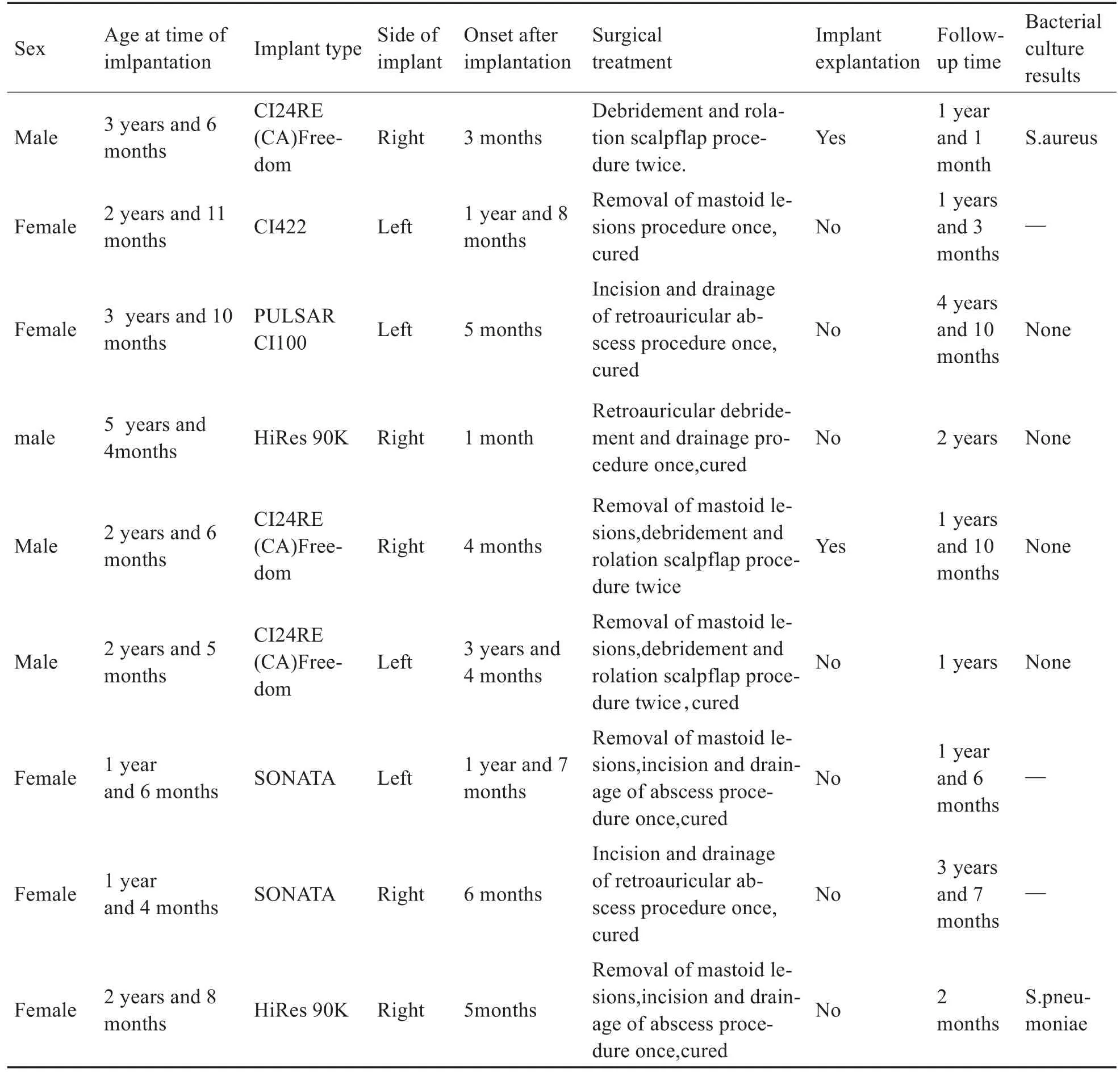
表1 人工耳蜗植入术后中耳乳突感染患儿的临床特征Table 1 Clinical Characteristics of Patients with Middle Ear and Mastoid Infection after Cochlear Implantation
例3,女。右侧人工耳蜗植入术后5月,出现发热、耳后红肿。查体:耳后乳突区红肿(图2a)、皮下有波动感、穿刺有脓性分泌物。体温39℃,白细胞:46×109/L,中性粒细胞:36×109/L,C反应蛋白155mg/L。既往有“先天性心脏病”,曾因“败血症”、“泌尿系感染”反复长期使用抗生素治疗,常规使用美洛西林舒巴坦全身抗感染,体温和白细胞计数未能有效控制。抽取脓液细菌培养结果为肺炎链球菌,对多种抗生素耐药,更换美罗培南抗感染治疗,体温逐渐正常,耳后仍红肿。全麻下行“耳后脓肿切开引流+中耳乳突清创”,术中清除病变组织,反复冲洗术腔,切口一期缝合,放置引流管。术后白细胞计数逐渐恢复正常,2天后拔除引流管。伤口愈合好,痊愈出院(图2b)。随访2月,感染无复发。
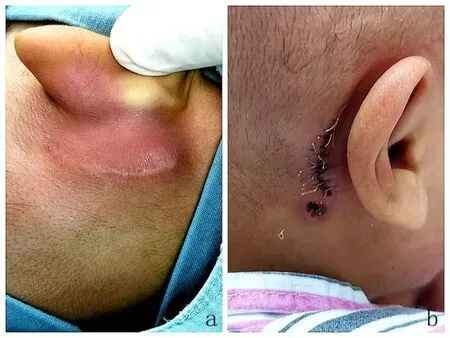
图2 中耳乳突急性感染手术前后情况。a.感染耳后肿胀;b.术后愈合良好Fig.2 Pre-and postoperative pictures of acute infection of mastoid and middle ear.a.Swelling after ear infection;b.Good healing after operation
3 讨论
人工耳蜗术后并发症逐渐引起人们的重视。目前国内外统计人工耳蜗植入术后出现并发症的总体发生率约在7%~9%[2-3],主要包括器械故障、电极移位、术后感染、外淋巴瘘和脑脊液漏、眩晕、面瘫、皮瓣坏死等。尤其术后感染是常见并发症,应予重视。处理不当,可造成感染扩散,植入体取出的严重后果。
根据我国最新人工耳蜗植入指南规定[4],中耳乳突急性化脓性炎症是人工耳蜗植入手术的绝对禁忌证,慢性中耳炎如果炎性反应得到控制,可选择行一期手术或分期手术。由于解剖学上的特点,儿童较成人更易患中耳炎,Paramita Baruah[5]等人分析了慢性化脓性中耳炎在儿童CI术后的发展,提出了CI术后患儿早期认识中耳炎和及时外科干预的重要性,延迟治疗会导致感染通过电极导线蔓延扩散,最终导致耳蜗植入失败。也有专家认为术前有中耳炎病史的患儿,术后更易并发急性中耳乳突炎。张宏征等[6]观察5例CI术后急性化脓性中耳炎的患者,认为单纯依靠全身使用敏感抗生素难以控制感染,尤其是对耐药金黄色葡萄球菌感染的病例,处理更为棘手。本组病例中,一例患儿术前CT提示双侧中耳乳突炎,经抗感染一个月后行人工耳蜗植入术,术中发现鼓室有黏液性分泌物。术后4个月出现了反复感染流脓,合并皮瓣坏死,最终取出植入体感染方得到控制。通常分泌性中耳炎未列入人工耳蜗植入术的禁忌症,但在该型中耳炎的中耳分泌物中可能有低致病性细菌存在,甚至在抗生素的作用下某些毒力较强的细菌潜伏于中耳腔。对乳突或鼓室病变较重,分泌物较多且黏稠的病例,先作病灶清除,二期行人工耳蜗植入为宜。
通常认为发生在三个月内的感染与手术操作或术后护理直接相关,而发生在三个月后的感染则与头部创伤或上呼吸道感染有关[7]。由于植入体的存在,CI术后皮瓣感染可能演变为复杂性、难治性感染,而目前尚无公认的最佳治疗手段[8]。因此预防皮瓣感染至关重要。现在人工耳蜗植入术多采用微创的“小切口”技术,因手术切口设计导致的皮瓣坏死已相当少见。耳后微创直或弧形切口,并分层切开皮肤、皮下组织及骨膜-颞肌筋膜-颞肌形成上、下两层不重叠的缝合口,可有效避免皮瓣并发症的发生[9]。皮瓣坏死多与感染或皮瓣过薄、植入体张力过大有关。感染发生的与个体体质、基础疾病有密切关系。营养不良、体重过低、反复上呼吸道感染、合并存在中耳乳突炎等,都在手术时机选择时应予重视。另外,植入体本身因素也可能与感染有关。Kanaan等[10]发现,耳蜗植入后12个月左右有超过半数的植入体表面可检测出细菌生物膜,最常见为金黄色葡萄球菌,其次为铜绿假单胞菌和流感嗜血杆菌。因此,一旦有感染发生,须尽早全身使用抗生素。如全身应用抗生素未能有效控制感染,应尽早局部清创引流,避免感染累及耳蜗植入体,因植入体细菌生物膜形成可导致反复感染,难以控制。本组一例在术后3年内反复发生两次中耳乳突感染,伴皮瓣坏死,则可能与细菌生物膜形成有关。
人工耳蜗植入术后感染并发症的风险不容小觑,如积极应用抗生素仍不能有效控制感染,尽早进行外科干预是一个必要的选择。本组6例患儿在一周内及时进行手术清创,感染很快得到控制,未造成严重并发症。如不能及时控制感染,则可能进展为需取出植入体。即使能够再次植入,感染潜伏的风险仍很大,给再次手术带来的困难也会明显增加,甚至只能选择对侧植入。文献报道近约6%~10%接受耳蜗再次植入手术的患者言语功能有退化[11,12]。目前无法确定耳蜗植入到出现感染之间的时间对植入体保留的影响,因此在术后出现感染并发症时如何早期发现并及时治疗对手术成功与否至关重要。
总之,人工耳蜗植入术后出现感染相关并发症需要引起重视。如感染局限中耳乳突腔未累及植入体,而抗生素不能有效控制时,应及时手术清创引流,可以减少继发感染机会。感染累及植入体则应尽早行清创手术,彻底清除感染病灶及炎性肉芽组织。如经久不愈,应及时取出植入体,感染控制后可尽快行二期人工耳蜗植入,以免影响患儿康复效果。由于术后感染可以在人工耳蜗植入后数年内发生,因此需要手术医生定期随访并重点关注累及范围较广的感染患儿,以保障人工耳蜗植入术后疗效。
