辅助放化疗对早期胃癌预后影响:基于人群倾向性评分匹配分析
2020-08-26王文生朱建儒陈东风文良志
王文生,朱建儒,王 斌,陈东风,文良志
陆军军医大学大坪医院消化科,重庆 400042
胃癌是引起我国肿瘤相关发病和死亡的最主要的恶性肿瘤之一,早期发现和治疗,能有效改善患者的生活质量和预后。局限于黏膜层或黏膜下层的早期胃癌(early gastric cancer,EGC),其5年生存率在90%以上[1]。虽然EGC的整体预后较好,但仍有部分患者表现为以淋巴结转移为特征的侵袭性生长引起治疗后复发[2]。
目前大量临床研究证实,对胃癌术后追加化疗能明显改善患者肝、肺及淋巴结转移风险,同时改善患者预后[3]。但对EGC患者术后追加辅助治疗的研究较少,我国相关指南规范推荐对Ⅰ期胃癌(pT1N1M0和T2N0M0)进行辅助化疗,而日本相关指南倾向于随访观察,目前临床上对EGC的术后辅助治疗存在较大的争议[4-5]。
SEER数据库是美国癌症研究所建立的针对肿瘤患者集监测、治疗及流行病学调查于一体的大型真实世界数据库,为科研工作者提供了宝贵的肿瘤研究的临床信息资料[6]。本研究基于SEER数据库中2010年至2015年的EGC患者信息进行统计分析,旨在评估术后辅助放化疗是否改善EGC患者长期预后,以期对筛选潜在的受益人群提供证据支撑。
1 材料与方法
1.1 患者信息采集通过SEERStat 8.3.6客户端软件在线提取(2019年11月1日进行)SEER数据库[6]中EGC患者一般临床信息,包括种族、年龄、性别、肿瘤大小、病理类型等。
纳入标准:(1)无远处转移且经手术治疗的EGC患者;(2)2010年至2015年经组织学确诊且细胞分化程度已知;(3)病理Lauren分型为肠型或弥漫型[7];(4)仅患胃癌1种肿瘤;(5)肿瘤大小已知;(6)随访时间≥1个月;(7)年龄≥18岁;(8)胃早癌部位已知。
排除标准:(1)合并其他恶性肿瘤;(2)TNM分期错误;(3)肿瘤大小未知;(4)死亡原因未知;(5)手术前和手术前后进行放疗患者;(6)种族未知患者。具体筛选流程如图1所示。

图1 研究流程图
1.2 统计学方法采用SPSS 23.0及R3.5.2软件进行统计学分析,计数资料的比较采用Pearson卡方检验,计量资料的比较采用Mann-Whitney秩和检验。研究终点事件为总生存期(overall survival,OS)和肿瘤特异性生存期(cancer-specific survival,CSS)。OS定义为手术至死亡或最后随访时间,CSS定义为手术至肿瘤相关死亡或最后随访时间。OS生存分析比较采用Kaplan-Meier法Log-rank检验,预后相关因素的探索采用Cox比例风险回归模型。CSS生存分析比较采用Fine-Gray检验,预后相关因素的探索采用竞争风险模型[8]。P<0.05为差异有统计学意义。
由于放化疗组和未放化疗组间人口学特征不完全相同,为使研究尽可能接近随机对照研究及尽量减少潜在的混杂偏倚,采用R包“MatchIt”进行倾向性评分匹配分析(propensity score matching,PSM)[9-11]。
2 结果
2.1 EGC患者基线特征通过SEERStat 8.3.6在线提取到3 473例EGC患者信息。按照纳入及排除标准,最终纳入本研究分析的患者1 262例,男751例,女511例,其人口统计学和临床特征如表1所示。本研究中,有187例患者术后给予了放化疗,其中放疗10例,化疗78例,联合治疗99例。
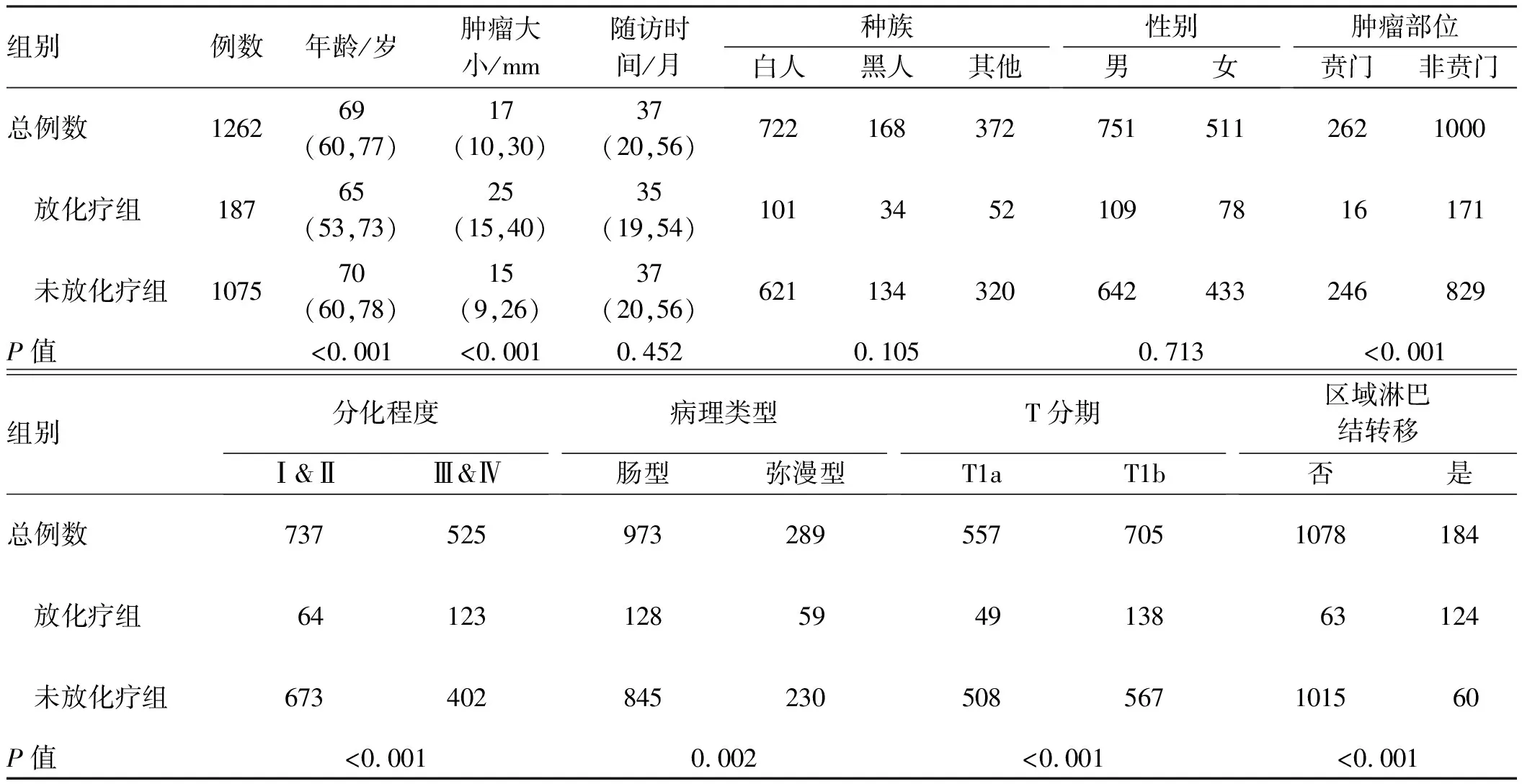
表1 放化疗组与未放化疗组患者的基线特征比较
纳入研究分析的EGC患者年龄偏大(中位年龄69岁),其中放化疗组患者中位年龄为65岁,明显小于未放化疗组(P<0.05),但其肿瘤病灶大小明显大于后者(中位值:25 mmvs15 mm,P<0.05)。虽然本研究人群主要是非贲门区EGC,但贲门区肿瘤接受放化疗比例更低(P<0.05)。此外,分化程度差(Ⅲ&Ⅳ,即低分化和未分化)、肿瘤浸润黏膜下层(T1b)及伴有区域淋巴结转移的EGC患者接受放化疗比例更高。两组患者在种族、性别分布及随访时间上比较,差异无统计学意义(P>0.05)。
2.2 影响患者预后的风险因素经过37个月(中位时间)的随访,共有238例患者死亡,其中因胃癌相关原因死亡患者121例,其他原因死亡造成删失患者117例(包括心脑血管死亡37例,慢性肝肺疾病16例等)。如表2所示,放化疗组1年、5年总生存率分别为0.940、0.750,稍高于未放化疗组(0.927、0.746),但差异无统计学意义(P>0.05,见图2A)。然而,放化疗组1年、5年肿瘤特异性生存率较未放化疗组稍差(0.951vs0.953,0.818vs0.886),其中两组术后5年肿瘤特异性死亡率比较,差异有统计学意义(P<0.05)。

表2 EGC患者1年、5年生存率
如图2B所示,单因素Cox分析显示,与预后相关的潜在因素是种族、性别、年龄、肿瘤大小、分化程度、病理类型、浸润深度(T)和淋巴结受累(N)(P<0.05)。将单因素分析中P<0.05的因素纳入多因素Cox回归分析,结果如图2C,种族、性别、年龄、肿瘤大小、浸润深度(T)和淋巴结受累(N)是影响EGC患者OS预后的独立风险因素(P<0.05)。与肿瘤局限于黏膜层(T1a)相比,当肿瘤浸润黏膜下层(T1b)时,患者总体死亡风险上升43%(HR=1.43,95%CI:1.08~1.89,P=0.013,见图2C),肿瘤特异性死亡风险增加1.22倍(HR=2.22,95%CI:1.42~3.49,P<0.001,见图2E)。同样,当区域淋巴结受累时,总体死亡风险上升52%(HR=1.52,95%CI:1.08~2.13,P=0.015,见图2C),肿瘤特异性死亡风险增加1.26倍(HR=2.26,95%CI:1.29~3.97,P=0.004,见图2E)。此外,随着肿瘤大小及患者年龄增加,患者总体死亡风险及肿瘤特异性死亡风险也有不同程度的升高(见图2C、2E)。而总体来说,女性要比男性总体死亡风险低(HR=0.64,95%CI:0.49~0.84,P=0.002),但肿瘤特异性死亡风险差异无统计学意义(P=0.310)。
放化疗组肿瘤特异性死亡累积发生率显著高于未放化疗组(P=0.015),但别死亡风险差异无统计学意义(P=0.142)(见图2D)。竞争风险回归分析表明,种族、年龄、肿瘤浸润深度(T)和淋巴结受累(N)(P<0.05)是导致EGC患者肿瘤特异性死亡的风险因素,而放化疗与CSS结局无相关性(P=0.820)。
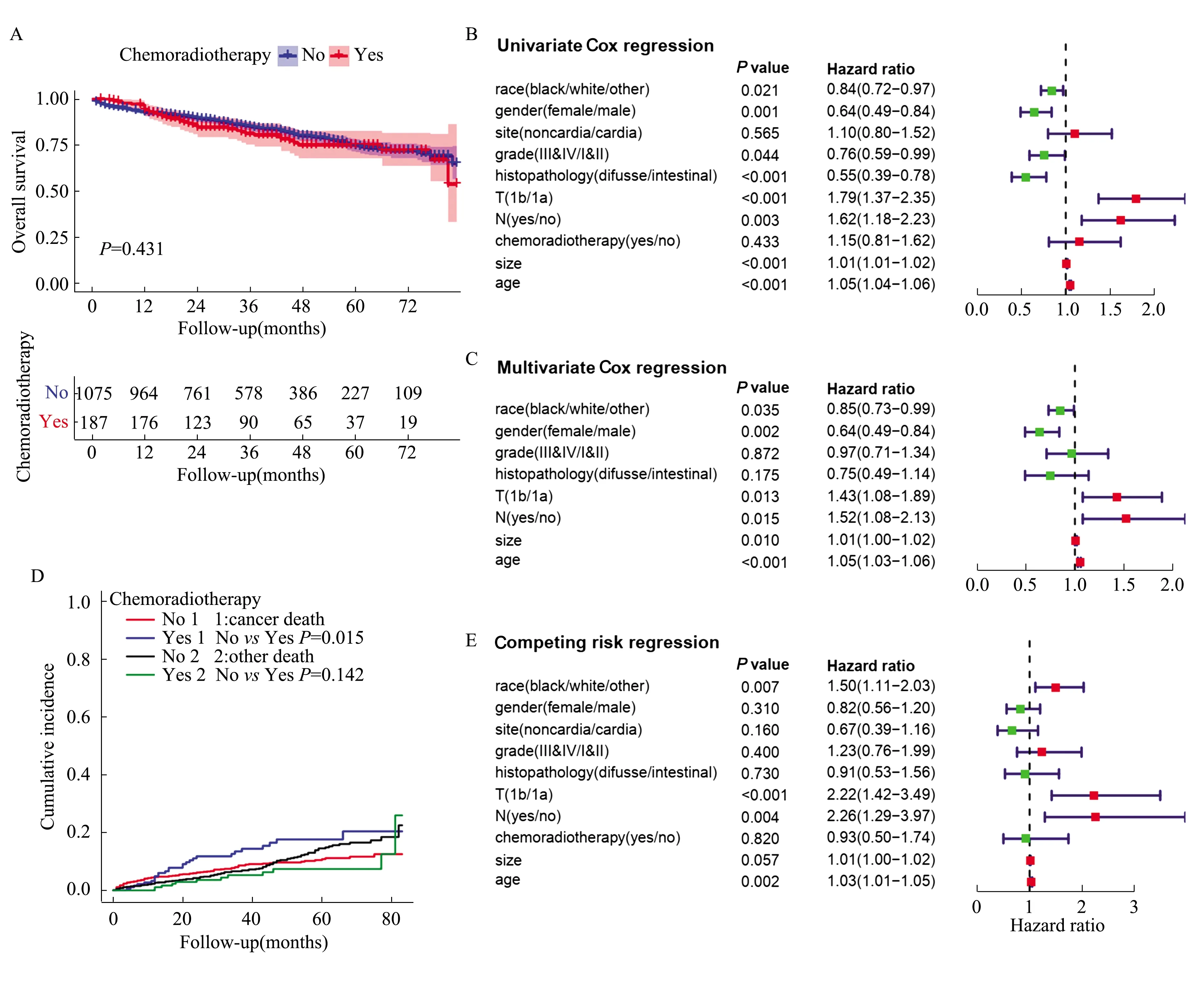
注:OS生存曲线(A)及预后相关的单因素(B)与多因素(C)Cox回归分析。CSS累积死亡率曲线(D)及预后相关风险因素(E)回归分析;race:种族;gender:性别;site:肿瘤部位;grade:分化程度;histopathology:病理类型;chemoradiotherapy:放化疗;size:肿瘤大小;age:年龄。
TNM分期是目前应用最广泛的预测预后及治疗选择的依据[12]。同时,考虑到淋巴结转移是胃癌患者最重要的预后因素[13],我们对存在治疗争议的pT1N1M0亚组探讨术后放化疗效应[5]。本研究中T1N1亚组患者共110例,全部为非贲门区EGC,其中术后放化疗71例,未放化疗患者39例。采用前文所述方法进行回归分析,结果如图3所示。影响T1N1亚组OS及CSS相关预后的独立因素是年龄(P<0.05),而放化疗对OS及CSS相关预后均未产生影响(P>0.05)。

图3 放化疗对T1N1亚组OS影响的单因素(A)与多因素(B)Cox回归及对CSS影响的竞争风险回归(C)分析
2.3 PSM后放化疗组与未放化疗组生存分析由于PSM分析得到的两组间一般临床特征相同,因此直接比较两组间生存曲线即可反映干预措施产生的效应差异。两组间OS生存曲线用Log-rank检验,如图4A所示,虽然放化疗组预后略好于未放化疗组,但差异无统计学意义(P=0.052)。两组间CSS累积死亡率比较采用Fine-Gray检验,如图4B所示,组间CSS累积死亡和别死亡风险差异无统计学意义(P>0.05)。

注:两组间OS生存曲线(A)与CSS累积死亡率曲线(B)。
2.4 PSM分析通过R包“MatchIt”(method=‘nearest’,caliper=0.1),按照1∶1进行匹配,如表3所示,PSM后得到放化疗组113例,未放化疗组113组,两组间基线资料比较,差异无统计学意义(P>0.05),具有可比性。

表3 放化疗组与未放化疗组患者的基线特征比较(PSM后)
2.5 PSM后亚组生存分析为进一步分析放化疗对不同TNM分期患者影响,探讨放化疗患者可能受益人群,我们分别对局限于黏膜层(T1a)、浸润到黏膜下层(T1b)及淋巴结是否受累4个亚组进行了预后分析。
PSM后T1a期中放化疗组与未放化疗组患者OS(P=0.276,见图5A)及CSS(P=0.518,见图5B)差异均无统计学意义(P>0.05)。同样,PSM后T1b期中两组间预后差异无统计学意义(P>0.05,见图5C、D)。最后,PSM后放化疗组和未放化疗组患者OS(见图6A、6C)和CSS(见图6B、6D)在无区域淋巴结受累和有区域淋巴结转移患者中差异均无统计学意义(P>0.05)。
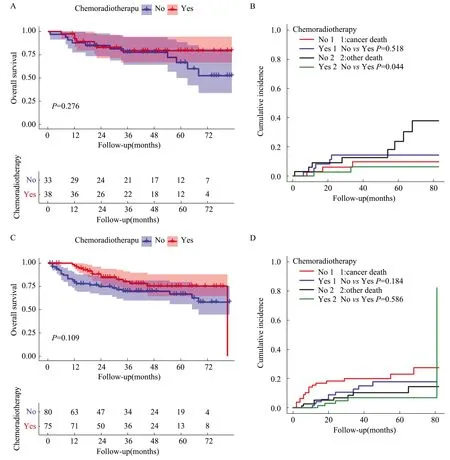
图5 放化疗对T1a期(A、B)与T1b期(C、D)患者预后影响

图6 放化疗对无区域淋巴结转移(A、B)与合并区域淋巴结转移(C、D)患者预后影响
3 讨论
目前我国EGC检出率已由过去10%提高到接近20%[14],为改善胃癌患者预后,人们将大量精力集中于提高EGC的筛查及检出率上,而忽视了对EGC的术后辅助优化治疗的探索。本研究基于SEER数据库中大规模病例的回顾性分析初步验证了术后放化疗对EGC患者长期预后的影响。
本研究纳入人群中,EGC患者区域淋巴结转移率为14.6%(184/1 262),与大多数研究报道一致[15]。合并淋巴结转移的184例患者中,67.4%给予术后辅助放化疗。总人群5年总生存率及肿瘤特异性生存率分别为74.6%、87.6%,与既往报道存在差异[1,16],考虑可能原因是本研究人群的患者年龄较高[中位值(四分位值),69岁(60岁,77岁)],合并老年慢性病的风险较大。本研究中非肿瘤性死亡达到了117例,与胃癌相关原因相当(121例),即患者非肿瘤性死亡较多导致整体预后较差。
187例术后放化疗患者与1 075例未辅助治疗患者OS比较,差异无统计学意义,并且Cox回归分析结果表明是否放化疗与患者OS无关。虽然放化疗组CSS死亡风险要高于未治疗组,但竞争风险回归分析显示放化疗并未对CSS死亡结局产生影响,这种差异是由患者年龄、种族、肿瘤浸润深度(T分期)及淋巴结转移不同导致。回归分析结果表明,种族、年龄、肿瘤浸润深度和淋巴结受累情况均是影响EGC患者长期预后结局(OS和CSS)的因素。淋巴结转移对患者临床结局产生的影响最大(即HR值最高),和既往报道一致[13]。
早在1993年,日本学者的一项小样本研究发现,对EGC术前化疗有助于缩小病灶,减少微转移病灶[17],提示化疗可能会对预后产生一定影响。然而另一项回顾性研究随访了121例无淋巴结转移的黏膜下胃癌患者,发现未化疗组(59例)的5年无进展生存(disease-free survival,DFS)率和化疗组(62例)一样均为100%,似乎化疗并不能使患者受益[18]。同样,韩国的一项对pT1N1期EGC患者的回顾性分析表明,术后化疗或放化疗与仅手术治疗相比并未进一步改善患者5年DFS[19]。与之相反,国内进行的一项前瞻性研究评估了EGC患者ER术后给予化疗的安全性和有效性,化疗降低了患者复发率同时提高了生活质量[4]。既往的研究均以DFS为评估终点,且可能由于纳入人群的异质性,研究结论不一致。本研究利用SEER数据库首次探讨了对EGC患者进行术后放化疗后患者OS及CSS获益情况。从分析结果来看,患者长期预后并未从辅助治疗中获益。此外,对存在治疗争议的T1N1亚组分析[5],放化疗同样未改变患者OS及CSS结局。同时,本研究为尽可能减少混杂因素的偏倚,利用了PSM方法进一步分析,所得结果并未改变,说明本研究结果稳健可靠。基于此,我们不推荐对EGC患者术后进行常规放化疗。
考虑到本研究存在的局限性,如纳入人群为美洲地区患者,且无法获取患者的具体放化疗方案和剂量等混杂因素,本研究结果不能说明我国EGC患者对辅助治疗的获益情况。此外,本研究中EGC患者多为经外科手术的患者,同时具体手术方式不明确,而对于淋巴结转移风险较小EGC患者,内镜下切除术特别是内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已逐渐取代外科手术[20-21]。目前对内镜下切除术后的EGC患者的辅助治疗价值研究较少[13],特别是内镜下治疗存在非治愈性切除,而患者又拒绝或不耐受外科手术治疗等情况[1]。因此,需要更高证据级别的随机对照试验深入研究评价EGC术后特别是ESD术后的辅助治疗价值。
