刺葡萄棒状拟盘多毛孢叶斑病病原菌的分离鉴定及其防治药剂筛选
2020-08-25唐鑫彪倪玉洁胡玉慈白金慧王琳陈清西文志丰
唐鑫彪 倪玉洁 胡玉慈 白金慧 王琳 陈清西 文志丰

摘要 葡萄叶斑病是一种严重影响葡萄产量的病害。为了明确引起刺葡萄叶斑病的病原菌种类及筛选有效防治药剂,本研究从福建农林大学实践教学基地采集刺葡萄‘高山二号10片典型叶斑病病叶片,对分离得到的菌株进行形态学和分子鉴定。结果表明,通过形态学特征结合rDNA-ITS(ITS)、β-tubulin和EF-1α序列分析确定分离到的菌株均为棒状拟盘多毛孢Pestalotiopsis clavispora。防治药剂筛选的结果显示,不同的防治药剂对炭疽病菌的抑制效果不同,60%唑醚·代森联水分散粒剂和25%嘧菌酯悬乳剂对该病原菌菌丝生长的抑制效果最好,其EC50分别为0.119 mg/L和0.178 mg/L;其次为80%波尔多液可湿性粉剂,其EC50为1.766 mg/L;抑制效果最差的药剂为50%多菌灵可湿性粉剂,仅表现出轻微的抑制作用。防治棒状拟盘多毛孢菌丝生长和孢子萌发的最佳药剂是60%唑醚·代森联水分散粒剂和25%嘧菌酯悬乳剂,可作为备选药剂进行田间刺葡萄叶斑病防控试验。
关键词 葡萄叶斑病; 鉴定; 拟盘多毛孢; 致病性
中图分类号:
S 436.631
文献标识码: A
DOI: 10.16688/j.zwbh.2019144
Identification of the fungal pathogen causing Vitis davidii leaf spot and screening of fungicides for control of the disease
TANG Xinbiao, NI Yujie, HU Yuci, BAI Jinhui, WANG Lin, CHEN Qingxi*, WEN Zhifeng*
(College of Horticulture, Fujian Agricultural and Forestry University, Fuzhou 360002, China)
Abstract
Grape leaf spot is one of the most important diseases of grapevine in the world, which causes serious losses in grape yield. In order to confirm the pathogenic species in Vitis davidii Fox and screening of fungicides for control of the disease, ten spot leaves of V.davidii ‘Gaoshan-2 were collected from the Practice-Teaching Base of Fujian Agricultural and Forestry University, and the pathogen was isolated and identified using morphological and molecular biological methods. The results showed that, based on the rDNA-ITS, β-tubulin and EF-1α sequence analysis and morphological characteristics, the pathogen was identified as Pestalotiopsis clavispora. Fungicide screening showed that different fungicides had different inhibitory effects on P.clavispora. The best fungicides against the mycelial growth of the pathogen were pyraclostrobin·metriam 60% WG and azoxystrobin 25% SC, with an EC50value of 0.119 mg/L and 0.178 mg/L, respectively, followed by bordeaux 80% WP, with an EC50value of 1.766 mg/L. The fungicide with the lowest inhibitory effect was carbendazim 50% WP, which showed only slight inhibition. Our study suggested that pyraclostrobin-metriam 60% WG and azoxystrobin 25% SE were the effective fungicides for control of mycelium growth, which may be used as alternative chemicals for control of leaf spot in V.davidii in the field.
Key words
grapevine leaf spot; identification; Pestalotiopsis clavispora; pathogenicity
刺葡萄Vitis davidii Fox屬于葡萄科Vitaceae,葡萄属Vitis,它的典型形态特征是幼枝及叶柄部位着生皮刺。刺葡萄东亚种群的一种野生种质资源,具有优良的鲜食、酿酒特性和抗湿热及抗病优势。通过对野生资源驯化改良,形成了‘塘尾[1]
‘紫秋[2]‘高山二号[3]‘福安[4]‘惠良[5]等多个刺葡萄品种,主要分布在福建、湖南、江西等地,因其鲜食加工兼用及优良抗逆抗病性,人们愈加重视对刺葡萄的开发利用,近年栽培规模扩增明显,在部分地区甚至形成了特色产业。如福建的福安刺葡萄种植面积达200多公顷,充分利用葡萄在鲜食加工方面的优势,衍生出观光采摘和酿酒加工等产业[6],效益十分可观;2011年湖南省刺葡萄酒产量超过1 710 t,产值达到1.9亿元[7]
。
叶斑病又称为斑点病、褐斑病,是葡萄常见的叶部病害之一[8]
,全国各个产区的刺葡萄几乎都发生过该病害。近年来,刺葡萄叶斑病发病率有升高趋势,该病会引起树体早期落叶,影响浆果的产量和品质,对刺葡萄产业的发展影响极大。但目前尚未见对刺葡萄叶斑病致病菌种类及其防治药剂等方面的研究报道。
为明确引起刺葡萄叶斑病的致病菌种类及其防治药剂,本研究从福建农林大学教学基地共采集10个刺葡萄‘高山二号病叶样品进行病菌常規分离,并结合病菌的形态学和分子生物学技术对其进行鉴定,明确该菌为棒状拟盘多毛孢Pestalotiopsis clavispora,为首次在刺葡萄中分离得到。同时测定了6种常用药剂对该病原菌菌丝和孢子的抑制作用,以期为进一步研究葡萄叶斑病菌种类变化及分布奠定良好基础,并为该病害的田间防治提供理论依据。
1 材料与方法
1.1 病样采集及防治药剂
供试病样为2018年6月从福建省福州市福建农林大学教学基地从刺葡萄品种‘高山二号采集具有典型叶斑病症状的叶片10片。病菌致病性分析试验供试品种为刺葡萄‘高山二号、华东葡萄‘吉安和葡萄‘红地球,均来自福建农林大学教学基地。抑菌试验所用的杀菌剂为嘧菌酯、百菌清、波尔多液、唑醚·代森联、多菌灵、甲基硫菌灵,均为农贸市场购买(表1)。
1.2 病原菌分离及形态学特征观察
病原菌分离及单孢纯化参照《植病研究方法》[9]
。用湿脱脂棉先将病叶表面污渍擦拭干净,再从典型病斑的病健交界处切取大小约为3 mm×3 mm的组织,每张叶片切取3块,然后经0.1%次氯酸钠消毒1 min,用无菌水洗净后用70%乙醇消毒30 s,再用无菌水洗净后转移至PDA平板上,置于28℃恒温培养。约3~4 d菌落清晰可见后,用直径6 mm的打孔器从其边缘打取菌丝块转接至新的PDA平板上,生长7~10 d后,进行单孢纯化。
病原菌形态和培养特征观察参照Cai等[10]
的方法。从PDA上培养5 d的纯化菌落边缘切取菌饼(直径6 mm),并将其转移至新的PDA平板上置于28℃,L∥D=12 h∥12 h条件下培养。每个菌株3次重复。7 d后测量菌落直径,计算平均生长速率(mm/d),并观察菌落的形态,分生孢子形态,并在倒置荧光显微镜(LEICA DMI8)下分别测量10个分生孢子盘、40个分生孢子的大小(长度和宽度)。
1.3 分子鉴定
收集在PDA培养基上生长5~7 d的菌丝体,参照Weir等[11]
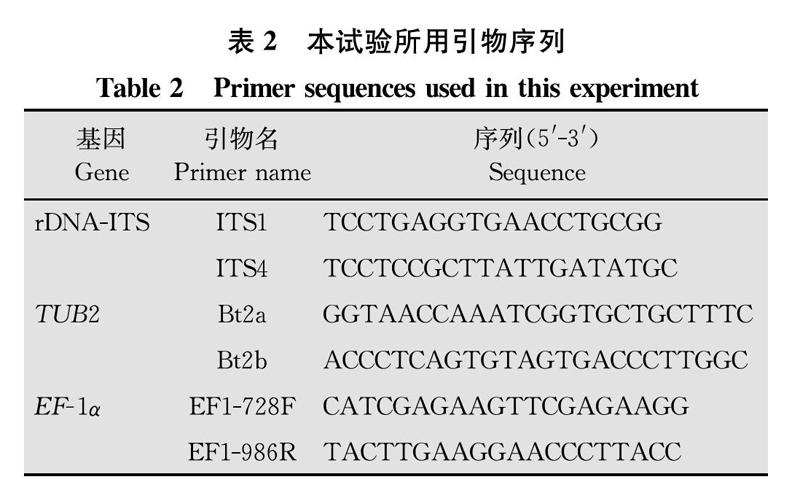
的方法提取基因组DNA,经1%琼脂糖凝胶电泳检测(Bio-Rad凝胶成像GelDocTMXR+系统,美国伯乐公司)后作为PCR的扩增模板。利用特异引物(表2)分别扩增rDNA-ITS(ITS)、β-微管蛋白基因(TUB2)和EF-1α序列,PCR扩增在Bio-Rad PCR仪(T100TM Thermal Cycle,美国,ABI)进行。25 μL反应体系如下:2×Taq PCR Master Mix 12.5 μL,DNA模板1 μL,上下游引物各1 μL,无菌超纯水9.5 μL。
PCR扩增程序如下:94℃预变性1.5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,36个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测并纯化后,由铂尚生物技术(福州)有限公司完成测序。
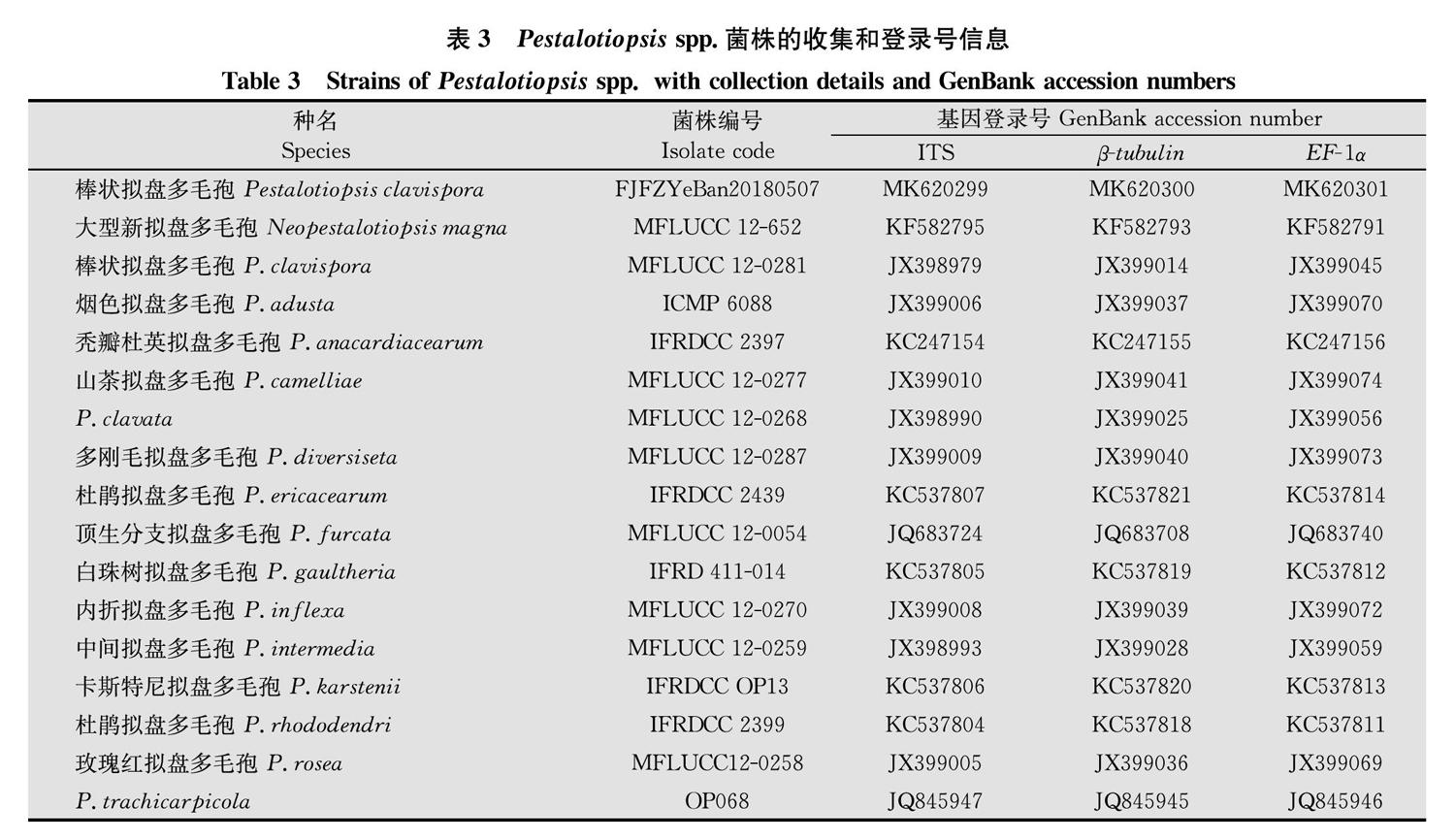
本研究中其他序列是根据BLAST搜索结果并参考文献[12]
从GenBank中下载(表3)。使用Clustal X 1.81软件处理3个保守基因rDNA-ITS(ITS)、TUB2和EF-1α组合序列数据。然后使用软件MEGA 7.0,应用自展法(bootstrap)对分离得到的菌株构建系统进化树,自展数据为1 000次。
1.4 致病性测定
将刺葡萄‘高山二号、华东葡萄‘吉安、葡萄‘红地球的健康叶片分别剪下40片,用脱脂棉蘸取70%乙醇擦拭叶片表面消毒30 s后,然后用无菌水清洗3遍。每个葡萄品种分别取20片葡萄叶片作为试验组,另外20片设为对照,总共分为6组;用3号昆虫针在葡萄叶片表面制造微伤口,然后用直径为6 mm的打孔器在培养了7 d的拟盘多毛孢PDA平板上打取菌饼,分别接种到相应的葡萄叶片表面,以接PDA培养基为对照,上述试验均重复3次,置于28℃,湿度80%条件下培养,72 h后将菌饼移除,培养7~10 d,每天观察发病情况并记录。
1.5 常用杀菌剂室内抑菌效果的测定
含药平板法:在无菌条件下,将6种常用杀菌剂用无菌水配制成浓度为0.1 g/mL的母液以备用,然后设置4个浓度梯度,配制含药培养基。60%唑醚·代森联WG终浓度为125、625、1 250、2 000、2 500 mg/L;80%波尔多液WP终浓度为150、300、600、900、1 200 mg/L;50%多菌灵WP和70%甲基硫菌灵WP终浓度为50、250、500、750、1 000 mg/L;75%百菌清WP终浓度为100、200、400、600、800 mg/L;25%嘧菌酯SC终浓度为10、50、250、750、1 250 mg/L。待培养基冷凝后,用直径6 mm打孔器打取大小相同的菌丝块接种于不同杀菌剂处理的PDA培养基上,置于28℃,L∥D=12 h∥12 h的恒温培养箱中培养,每组重复6次,以无菌水代替杀菌剂为对照。每隔24 h观察记录1次,至第7天采用十字交叉法测量菌落直径,计算各药剂的菌丝生长抑制率。
菌丝生长抑制率=
对照菌落生长直径-处理菌落生长直径对照菌落生长直径-菌饼直径×100%。
计算出不同浓度下的抑制率后,以防治药剂浓度的对数值为横坐标,抑制率的生物统计几率值为纵坐标,使用Excel 2010处理后得到毒力回归方程及回归系数,并计算出有效中浓度(EC50),比较不同防治药剂的相对抑制效果。
2 结果与分析
2.1 病原菌形态观察
根据菌株在PDA平板上菌落的形态、大小和颜色等特征,本研究共从福建农林大学教学基地采集具有典型叶斑病症状(图1a)的刺葡萄‘高山二号病叶中分离得到1种致病菌株,将其编号为FJFZYeBan20180507。在PDA平板上,28℃培养7 d后,菌落呈近圆形,菌落正面为白色(图1b),呈波浪状,菌落背面为黄色,中心向外颜色逐渐变浅(图1c);14 d左右菌落上可见黑色油状小点,即为分生孢子盘,后期分生孢子盘上会出现墨汁状黏液(图1d~e),分生孢子盘散生,黑色,直径为138.92~246.04 μm。分生孢子呈纺锤形或长棱形(图1f~g),长22.26~31.18 μm,宽5.09~7.31 μm,共5个细胞,4个隔膜,分隔处缢缩不明显,顶端与基部细胞颜色较淡,多数呈透明状,中间3个细胞颜色较深,多为褐色,顶端有2~4(多为3)根不分支的附属丝,无色透明,基部细胞具有小柄(图1 h~k)。
2.2 系统发育分析
分离得到的菌株用ITS序列的通用引物(ITS1/ITS4),β-微管蛋白(TUB2)和EF-1α,可分别从其基因组DNA中扩增出一条约为500 bp(图2a)、450 bp(图2b)和280 bp(图2c)的特异性条带。将该菌株的测序结果提交至NCBI数据库,登录号分别为MK620299、MK620300和MK620301。序列信息比对结果显示,与该菌同源性较高的序列为棒状拟盘多毛孢属P.clavispora,同源性高达99%~100%。
通过MEGA7.0进行系统发育分析,以N.magna(MFLUCC_12-652)为外群,获得Pestalotiopsis属的系统进化树(图3),结果显示FJFZYeBan20180507与已登录的P.clavispora菌株(CGMCC 3.9123)具有很高的Bootstrap支持率,相似率最高,可以认为是同一种菌。因此通过ITS、β-微管蛋白和EF-1α 3个基因并结合病原菌形态学特征,得出FJFZYeBan20180507为棒状拟盘多毛孢菌P.clavispora。
2.3 致病性测定
刺葡萄‘高山二号、华东葡萄‘吉安、葡萄‘红地球的叶片在室内接种3 d后,在接种处出现褐色病斑,病斑周围叶片褪绿,中央变干,与田间症状类似(图4)。从具有典型症状的葡萄叶片上重新进行病菌分离,结果分离得到的菌株菌落形态与分离得到的菌株相同,符合柯赫氏法则,证明该菌株是引起葡萄叶斑病的病原菌。
2.4 常用防治药剂对病原菌的抑制作用
不同供试防治药剂对刺葡萄棒状拟盘多毛孢的抑制效果见表4。由表4可知,除50%多菌灵可湿性粉剂外,其余的防治药剂对刺葡萄棒状拟盘多毛孢均表现出一定的抑制作用,但不同的防治药剂间的抑制效果有差异。供试的防治药剂中,60%唑醚·代森联水分散粒剂和25%嘧菌酯悬乳剂对该病原菌菌丝生长的抑制效果最好,其EC50分别为0.119 mg/L和0.178 mg/L;其次为80%波尔多液可湿性粉剂,其EC50为1.766 mg/L;抑制效果最差的药剂为50%多菌灵可湿性粉剂,仅表现出轻微的抑制作用。
3 讨论
葡萄叶斑病的分布范围较广,是世界范围内普遍发生的重大病害之一,在我国大部分葡萄主栽区均有发生,发病较重时,可引起叶片提早脱落,进而影响树势的生长和果实产量。多种病原菌均可使葡萄叶部产生病斑,如葡萄褐柱丝霉Phaeoisariopsis vitis (Lev.)[13],葡萄生单轴霉Plasmopara viticola (Berk.et Curtis) Berl.et de Toni[14]等,张梦影等[15]
调查发现了尤韦可拟盘多毛孢 P.uvicola (Speg.) Bissett 能够侵害葡萄叶片引起叶斑病,但国内外未见拟盘多毛孢属危害刺葡萄叶片的报道。
本试验从福建农林大学教学基地采集的刺葡萄‘高山二号病叶样品中共分离纯化得到1株形态特征一致的致病菌株,对该菌株进行多基因系统发育分析,明确该菌为棒状拟盘多毛孢P.clavispora,在福建省内尚属首次发现。棒状拟盘多毛孢,为拟盘多毛孢属,可以危害枇杷、杧果、番石榴、山茶等多种植物,引起叶斑、腐烂、溃烂等症状。它的菌落形态、分生孢子盘及分生孢子与已报道的菌株P.clavispora[16]形态相似。在印度南部,该菌能引起茶的灰斑病[17]。Ismai等[18]報道P.uvicola 和P.clavispora能引起杧果灰斑病。Ruvishika等[12]认为Pestalotiopsis-like真菌可引起国内葡萄果实腐烂和葡萄藤病害,造成溃疡病。P.clavispora和P.neglecta能引起经济水果溃疡病和茎枯病[19]。赵景楠等[20]认为棒状拟盘多毛孢P.clavispora可引起草莓叶斑病,而薛德胜等[21]认为棒状拟盘多毛孢P.clavispora是引起山东省蓝莓叶斑病和根腐病的病原菌,说明该菌可引起作物多种病害。本研究结果与之前其他物种中分离的致病菌P.clavispora一致,而该菌所造成的刺葡萄叶斑病在我国其他地方是否也有分布还有待于进一步研究。
目前对该病害的防治措施主要是田间管理和化学药剂防治。及时清理果园、改善果园通风透光条件、降低园内湿度、严控化肥的施用及葡萄果实负载量均是田间管理的主要措施。化学药剂防控主要是前期预防,多菌灵、唑醚·代森联等均是市面上较为常用的药剂。然而市场上仍未有明确的防治药剂能够对该菌产生显著的抑制效果。
本试验测定了7种杀菌剂对葡萄棒状拟盘多毛孢菌丝的生长和孢子萌发的抑制效果,结果表明唑醚·代森联对病菌的抑制效果最好,嘧菌酯和百菌清也有一定的抑制作用,其余的如波尔多液、多菌灵和甲基硫菌灵对该病原菌几乎没有抑制效果。该结果为刺葡萄叶斑病的田间药剂试验提供参考,还需要在田间进行试验方可推广。
参考文献
[1] 张浦亭,范邦文,余烈,等. 刺葡萄品种“塘尾葡萄”[J]. 中国果树, 1985(1): 32-34.
[2] 李桂永,李枝清,吴瑞章,等. 南方刺葡萄新品种“紫秋”的选育[J]. 中国南方果树,2007(1): 59-60.
[3] 徐丰,石雪晖,杨国顺,等. 湖南不同类型刺葡萄植物学性状研究[J]. 中外葡萄与葡萄酒, 2010(3): 8-12.
[4] 魏泽平,林旭. 溪塔刺葡萄与5个野生葡萄的ISSR标记分析[J]. 农业科技通讯,2015(6): 121-123.
[5] 施金全,王道平,江映锦. 刺葡萄新品种“惠良”的选育及配套栽培技术[J]. 中国南方果树,2017, 46(2): 169-171.
[6] 叶永茂. 福安刺葡萄丰产优质栽培的几项技术措施[J]. 农业科技通讯, 2018(10): 275-276.
[7] 石雪晖,杨国顺,钟晓红,等. 湖南省葡萄产业发展历程与趋势[J]. 中外葡萄与葡萄酒, 2011(3): 61-66.
[8] 刘晓菊. 葡萄褐斑病的发生与防治方法[J]. 北方园艺, 2010(1): 190-191.
[9] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 15, 427.
[10]CAI Lei, HYDE K D, PAUL TAYLOR, et al. A polyphasic approach for studying Colletotrichum [J]. Fungal Diversity, 2009, 39: 183-204.
[11]WEIR B S, JOHNSTON P R, DAMM U. The Colletotrichum gloeosporioides species complex [J]. Studies in Mycology, 2012, 73: 115-180.
[12]RUVISHIKA S J, ZHANG Wei, LIU Mei, et al. Identification and characterization of Pestalotiopsis-like fungi related to grapevine diseases in China [J]. Fungal Biology, 2015, 119(5): 348-361.
[13]梁春浩,于舒怡,李海春,等. 沈阳地区葡萄褐斑病流行规律初步研究[J]. 植物保护, 2014, 40(6): 126-130.
[14]杜蕙,王春明,吕和平,等. 不同来源葡萄霜霉菌致病力差异研究[J]. 中国果树, 2019(1): 42-46.
[15]张梦影,温晓蕾,赵美键,等. 葡萄尤韦可拟盘多毛孢叶斑病病菌的生物学特性[J]. 河北科技师范学院学报, 2018, 32(1): 39-42.
[16]SAJEEWA S N M, GUO Liangdong, CAI Lei, et al. A multi-locus backbone tree for Pestalotiopsis, with a polyphasic characterization of 14 new species [J]. Fungal Diversity, 2012, 56(1): 95-129.
[17]JOSHI S D, SANJAY R, BABY U I, et al. Molecular characterization of Pestalotiopsis spp. associated with tea (Camellia sinensis) in southern India using RAPD and ISSR markers [J]. Indian Journal of Biotechnology, 2009, 8: 377-383.
[18]ISMAIL A M, CIRVILLERI G, POLIZZI G. Characterisation and pathogenicity of Pestalotiopsis uvicola and Pestalotiopsis clavispora causing grey leaf spot of mango (Mangifera indica L.) in Italy [J]. European Journal of Plant Pathology, 2013, 135(4): 619-625.
[19]JOS G E, ERIKA X B, LISA K, et al. Canker and twig dieback of blueberry caused by Pestalotiopsis spp. and a Truncatella sp. in Chile [J]. Plant Disease, 2008, 92(10): 1407-1414.
[20]赵景楠,马喆,刘正坪,等. 草莓拟盘多毛孢叶斑病的病原菌[J]. 菌物学报, 2016, 35(1): 114-120.
[21]薛德胜,邵兆浩,李保华,等. 防治蓝莓棒状拟盘多毛孢菌化学药剂的室內筛选[J]. 山东农业科学, 2018, 50(9): 115-118.
(责任编辑:田 喆)
