Ni基催化剂处理甲基橙废水动力学及机理研究
2020-08-25吴正雷彭文博董凯
吴正雷 彭文博 董凯

摘 要:以γ-Al2O3为载体,利用浸渍法自制Ni2O3-MnO2-CeO2/γ-Al2O3催化剂催化次氯酸钠处理甲基橙废水,探讨了甲基橙降解的反应动力学和热力学,并运用紫外-可见吸收光谱研究甲基橙的降解机理。结果表明:降解甲基橙反应为一级反应,其反应速率常数受到甲基橙初始浓度和反应温度的影响,反应活化能为25 305.74 J/mol。此外,根据紫外-可见吸收光谱初步推测了甲基橙的降解机理主要包括脱甲基化和裂解开环等反应,最终甲基橙被分解成苯酚、对苯二酚、苯醌和丁烯二酸等中间产物。
关 键 词:催化氧化;次氯酸钠;甲基橙;动力学;降解机理
中图分类号:X703.1 文献标识码: A 文章编号: 1671-0460(2020)05-0850-05
Abstract: Supported Ni2O3-MnO2-CeO2/-Al2O3 catalysts were prepared by immersion method with-Al2O3 as carrier. The catalysts were applied to treat the methyl orange wastewater. Kinetics and thermodynamics were discussed and the degradation mechanism of methyl orange wastewater was studied by UV-visible absorption spectra. The analysis result of reaction kinetics revealed that the degradation of methyl orange was first-order kinetics and the reaction velocity was affected by methyl orange initial concentration and the temperature. The reaction activation energy was 25 305.74 J/mol. Analytical result of UV-visible absorption spectra indicated the pyrolysis reactions of methyl orange mainly included demethylation and open ring reactions, finally methyl orange was degraded into intermediates,such as phenol, hydroquinone, benzoquinone and butenedioic acid and so on.
Key words: Catalytic oxidation; Sodium hypochlorite; Methyl orange; Dynamics; Degradation mechanism
次氯酸钠俗称漂白水,在常温下即有高效的氧化作用,因此常用作消毒剂、漂白剂[1]。在废水(尤其是印染废水)色度去除方面具有独特的优势,但由于次氯酸钠稳定性较差,较高的温度或日光照射容易导致其发生分解,生成NaClO3、NaCl和HCl等副产物,降低了次氯酸钠的利用率。针对次氯酸钠的上述缺点,国内外学者研究证实镍基催化剂能促进NaClO产生强氧化性的新生态氧[O],可以有效提高NaClO的反应速率和氧化性[2,3]。这是由于镍基催化剂具备价态可变的特性,能够促进氧化还原循环进行[4,5]。龚雪君[6]采用Ni2O3/AC催化剂,以NaClO为氧化剂,催化氧化蒽醌染料中间体1-氨基蒽醌废水。实验结果表明,Ni2O3/AC催化剂在碱性环境下对废水有较好的处理效果,COD去除率达到85.1%,脱色率达到96.5%。
目前对Ni基催化剂催化次氯酸鈉氧化有机废水的动力学和降解机理研究较少,本研究采用浸渍法自制负载型Ni2O3-MnO2-CeO2/γ-Al2O3非均相催化剂,用于催化次氯酸钠处理甲基橙模拟的印染废水,通过紫外可见光谱分析探讨Ni基催化剂催化氧化降解甲基橙的动力学规律,推测反应机理和反应历程,为Ni基催化剂的工程应用提供初步的理论依据。
1 实验部分
1.1 试剂与仪器
试剂:甲基橙,分析纯,上海迈坤化工有限公司;次氯酸钠(有效氯为5.2%,下同),化学纯,东茂化学试剂有限公司;氢氧化钠、浓硫酸,分析纯,浙江三鹰化学试剂有限公司;硝酸镍,分析纯,廊坊鹏彩精细化工有限公司;高锰酸钾、硝酸铈,分析纯,国药集团化学试剂有限公司。
仪器:PHS-3C型pH计,广州佳仪精密仪器有限公司;双杰JJ523BC型电子天平,昆山托普泰克电子有限公司;CLJB-09型磁力搅拌器,北京中西远大科技有限公司;UV1900型双光束紫外-可见光分光光度计,山东达普机械制造有限公司;WLT-14SM型马弗炉,河南威尔泰炉业有限公司; HH-8型恒温水浴锅,江苏金坛市中大仪器厂;DHG型立式鼓风干燥箱,无锡玛瑞特科技有限公司。
1.2 催化剂的制备
取适量? 3~5 mm球型γ-Al2O3载体,置于干燥箱中在80~100℃下干燥至恒重后倒入一定浓度的硝酸铈溶液中,搅拌30 min后静置24 h,在110 ℃干燥6 h,再置于马弗炉中在一定温度下焙烧6 h,最后再次浸渍硝酸镍和KMnO4的混合溶液,重复上述实验步骤,得到Ni2O3-MnO2-CeO2/γ-Al2O3催化剂[7]。
1.3 分析方法
用UV1900型双光束紫外-可见光分光光度计在400~600 nm 扫描甲基橙最大吸收波长,确定在可见区的最大吸收波长为465 nm;并在465 nm 波长下测定不同浓度甲基橙溶液的吸光度,绘制浓度标准曲线,根据浓度标准曲线计算出反应前后甲基橙溶液浓度。
2 结果与讨论
2.1 反应动力学
配制pH为6,浓度为5、10和20 mg/L的甲基橙溶液各100 mL,分别加入5 g Ni2O3-MnO2-CeO2/γ-Al2O3催化剂,0.1 mL次氯酸钠溶液,在25 ℃的条件下每隔一段时间取样在最大吸收波长处测其吸光度,考察甲基橙初始浓度对甲基橙降解速率的影响,结果如图1所示。
由图2和表1可见,﹣lnCMO和t成良好的线性关系,相关系数R2均达到0.99以上,表明Ni2O3-MnO2-CeO2/γ-Al2O3催化剂催化NaClO体系降解甲基橙的过程符合一级动力学模型[9]。
三个线性方程的表观反应速率常数k?分别为0.160 5、0.161 7和0.156 5 min-1。通常反应速率常数随溶液初始浓度的增加而降低,因为浓度越高反应越慢,但浓度为10 mg/L时反应速率常数高于浓度为5 mg/L的速率常数,造成上述现象的可能原因是5 mg/L时,浓度过低,甲基橙被吸附在催化剂表面活性点位的量较少,在催化剂上与原子氧[O]碰撞反应的几率低,导致反应速率慢。随MO浓度的升高至20 mg/L,MO扩散到催化剂活性点位的能力提高,在催化剂上反应产生的中间产物也会被吸附在活性点上来不及脱附到液相中,因而阻碍了其他的MO的吸附与降解,导致降解速率下降。说明该催化氧化反应包含吸附和脱附的过程,反应的主要场所是在催化剂活性点位上,而不是甲基橙和次氯酸钠在水中直接反应。
因此推测该反应过程是甲基橙分子先被吸附到催化剂活性点位上,同时次氯酸钠也被吸附在催化剂活性点位上產生原子氧[O],然后在催化剂活性点位上的甲基橙和原子氧[O]发生反应。
2.2 反应热力学
配制pH为6,浓度为20 mg/L的甲基橙溶液100 mL各3份,分别加入5 g催化剂和0.1 mL的次氯酸钠溶液,控制反应温度为25、40和60 ℃,每隔一段反应时间取样在最大吸收波长处测其吸光度。考察不同反应温度对降解甲基橙溶液的影响,结果如图3所示。
2.3 紫外-可见光谱图分析
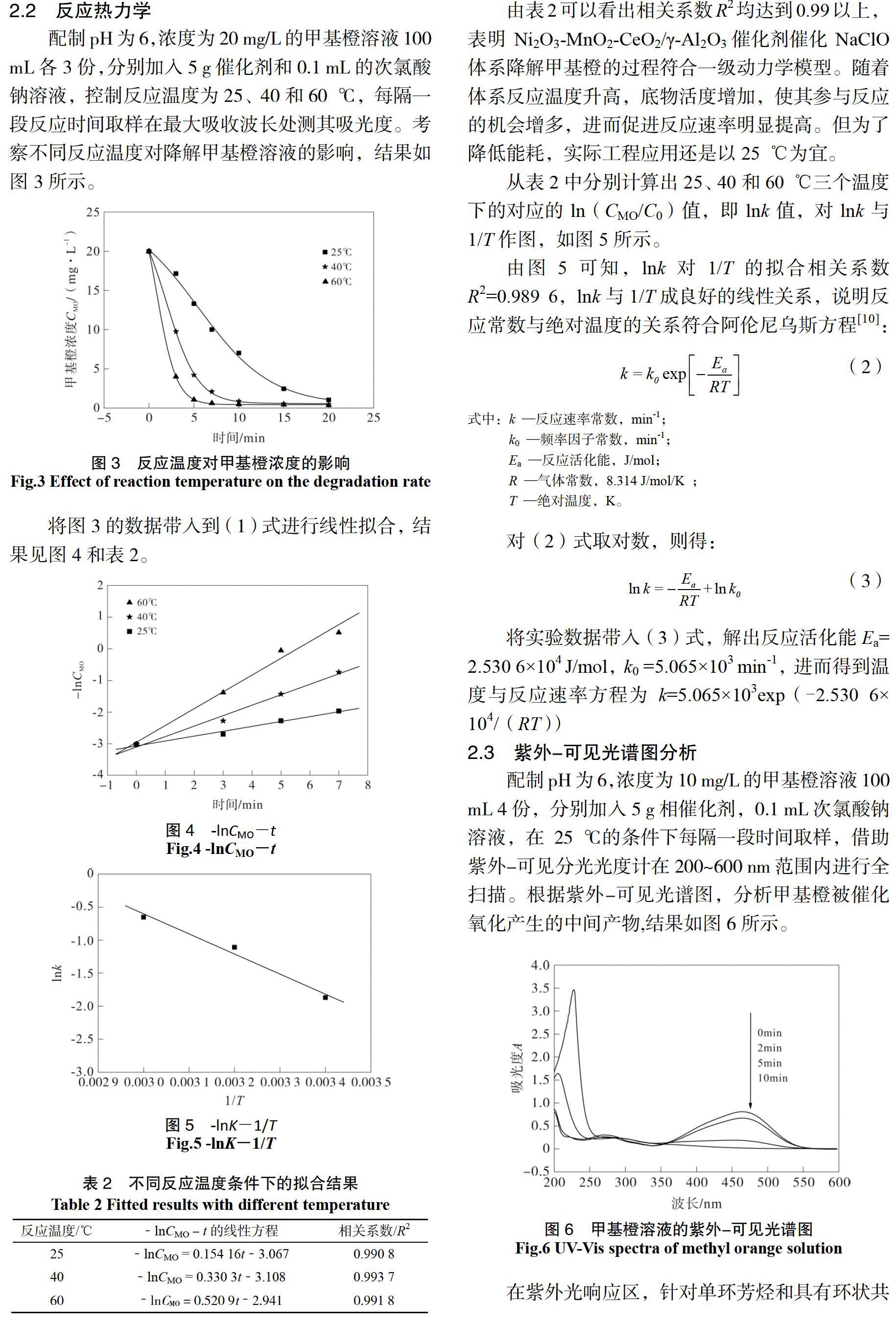
配制pH为6,浓度为10 mg/L的甲基橙溶液100 mL 4份,分别加入5 g相催化剂,0.1 mL次氯酸钠溶液,在25 ℃的条件下每隔一段时间取样,借助紫外-可见分光光度计在200~600 nm范围内进行全扫描。根据紫外-可见光谱图,分析甲基橙被催化氧化产生的中间产物,结果如图6所示。
在紫外光响应区,针对单环芳烃和具有环状共轭不饱和有机物的最大波长分别位于275 nm和200~250 nm,而多环芳烃化合物和杂环化合物的最大波长位于300~370 nm[11]。
由图6看出反应前甲基橙溶液在275 nm处有个吸收峰,是由苯环共轭体系的π-π*跃迁引起的,属于甲基橙分子中苯环的特征吸收峰;在465 nm处有一个强吸收峰,由甲基橙分子中偶氮结构的n-π*跃迁引起的,属于甲基橙的偶氮键特征吸收峰[12]。
随着氧化反应的进行,465 nm处偶氮特征峰高度迅速降低,直至完全消失,此时反应液的颜色也由黄色变成无色,表明甲基橙分子结构中的偶氮键被氧化破坏,甲基橙分子中-SO3Na和-N(CH3)2 发色基团也脱落,使n-π*的跃迁逐渐消失;在275 nm处的吸收峰随着反应时间的增加也在逐渐减少,但很缓慢,这是因为甲基橙苯环结构稳定,苯环共轭体系的π-π*跃迁被氧化很难破坏[13,14]。同时在200~250 nm处产生越来越高的吸收峰,主要为苯酚、对苯二酚、苯醌和丁烯二酸等[15,16]中间产物。
2.4 反应机理初探
目前Ni催化剂催化次氯酸钠的反应机理尚无统一结论,但大多数学者认可的反应机理是:废水中的有机污染物分子和次氯酸钠分子经扩散被吸附到催化剂上的活性点位,并发生催化氧化反应,氧化产物再脱附离开活性点位返回液相主体,形成一个吸附—催化氧化—脱附的动态循环过程,直至反应达到平衡。其反应的具体动态循环过程如下:
上述反应生成的二氧化镍(NiO2)和原子氧[O]有极强的氧化性活性[17]。
因此根据上述反应方程式和图6中甲基橙溶液的紫外-可见光谱图,初步推测反应机理如下:
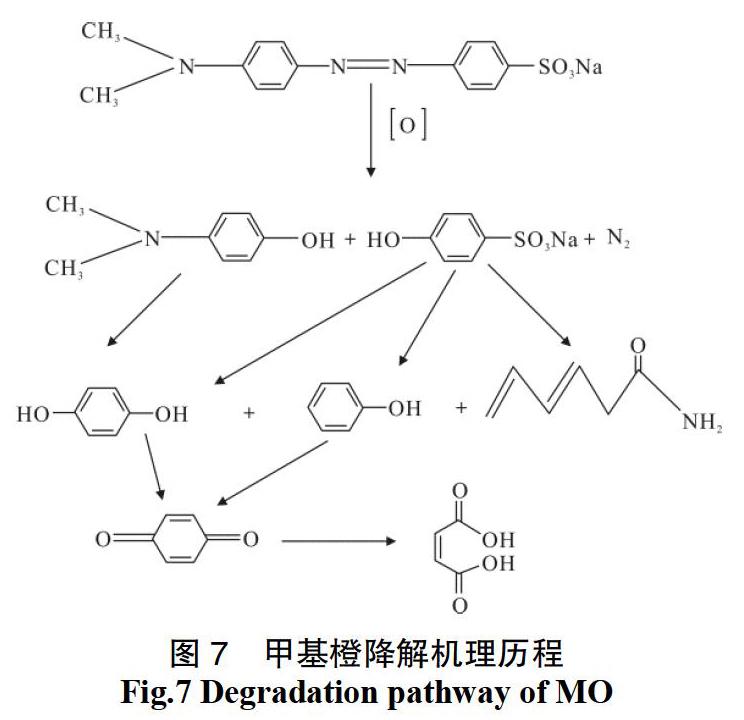
甲基橙分子和次氯酸钠分子扩散且被吸附到镍基催化剂的表面活性点位,次氯酸钠分子在活性点位被氧化为氧化性极强的原子氧[O],然后原子氧[O]首先进攻甲基橙分子中带有未成对电子的偶氮键,通过破坏甲基橙的发色基团达到降解脱色的目的,这从反应液颜色从黄色变淡直至无色的变化得到佐证。原子氧[O]攻击偶氮键导致甲基橙分子从中间断开,分解为多种芳香类物质;接着原子氧[O]进一步攻击苯环大π键,生成对苯二酚、苯酚和酰胺等中间产物,随着反应的进行,部分对苯二酚和苯酚进一步被氧化成苯醌,故而会在200~250 nm之间出现强吸收峰,且随反应时间的增加而增强,说明产生的苯系物越来越多。反应结束后,测反应液pH值略微降低,说明苯醌相对不稳定,被开环继续降解为丁烯二酸等产物。
由于甲基橙本身具有异构体互变的复杂性,本实验的机理也只是在理论上作了一定的推测,对其机理的认识还很不全面,因为通过紫外-可见光谱图仅能判断出反应中间产物的基团性质,而其具体结构需结合其他分析手段如高效液相色谱等确定(图7)。
3 结论
(1)对甲基橙催化氧化过程进行表观反应动力学和热力学研究,结果表明:催化降解甲基橙反应为一级反应,而且其反应速率常数受到甲基橙初始浓度和反应温度的影响,活化能为25 305.74 J/mol,温度与反应速率方程为k=5.065×103 exp(-2.530 6× 104/(RT))。
(2)从紫外-可见光谱图可以看出:随着反应时间的增加,465 nm处偶氮特征峰高度迅速降低,直至完全消失,表明甲基橙分子结构中的偶氮键被氧化破坏。而在275 nm处有芳香类物质特有吸收峰,但减少比较缓慢,这是因为苯环结构稳定,很难破坏;在200~250 nm之间出现强吸收峰,表明有苯酚、对苯二酚、苯醌和丁烯二酸等中间产物生成。
(3)初步推测反应机理如下:镍基催化剂和次氯酸钠反应产生氧化性极强的原子氧[O]首先进攻甲基橙分子中带有未成对电子的偶氮键,同时破坏甲基橙的共轭发色基团,导致甲基橙分子从中间断开,分解为多种芳香类物质;接着原子氧[O]进一步攻击苯环大π键,生成苯酚 、对苯二酚、苯醌和丁烯二酸等中间产物。
参考文献:
[1]Lebedev A T, Shaydullina G M, Sinikova N A, et al. GC-MS comparison of the behavior of chlorine and sodium hypochlorite towards organic compounds dissolved in water[J]. Water Research, 2004, 38(17): 3713-2549.
[2]Lai T L, Wang W F, Shub Y Y, et al. Evaluation of microwave-enhanced catalytic degradation of 4-chlorophenol over nickel oxides[J]. J Mol. Catal. A: Chem, 2007, 272(1/2): 303-309.
[3]Poncelet G, Centeno M A, Molina R. Characterization of reduced α-Alumina-supported nickel catalysts by spectroscopic and chemisorption measurements[J]. Appl. Catal, A: general, 2005, 288(1/2): 232-242.
[4]Frank K,Fred E H. Catalysis and pollution abatement:the removal of hypochlorite from waste chlorine/caustic effluent[J]. Catalysis Today, 1996, 27(1): 203-207.
[5]Chuan L, Shaheen A A, James A R. Thermal treatment of sol-gel derived nickel oxide xerogels[J]. Journal of Sol-Gel Science and Technology, 2003, 28(1): 133-141.
[6]Gong Xuejun,Chen Xiaorong,Mei Hua . Catalytic oxidation of Ni2O3 /AC catalysts for degradation of anthraquinone dye intermediate[J]. Environmental Science & Technology, 2013, 36(12): 117-121.
[7]吳正雷, 曹子燚, 张帆, 等.Ni2O3-MnO2-CeO2/γ-Al2O3非均相催化剂的制备、表征及其催化性能[J]. 石油化工, 2013, 42(9):1028-1034.
[8]杨德敏, 夏宏, 门奇, 等. 非均相催化臭氧氧化深度处理钻井废水的机理和动力学[J]. 石油化工, 2014, 43(4):343-347.
[9]邵鲁华, 魏光涛, 王艺志, 等. 机械力化学活化HPW-TiO2/膨润土光催化降解甲基橙[J]. 化工环保, 2016, 36(2): 168-172.
[10]Sun S P, Zeng X, Lemley A T. Kinetics and mechanism of carbamazepine degradation by a modified Fenton-like reaction with ferric-nitrilotriacetatecomplexes[J]. Journal of Hazardous Materials, 2013, (252/253): 155-165.
[11]伍开毅. 镍催化剂的制备、表征及其在臭氧催化氧化降解焦化废水尾水中的应用[D]. 上海: 华南理工大学, 2018.
[12]Zhao WT, Huang X, Lee DJ. Enhanced treatment of coke plant wastewater using an anaerobic–anoxic–oxic membrane bioreactor system[J]. Separation & Purification Technology,2009,66(2):279-286.
[13]孙宏, 张泽, 潘珊珊. 负载型纳米Mn-Fe双金属配合物的制备及催化性能[J]. 化学工程, 2016, 44(9): 6-10.
[14]孙宏, 张泽, 于祥辉. ZnFe2O4/ZnO复合材料光催化氧化水中甲基橙[J]. 印染助剂, 2018, 35(9): 44-47.
[15]朱佳迪, 程露芽, 张涛, 等. 印染废水甲基橙电解脱色动力学及脱色产物研究[J]. 浙江树人大学学报, 2016, 16(1):22-26.
[16]杨思静. 水力空化强化 ClO2破解甲基橙和苯并[a]斑机理研究[D]. 太原:中北大学, 2018.
[17]谢少雄, 黄功浩, 何淑妤. 催化氧化法处理印染废水的实验研究[J]. 汕头大学学报(自然科学版), 2003, 18(2): 40-44.
