2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮的合成
2020-08-25唐文强高艳蓉刘斌
唐文强 高艳蓉 刘斌

摘 要:报道了一种2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮的合成方法。以2-羟基萘醌-1,4-二酮和(E)-查尔酮为原料通过Michael加成反应合成得到标题化合物2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮,采用MS、1H NMR和13C NMR对其化学结构进行验证,并考察了反应条件。n(查尔酮): n(2-羟基-1,4-萘醌)= 1.1 : 1;TEA用量为n(TEA): n(2-羟基-1,4-萘醌)= 0.20 : 1;以二氯甲烷为溶剂,25 ℃,反应45 min为最佳反应条件,此时产物1a收率为92.9 %。对反应底物进行拓展,该最佳反应工艺条件被用于1-(3-羟基-1,4-二氧代-1,4-二羟基萘-2-基)肼-1,2-二羧酸二异丙酯1b的合成,收率达到94.4 %。
关 键 词:萘醌衍生物;3-取代-2-羟基萘醌;Michael加成;合成
中图分类号:TQ031.2 文献标识码: A 文章编号: 1671-0460(2020)05-0794-04
Abstract: 2-Hydroxy-3-(3-oxo-1,3-diphenylpropyl)naphthalene-1,4-dione was synthesized by the Michael addition reaction of 2-hydroxynaphthalene-1,4-dione and (E)-chalcone in the presence of triethylamine as catalyst.The structure of the product was confirmed by 1H NMR, 13C NMR and MS. The optimal reaction conditions were investigated, and target compound 1a was obtained in the yield of 92.9% when n(chalcone): n(2-hydroxynaphthalene-1,4-dione)was 1 : 1.1, n(TEA): n(2-hydroxynaphthalene-1,4-dione) was 0.20 : 1, dichloromethane was used as solvent, the reaction temperature was 25 ℃ and the reaction time was 45 min. The synthesis method was used for synthesis of diisopropyl 1-(3-hydroxy-1,4-dioxo-1,4-dihydronaphthalen-2-yl)hydrazine-1,2-dicarboxylate 1b,and the yield reached 94.4 %.
Key words: Naphthaquinone derivatives; 3-substituted 2-hydroxynaphthalene-1,4-dione; Michael addition reaction; Synthesis
萘醌作為一种重要的生物活性结构骨架,广泛地存在于许多具有生物活性的化合物结构中[1-4]。许多天然存在的萘醌及人工合成萘醌衍生物都是制备具有生物活性天然产物和药物重要中间体[5-9]。许多含有萘醌的化合物之所以具有生物活性是因为有萘醌骨架药效团的存在,含有萘醌结构的抗肿瘤药物如米托蒽醌(Mitoxantrone)、双氢胺蒽醌(Ametantrone)、阿霉素(Doxorubicin)等在临床应用上发挥了重要的作用[10-13]:
鉴于萘醌类化合物的所具有的重要潜在生物活性,大量的萘醌类衍生物被合成出来用于前期药物的研究[14,15]。因而,合成并开发具有生物活性的萘醌类衍生物对于具有潜在生物活性的此类化合物的研发具有重要的意义。
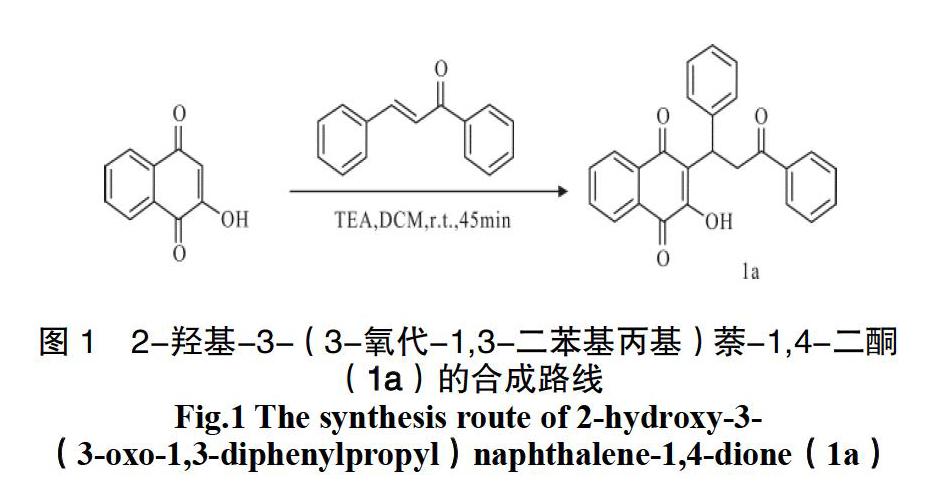
为了研究萘醌类化合物的生物活性,尤其是3-取代-2-羟基萘醌在抗肿瘤药物中的应用,本研究以2-羟基萘醌-1,4-二酮和查尔酮为原料在三乙胺催化作用下通过Michael加成反应合成得到化合物2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮(1a),并对反应工艺进行研究,确定了化合物1a的最佳反应条件,对于反应底物进行拓展,该最佳反应工艺条件被用于1-(3-羟基-1,4-二氧代-1,4-二羟基萘-2-基)肼-1,2-二羧酸二异丙酯1b的合成。目标化合物1a和1b结构经1H NMR、13C NMR和MS确证。该合成方法为3-取代-2-羟基萘醌衍生物的合成提供了一种可行的途径(图1)。
1 实验部分
1.1 主要原料与仪器
2-羟基-1,4-萘醌、查尔酮,购自阿拉丁;300 ~ 400目柱层析硅胶,购自青岛海洋化工厂;其他试剂均为市售分析纯。
德国Bruker公司AV400型核磁共振仪(CDCl3为溶剂,TMS为内标);美国Waters公司Ultima Global Spectrometer型质谱仪(ESI源)。
1.2 合成方法
2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮(1a)的合成:
在100 mL的三口瓶中加入2-羟基-1,4-萘醌1.74 g(10.0 mmol)、查尔酮2.29 g(11.0 mmol)、二氯甲烷(30 mL),搅拌均匀后,再加入三乙胺202 mg(2.0 mmol),体系瞬间变为红色,磁力搅拌,25 ℃反应45 min。反应结束后,除去溶剂,采用硅胶柱分离(V(二氯甲烷): V(甲醇)= 20 : 1)得到淡黄色油状液体3.55 g,收率92.9%。1H NMR (400 MHz, CDCl3) δ 8.11 ~ 8.06 (m, 1H), 8.00 ~ 7.96 (m, 3H), 7.70 (td, J = 7.6, 1.2 Hz, 1H), 7.64 ~ 7.59 (m, 1H), 7.56 ~ 7.50 (m, 3H), 7.43 (t, J = 7.6 Hz, 2H), 7.30 (t, J = 7.6 Hz, 2H), 7.20 (t, J = 7.3 Hz, 1H), 5.17 (dd, J = 9.9, 5.4 Hz, 1H), 4.43 (dd, J = 18.1, 10.0 Hz, 1H), 3.72 (dd, J = 18.1, 5.4 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ 198.40, 184.32, 181.71, 152.62, 141.97, 136.76, 135.02, 133.11, 132.95, 132.88, 129.22, 128.60, 128.37, 128.08, 127.11, 126.80, 126.01, 124.95, 41.66, 36.65。
2 结果与讨论
2.1 物料比对产物1a收率的影响
查尔酮和2-羟基-1,4-萘醌之间发生Michael加成反应,反应中两者的物料比对产物1a的收率具有重要的影响,结果见表1。
当三乙胺用量为n(TEA) : n(2-羟基-1,4-萘醌) = 0.2 : 1,反应在二氯甲烷溶剂中,25 ℃(室温)反应45 min时,当物料比n(查尔酮): n(2-羟基-1,4-萘醌)为1.0 : 1时,TLC监测显示原料查尔酮有剩余,收率为87.3%,我们选择提高查尔酮的用量,尽可能使2-羟基-1,4-萘醌反应完全,一方面由于查尔酮极性较小,纯化时较容易分离,而2-羟基-1,4-萘醌极性较大,在柱层析时严重拖尾,不利于纯化分离;另一方面是由于查尔酮价格相对较低。当n(查尔酮): n(2-羟基-1,4-萘醌) 物料比为1.1 : 1时,收率明显升高到92.9%,继续增加查尔酮的量到1.2 : 1时,收率没有明显变化。继续增加比例,收率略有降低,最终选择最佳物料配比n(查尔酮) : n(2-羟基-1,4-萘醌)= 1.1 : 1。
2.2 三乙胺用量对产物1a收率的影响
在有机碱三乙胺(TEA)的催化作用下,查尔酮和2-羟基-1,4-萘醌发生Michael加成反应制备2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮(1a),在确定了最佳物料比n(查尔酮) : n(2-羟基-1,4-萘醌)= 1.1 : 1,而固定其他反应条件不变时,研究反应中TEA用量对产物的收率的影响,结果见表2。
当三乙胺用量为n(TEA): n(2-羟基-1,4-萘醌)= 0.10 : 1时,反应仍然能较快进行,但反应速率较慢,产物1a收率仅为82.6%,提高TEA的比例,收率明显升高,当TEA与2-羟基-1,4-萘醌的摩尔比例提高到为0.20 : 1时,收率达到92.9%,继续增加TEA的量,收率没有明显变化。最终,确定TEA用量为n(TEA) : n(2-羟基-1,4-萘醌) = 0.20 : 1。
2.3 溶剂对产物1a收率的影响
反应溶剂对反应的进行具有重要影响,在确定了最佳物料比n(查尔酮): n(2-羟基-1,4-萘醌) = 1.1 : 1,TEA用量为n(TEA): n(2-羟基-1,4-萘醌) = 0.20 : 1,其他反应条件固定不变时,继续研究反应溶剂对产物1a的影响,结果见表3。
由表3可见,通过筛选四种反应溶剂,发现该反应在非极性溶剂四氢呋喃(THF)和甲苯(Toluene)中收率均较低,在甲醇(MeOH)中1a收率为84.3%,以二氯甲烷(DCM)为溶剂时1a收率可达到92.9%。因此,选择DCM作为该反应的溶剂。
2.4 反应温度对产物1a收率的影响
在确定了最佳物料比n(查尔酮) : n(2-羟基-1,4-萘醌)= 1.1 : 1,TEA用量为n(TEA): n(2-羟基-1,4-萘醌)= 0.20 : 1,二氯甲烷为溶剂,反应45 min,研究温度对1a收率的影响,结果见表4。
由表4可见,反应在冰浴下(0 ℃)进行时,产物1a收率仅为75.0%,当温度高到室温(25 ℃)时,收率从75.0%升高到92.9%,继续升高温度到50 ℃时,收率出现降低,可能是温度过高而导致反应中发生副反应。因此,确定25 ℃为最佳的反应温度。
2.5 时间对产物1a收率的影响
在确定了最佳物料比n(查尔酮) : n(2-羟基-1,4-萘醌)= 1.1 : 1,TEA用量为n(TEA): n(2-羟基-1,4-萘醌)= 0.20 : 1,反应溶剂为二氯甲烷,最佳反应温度为25 ℃后,对反应时间研究发现(见表5),当反应进行15 min时,收率为53.8%,TLC显示原料大量剩余,延长反应时间,收率明显增加,反应45 min,收率为92.9 %,继续反应至60 min,收率变化不明显。因此,45 min为最佳的反应时间。
2.6 产物1a的核磁结构分析
对于目标化合物的1H NMR分析(图2),δ 8.11 ~ 8.06(m, 1H), 8.00 ~ 7.96(m, 3H),7.70(td, J = 7.6, 1.2 Hz, 1H),7.64 ~ 7.59(m, 1H),7.56 ~ 7.50(m, 3H),7.43(t, J = 7.6 Hz, 2H),7.30(t, J = 7.6 Hz, 2H),7.20(t, J = 7.3 Hz, 1H)为芳环上的氢,δ 5.17(dd, J = 9.9, 5.4 Hz, 1H)为与苯环连接的次甲基Ph-CH,δ 4.43(dd, J = 18.1, 10.0 Hz, 1H)和3.72(dd, J = 18.1, 5.4 Hz, 1H)为与苯甲酰基直接相连的亚甲基上的质子Ph-COCH2-。
产物1a的核磁共振碳谱见图3。
3 反应底物拓展
按照化合物1a最佳反应条件,以2-羟基-1,4-萘醌和偶氮二甲酸二异丙酯为原料合成得到1-(3-羥基-1,4-二氧代-1,4-二羟基萘-2-基)肼-1,2-二羧酸二异丙酯(图4),淡黄色油状液体,收率94.4%。
1H NMR (400 MHz, CDCl3) δ 8.14 (dd, J = 20.0, 6.8 Hz, 2H), 7.81 ~ 7.69 (m, 2H), 7.50 (s, 1H), 5.02 (ddd, J = 23.0, 12.4, 6.2 Hz, 2H), 1.39 ~ 1.17 (m, 12H)。
图5为产物1b的核磁共振氢谱。
4 结论
报道一种2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮的合成方法。以2-羟基萘醌-1,4-二酮和(E)-查尔酮为原料通过Michael加成反应合成得到化合物2-羟基-3-(3-氧代-1,3-二苯基丙基)萘-1,4-二酮(1a),并对反应工艺进行研究,确定了化合物1a的最佳反应条件:n(查尔酮): n(2-羟基-1,4-萘醌)= 1.1 : 1;TEA用量为n(TEA): n(2-羥基-1,4-萘醌)= 0.20 : 1;二氯甲烷为溶剂;25 ℃反应45 min,此时化合物1a收率为92.9%。对于反应底物进行拓展,该最佳反应工艺条件被用于1-(3-羟基-1,4-二氧代-1,4-二羟基萘-2-基)肼-1,2-二羧酸二异丙酯1b的合成,收率达到94.4%。目标化合物结构经1H NMR、13C NMR和MS确证。
参考文献:
[1]De Andrade-Neto V F, Goulart M O, da Silva F J , et al. Antimalarial activity of phenazines from lapachol, β-lapachone and its derivatives against Plasmodium falciparum in vitro and Plasmodium berghei in vivo[J]. Bioorganic & Medicinal Chemistry Letters, 2004, 14(5):1145-1149.
[2]Tandon V K, Yadav D B, Singh R V, et al. Synthesis and biological evaluation of novel (L)-α-amino acid methyl ester, heteroalkyl, and aryl substituted 1,4-naphthoquinone derivatives as antifungal and antibacterial agents[J]. Bioorganic and Medicinal Chemistry Letters, 2005, 15(23):5324-5328.
[3]Gomez-Monterrey I, Santelli G, Campiglia P, et al. Synthesis and cytotoxic evaluation of novel spirohydantoin derivatives of the dihydrothieno [2,3-b] naphtho-4,9-dione system[J]. Journal of medicinal chemistry, 2005,48(4), 1152-1157.
[4]Gl?Nzel M, Ralph Bültmann, Starke K, et al. Structure–activity relationships of novel P2-receptor antagonists structurally related to Reactive Blue 2[J]. European Journal of Medicinal Chemistry, 2005, 40(12):1262-1276.
[5]Castellano S, Bertamino A, Gomez-Monterrey I, et al. A practical, green, and selective approach toward the synthesis of pharmacologically important quinone-containing heterocyclic systems using alumina-catalyzed Michael addition reaction[J]. Tetrahedron Letters, 2008, 49(4):583-585.
[6]Zhang G, Wang Y, Zhang W, et al. Organocatalytic Michael addition of naphthoquinone with α,β-unsaturated ketones: primary amine catalyzed asymmetric synthesis of lapachol analogues[J]. European Journal of Organic Chemistry, 2011, 2011(11):2142-2147.
[7]Wei P, Zhang X, Tu S, et al. New potential inhibitors of DNA topoisomerase. Part II: Design and synthesis of α-lapachone derivatives under microwave irradiation[J]. Bioorganic & Medicinal Chemistry Letters, 2009, 19(3):828-830.
[8]Hsin L W, Wang H P, Kao P H, et al. Synthesis, DNA binding, and cytotoxicity of 1,4-bis(2-amino-ethylamino)anthraquinone-amino acid conjugates[J]. Bioorganic & Medicinal Chemistry, 2008, 16(2):1006-1014.
[9]刘红兵, 崔承彬, 任虹, 等. 天然来源萘醌及其人工衍生物抗癌剂的研究进展[J]. 天然产物研究与开发, 2005, 17(1):104-107.
[10]Galetta D S L, Markowitz C. US FDA-Approved Disease-Modifying Treatments for Multiple Sclerosis[J]. CNS Drugs, 2005, 19(3): 239-252.
[11]Lown J W. Anthracycline and anthraquinone anticancer agents: Current status and recent developments[J]. Pharmacology and Therapeutics, 1993, 60(2):185-214.
[12]谭琪明, 胡丹. 异鼠李素抗癌活性研究[J]. 当代化工, 2016, 45(04): 687-689.
[13]Yao C, Tian J, Wang H, et al. Loading-free supramolecular organic framework drug delivery systems(sof-DDSs)for doxorubicin:normal plasm and multidrug resistant cancer cell-adaptive delivery and release[J]. Chinese Chemical Letters, 2017, 28(4):893-899.
[14]Oku H, Kato T, Ishiguro K. Antipruritic effects of 1,4-naphtho- quinones and related compounds.[J]. Biological & Pharmaceutical Bulletin, 2002, 25(1):137-139.
[15]谢冰芬, 冯公侃, 黄河, 等. 新合成的紫草萘醌类衍生物TEISHNZ的细胞毒作用和诱导人鼻咽癌细胞凋亡[J]. 中草药, 2006, 37(2):234-238.
