阿卡斑病毒qRT-PCR检测方法的建立及应用
2020-08-25孟锦昕李楠何于雯王静林
孟锦昕,李楠,何于雯,王静林
(云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
阿卡斑病毒(Akabane virus,AKAV)属布尼亚病毒科(Bunyaviridae)正布尼亚病毒属(Orthobunyavirus)辛波(Simbu)病毒血清群中的一个亚群,为单股负链分节段RNA病毒[1,2]。AKAV引起的赤羽病是造成牛、羊等动物流产、早产、死胎、畸形胎、木乃伊胎的一种虫媒传染病,对我国养牛业和养羊业危害较大,一旦暴发流行将会给畜牧业造成严重的经济损失[3]。
目前,已有很多AKAV诊断方法的研究报道,如病原学检查的电镜法[4];抗体筛查的微量血清中和试验方法[5]、ELISA方法[6,7]、胶体金免疫层析试纸条[8];核酸检测的RT-PCR方法[9]、套式RT-PCR方法[10]、SYBR Green I 实时荧光 PCR 方法[11]、环介导等温扩增(LAMP)检测方法[12]。这些方法为AKAV的检测搭建了重要平台,但随着分子生物学技术的发展,核酸检测方法必将成为病毒检测的一个重要发展方向,而实时荧光定量PCR(qRT-PCR)以其快速、敏感、高通量等优势已大量应用于疫病的检测中。已有报道以色列针对辛波血清群S片段建立了可以检测AKAV的real-time RT-PCR方法,但没有针对云南省流行的地方毒株的检测方法。本研究的目的是建立AKAV的 qRT-PCR 检测方法,为AKAV的检测提供新的技术手段。
1 材料与方法
1.1 主要试剂及毒株信息
病毒RNA提取试剂盒购自天根生化科技(北京)有限公司、One Step PrimeScriptTM RT-PCR Kit(Perfect Real Time)购自TaKaRa公司。AKAV毒株分离自师宗县库蠓,编号55,经全基因序列测定和病毒中和试验鉴定,毒株保存于本实验室-80 ℃液氮冰箱。蓝舌病病毒(Bluetongue virus,BTV)、辛德毕斯病毒(Sindbis virus,SINV)、Cat Que 病毒(Cat Que virus,CQV)、皮通病毒(Peaton virus,PEAV)由本实验室保存。
1.2 引物、探针的设计与合成
对云南省流行AKAV毒株的S片段序列进行分析,设计引物和探针,探针其5′端标记荧光报告基团,3′端标记非荧光淬灭基团。所设计的引物和探针既要保证特异性和高效性,又要避免与其他辛波血清群病毒的交叉反应。引物和探针由生工生物工程(上海)股份有限公司合成。
AKAV-S-F:GCAGGGTATGTGGCATTTATC
AKAV-S-R:AGATCGACACTTGGTTGTGGC
AKAV-S-P:5′FAM-TTCCTCAACCAGAAGAAGGCCAAGAT-TAMRA3′
1.3 病毒标准品的制备
取编号为55的AKAV毒株在金黄地鼠肾细胞(Baby hamster kidney cell,BHK-21)上复壮,待80%细胞出现细胞病变(Cytopathic effect,CPE)时收毒,将细胞-80 ℃冻融2次,3 000 r/min离心20 min,上清液每管0.5 mL分装,-80 ℃保存备用。
取一管病毒液冰上化冻后在96孔板上作10-1~10-8稀释,每个稀释度作8孔,每孔病毒悬液为100 μL,加入BHK-21细胞悬液100 μL(1×106个细胞/mL),每块板设8孔细胞对照。置37 ℃ 5% CO2培养箱培养,从72~168 h逐日观察记录CPE。用Karber方法计算细胞半数感染量(TCID50)。用细胞生长液稀释成100 TCID50/50 μL的病毒工作液作为病毒标准品。
1.4 反应条件的优化
提取病毒标准品的RNA,使用本试验设计的引物和探针进行扩增,确定最佳退火温度。扩增体系:2×One Step RT-PCR Buffer Ⅲ 10 μL,TaKaRa Ex Taq HS 0.4 μL,PrimeScript RT Enzyme Mix Ⅱ 0.4 μL,Rox Reference Dye Ⅱ 0.4 μL,Rnase-free ddH2O 0.4 μL,引物和探针各0.4 μL,加入RNA 2 μL,共20 μL。扩增程序:42 ℃反转录5 min,95 ℃预变性10 s,95 ℃变性5 s、退火(56 ℃、58 ℃、60 ℃、62 ℃)34 s,45个循环。
1.5 标准曲线的绘制
将病毒标准品做10 倍梯度稀释,稀释浓度为100~10-7,共8个稀释度,用病毒RNA提取试剂盒分别提取RNA,用优化的qRT-PCR方法进行检测,通过收集的荧光曲线判定Ct值,绘制标准曲线,获得回归方程。
1.6 灵敏度与特异性试验
灵敏度试验:提取稀释浓度为100~10-10的病毒标准品RNA,共11个稀释度,采用优化后的扩增程序进行扩增,确定AKAV qRT-PCR 检测方法可以检测到的病毒标准品最低稀释度,验证其灵敏度。
特异性试验:选择布尼亚病毒属辛波血清群的CQV和PEAV、甲病毒属的SINV、呼肠孤病毒科环状病毒属的BTV,提取这些病毒的RNA,同样的方法提取病毒标准品RNA,同时进行AKAV qRT-PCR检测,检验其特异性。
1.7 不同分离毒株及田间样本检测
应用建立的AKAV qRT-PCR方法检测2013年、2014年从师宗县采集的库蠓、黄牛血液、山羊血液中分离到的5株AKAV;检测2014年师宗县采集的黄牛血液样品280份和山羊血液样品140份。
2 结果
2.1 病毒标准品
编号55的AKAV样品的TCID50效价为10-4.25,将分装的病毒液做177.83倍稀释后,得到含量为100 TCID50/50 μL的病毒标准品。
2.2 退火温度的优化
将AKAV qRT-PCR退火温度分别设置为56 ℃、58 ℃、60 ℃、62 ℃,在60 ℃退火时,扩增曲线最好,扩增Ct值最低,因此,确定AKAV qRT-PCR检测方法最佳退火温度为60℃。
2.3 标准曲线的绘制
分别提取稀释浓度为100~10-7的标准对照病毒液RNA,共8个稀释度,编号1-8,进行AKAV qRT-PCR检测,建立标准曲线。以稀释度编号为x轴,以Ct 值为y轴进行回归曲线的绘制,得到AKAV qRT-PCR检测的标准曲线。相关系数(R2)为0.9976,回归方程为y=3.6488x+7.5179(图1)。说明所建立的AKAV qRT-PCR检测方法具有良好的线性关系。
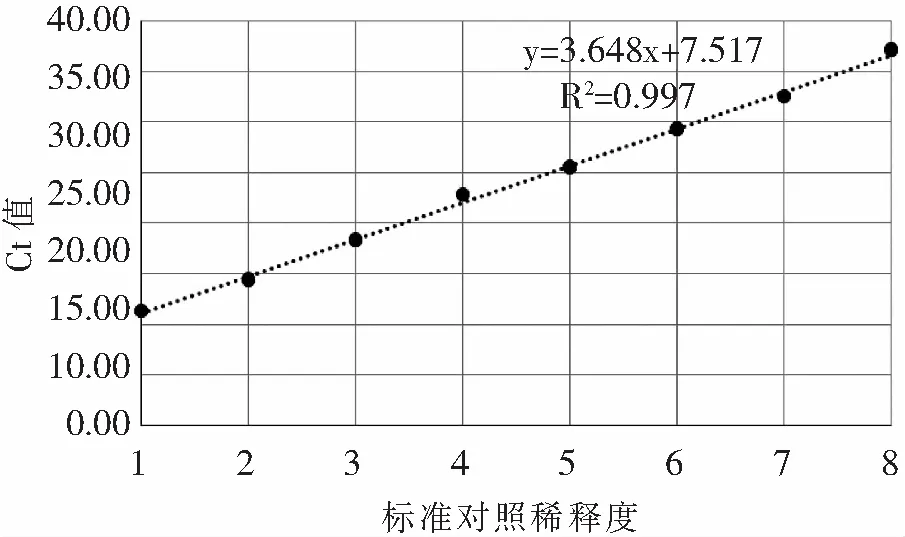
图1 AKAV qRT-PCR的标准曲线
2.4 灵敏度与特异性
AKAV qRT-PCR方法能检测到10-8倍稀释的病毒标准品,表明该方法具有良好的检测灵敏度(图2)。以CQV、PEAV、SINV、BTV的病毒RNA为模板,和AKAV标准品RNA同时进行AKAV qRT-PCR检测,结果显示对CQV、PEAV、SINV、BTV的核酸检测结果均为阴性,表明该方法具有一定的特异性(图3)。
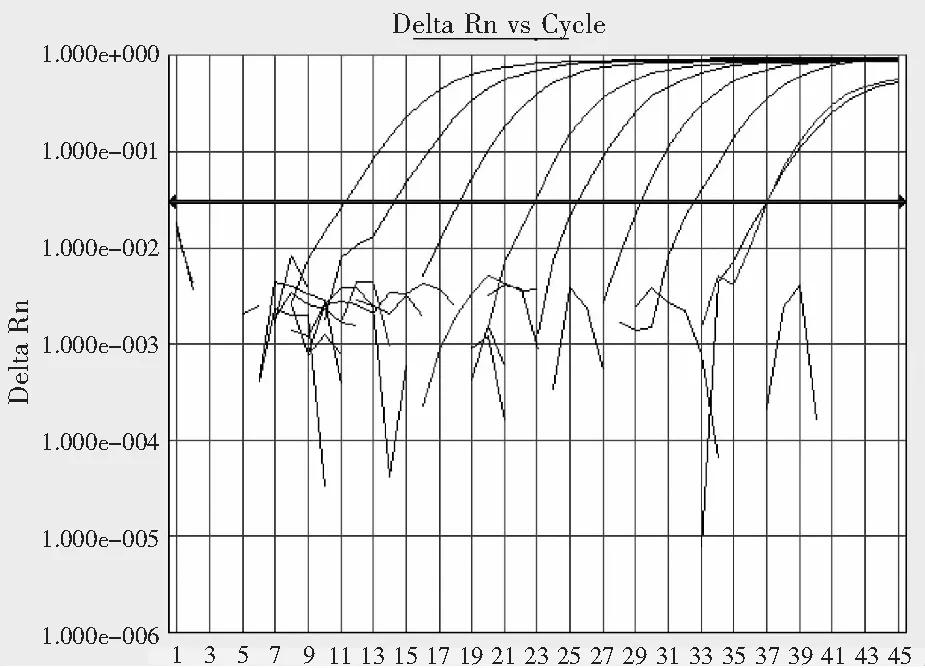
注:从左至右依次代表稀释浓度为100-10-8的病毒标准品曲线,1-45代表循环数。
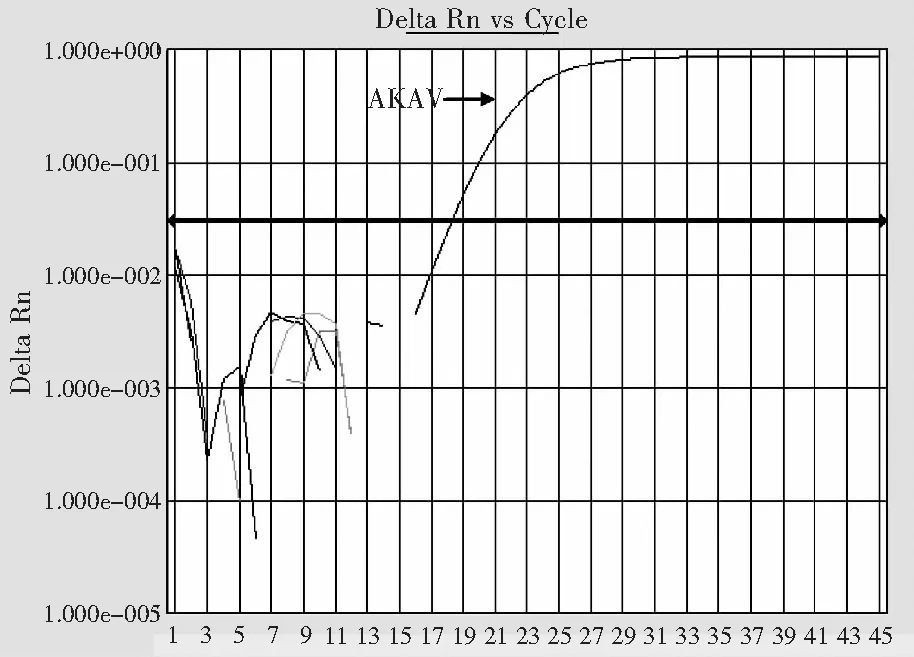
注:1-45代表循环数。
2.5 分离毒株与田间样本的检测结果
对云南省师宗县不同来源分离到的5株AKAV毒株进行qRT-PCR 的检测结果显示,建立的AKAV qRT-PCR 检测方法对细胞分离毒株检测的Ct 值在11.40~13.49(表1)。通过对2014年师宗县采集的420份肝素抗凝血进行AKAV qRT-PCR检测,仅有5月20日的5号黄牛编号为09312的血样为AKAV核酸阳性,Ct值为30(图4),且编号为09312的血样与病毒分离结果一致。

表1 AKAV分离毒株的信息及病毒核酸qRT-PCR 检测结果

注:P.阳性对照;N.阴性对照;1-45.循环数。
3 讨论
阿卡斑在我国被列为二类传染病,也是从国外进口牛、羊必检的七种疫病之一。我国阿卡斑流行病学调查和病毒分离证实,AKAV在我国广泛存在且流行严重。据报道,2013—2016年AKAV引起广西30%的竹鼠发病,死亡率高达100%[13],2018年AKAV引起上海市某奶牛场20头母牛发生流产、早产、死胎[14],越来越多的AKAV分离和流行病例报道让我们不能忽视AKAV。建立云南省流行AKAV毒株的快速检测技术,对云南省AKAV的疫病诊断及防控具有重要意义。
目前建立的AKAV核酸检测技术大多都要经核酸的提取与纯化、PCR 反应或套式PCR反应、电泳、酶切、测序等才能得到检测结果,人为操作步骤多,费时费力,易污染和产生误差。因此,本研究选择云南省流行AKAV毒株S片段设计引物和探针,建立了AKAV qRT-PCR检测方法。本方法通过对反应条件的优化,使扩增曲线达到最优;为保证试验更准确合理,本研究对所用云南省地方AKAV毒株进行毒价测定,制备病毒标准品,保证每次试验使用的病毒含量一致,让测定结果更准确合理,从而达到了在分子拷贝水平上的定量;通过梯度稀释病毒标准品,建立标准曲线,线性关系较好;试验结果显示,本研究建立的qRT-PCR 方法最低可检测到10-8倍稀释的病毒标准品,且同属病毒以及其他虫媒病毒核酸均无扩增信号产生,具有良好的灵敏度和特异性。对分离毒株和田间血液样品的检测结果显示,本方法不仅能检测病毒核酸含量高的AKAV分离毒株,也能检测病毒核酸含量较低的血液样本,本方法既是检测病毒早期感染的手段,也是病毒分离的指路灯。
综上,本实验室建立AKAV qRT-PCR方法是一种快速准确、灵敏度高、特异性好的高通量检测方法。此方法对云南省阿卡斑病的早期诊断、批量检测、毒株分离有着重要意义,为云南省口岸检疫提供了一种有效的检测手段。
