高大鹿药喷雾干燥粉制备工艺及抗氧化研究
2020-08-24胡祥阚欢胡海燕赵李宁刘云
胡祥,阚欢,胡海燕,赵李宁,刘云,*
(1.西南林业大学园林园艺学院,云南昆明650224;2.西南林业大学生命科学学院,云南昆明650224;3.云南宁茂环境科技有限公司,云南昆明650100)
高大鹿药(Smilacina atropurpurea)又称竹叶菜,系百合科的一种药食两用多年生草本植物[1],在我国主要分布于海拔2 100米至4 000米的云南西北部、四川东南部及西藏地区[2]。高大鹿药营养物质丰富,富含多种微量元素及人体不能合成的氨基酸[3-4],其幼苗是深受滇西北地区人们喜爱的野生蔬菜,且碳水化合物和脂肪含量很低,可作为减肥产品[2,5-6]。高大鹿药含有丰富的活性物质,主要是甾体皂苷和核苷类抗癌活性成分[7],还具有补肾壮阳、活血祛瘀、祛风止痛的药效[8],是很好的保健食品。
国内外对高大鹿药的研究主要集中在栽培、保鲜、储藏及其根茎中皂苷化合物等方面的研究,在食品开发利用方面的研究鲜有报道。桂明英[2-3]测定了云南省中甸县高大鹿药的营养成分,比较了不同处理方式营养成分的差异。张曦[5]运用对比样方带和线性回归分析了人为干扰是高大鹿药种群特征变化重要因素之一。杨顺丽[9-11]从高大鹿药地上部分甲醇提取物中分离出14个化合物,且总提取物对K562细胞生长有显著的抑制作用。张影[12-14]从高大鹿药地下部分分离出10个甾体皂苷,9个为新化合物,有3个能抑制真菌。赵淑杰[15]从Smilacina japonica中分离出一种新化合物,这种化合物具有抑制人肺腺癌SPC-A-1细胞生长的活性。
喷雾干燥技术在食品中的应用使得许多果蔬的价值得以大大体现[16-17]。近年来,有学者采用喷雾干燥技术制备果蔬粉[18]和提取物速溶粉[19-21],但应用喷雾干燥技术在高大鹿药提取物加工方面的研究还未见报道。本研究以采自云南怒江州的高大鹿药为原料,测定其主要的的营养成分,并通过提取、浓缩、喷雾干燥等工艺,采用单因素及正交试验确定高大鹿药喷雾干燥粉的最优制备工艺条件,并对其进行抗氧化活性分析,为高大鹿药的开发和利用提供科学依据。
1 材料与方法
1.1 材料与试剂
高大鹿药:采自云南省怒江州贡山县。样品45℃烘干粉碎,过60目筛,取筛下样品,4℃密封保存。
维生素C:广东光华科技股份有限公司;DPPH试剂、ABTS+试剂、95%乙醇:天津市致远化学试剂有限公司,以上试剂均为分析纯。
1.2 仪器与设备
超声波清洗器(SG5200HDT):上海冠特超声仪器有限公司;EYELA旋转蒸发仪(N-1001)、冷却水循环装置(CA-1111):日本东京理化器械有限公司;数显电热鼓风干燥箱(DGH-9140A):上海一恒科学仪器有限公司;电子天平(CP224C):上海奥豪斯仪器有限公司;紫外可见分光光度计(UV-2600):岛津仪器(苏州)有限公司;喷雾干燥机(B-290BUCHI):瑞士步琦有限公司。
1.3 高大鹿药营养成分测定及方法
氨基酸含量:参照国标GB/T 5009.124-2016《食品安全国家标准食品中氨基酸的测定》的方法进行测定[22]。矿质元素含量:参照国标NY/T 1653-2008《蔬菜、水果及制品中矿质元素的测定》的方法进行测定[23]。蛋白质含量:GB 5009.5-2010《食品安全国家标准食品中蛋白质的测定》的方法进行测定[24]。水分含量:GB 5009.3-2010《食品安全国家标准食品中水分的测定》的方法进行测定[25]。脂肪含量:GB/T 5009.6-2016《食品安全国家标准食品中脂肪的测定》的方法进行测定[26]。总灰分含量:GB 5009.4-2010《食品安全国家标准食品中灰分的测定》的方法进行测定[27]。
1.4 高大鹿药喷雾干燥粉制备工艺条件优化试验
1.4.1 喷雾干燥粉制备工艺流程及操作要点
1.4.1.1 工艺流程
高大鹿药粉末→超声波提取→收集提取液→浓缩→喷雾干燥→包装
1.4.1.2 操作要点
1)超声波提取:根据前期研究基础,以料水比1 ∶50(g/mL)、超声功率 400 W、超声时间 50 min、超声温度50℃进行提取。
2)浓缩:用旋转蒸发仪浓缩提取液,以可溶性固形物为指标,浓缩至喷雾干燥所需的浓缩液浓度。
3)喷雾干燥:根据前期研究基础,以200 mL浓缩液为基量,出风温度为80℃,β-环糊精作为助干剂添加量7 g/100 mL、浓缩液浓度10%、进风温度220℃和进料速度14 mL/min进行。
1.4.2 单因素试验
以出粉率为评价指标,考察喷雾干燥过程中助干剂的添加量、浓缩液浓度、进料速度和进风温度等对出粉率的影响。
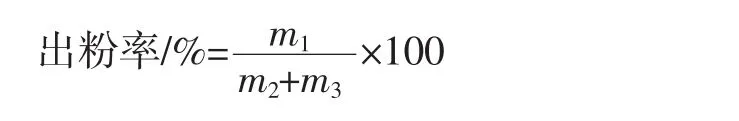
式中:m1为收集到的喷雾干燥粉,g;m2为高大鹿药粉质量,g;m3为助干剂添加量,g。
1.4.2.1 助干剂添加量对出粉率的影响
量取浓度为20%的高大鹿药提取物浓缩液200 mL,设置进样速度为20 mL/min,进风温度220℃,助干剂的添加量依次为 10、12、14、16、18 g,将其充分溶于水后加入浓缩液中,考察助干剂添加量对出粉率的影响。
1.4.2.2 浓缩液浓度对出粉率的影响
设置喷雾干燥机进风温度220℃,进样速度为20 mL/min,助干剂的添加量参照1.4.2.1中的最佳值,200 mL浓缩液浓度依次为5%、10%、15%、20%、25%,考察浓缩液浓度对出粉率的影响。
1.4.2.3 进风温度对出粉率的影响
以1.4.2.1中的助干剂的添加量,1.4.2.2中的最佳浓缩液浓度为基准,量取高大鹿药可溶性物质浓缩液200 mL,进样速度设置为20 mL/min,设置进风温度依次为 160、180、200、220、240 ℃,考察进风温度对出粉率的影响。
1.4.2.4 进样速度对出粉率的影响
以上述中最佳助干剂的添加量、浓缩液浓度以及进风温度,设置进样速度为 10、15、20、25、30 mL/min,考察进样速度对出粉率的影响。
1.4.3 正交试验
根据单因素试验所得到的结果,选择助干剂的添加量、浓缩液浓度、进风温度、进料速度4个因素,采用L9(34)设计正交试验。根据正交试验得到的数据,确定高大鹿药喷雾干燥粉制备的最佳工艺条件。
各因素的水平值如表1。

表1 正交试验因素水平表Table 1 Orthogonal test factor level table
1.4.4 验证试验
正交试验得到的最佳因素组合,应通过验证试验来进一步验证所得到的工艺参数是否可靠。进行3次重复试验,将重复试验的结果与正交试验得到的结果进行比较,直观地分析出工艺条件的可靠性。
1.5 高大鹿药喷雾干燥粉抗氧化活性分析
1.5.1 DPPH自由基清除试验
将样品溶液稀释到目标浓度梯度以后,精确吸取2 mL不同浓度的样品溶液加至具塞刻度试管中,再加入2 mL DPPH溶液,摇匀,于37℃水浴保温反应30 min后取出,在517 nm处测其吸光度值AS,空白组用蒸馏水替换样品,并在517 nm处测其吸光度值AC。配置和样品溶液相同浓度的维生素C溶液,重复上述试验并记录[28-29]。
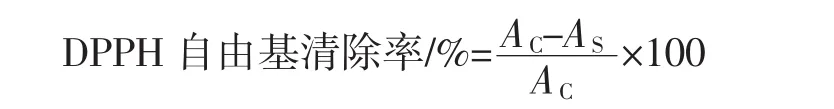
1.5.2 羟基自由基的清除试验
将样品溶液稀释至目标浓度梯度后,向具塞刻度试管中依次加入9 mmol/L水杨酸1 mL,0.75 mmol/L硫酸亚铁溶液1 mL,不同目标浓度样品溶液1 mL,0.01%H2O2溶液1 mL以及4 mL的蒸馏水,总反应体系的体积为8 mL,避光反应37℃反应30 min后取出用紫外分光光度计在510 nm处测量并记录吸光度值为AX,以无水乙醇代替样品液作空白,等量无水乙醇替代水杨酸-乙醇溶液作对照,在510 nm处分别测量吸光值A0和Ax0。配置和样品溶液相同浓度的维生素C溶液,重复上述试验并记录[28,30]。

1.5.3 ABTS+自由基清除试验
将样品溶液稀释至目标浓度梯度,去0.1 mL样品稀释液与3.9 mL ABTS+工作液避光反应7 min后,用70%乙醇空白对照,用紫外分光光度计测定734 nm处吸光度值为Ax,用蒸馏水代替样品,测得的吸光度值为A0,调零组为70%的乙醇。配置和样品溶液相同浓度的维生素C溶液重复上述试验并记录[28,31]。
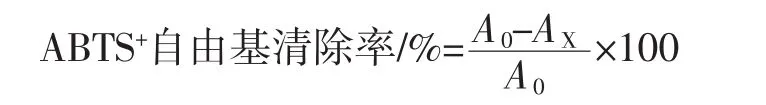
1.6 数据处理
成分分析所得试验数据均有测定设备自带软件自动输出,正交试验设计及结果分析采用latin正交软件助手处理,所用图表的绘制均采用office2016软件进行处理。
2 结果与分析
2.1 高大鹿药主要营养成分
2.1.1 氨基酸的组成测定
高大鹿药氨基酸含量见表2。

表2 高大鹿药氨基酸含量Table 2 Amino acid contents of Smilacina atropurpurea
2.1.2 矿质元素的含量测定
高大鹿药矿质元素含量见表3。
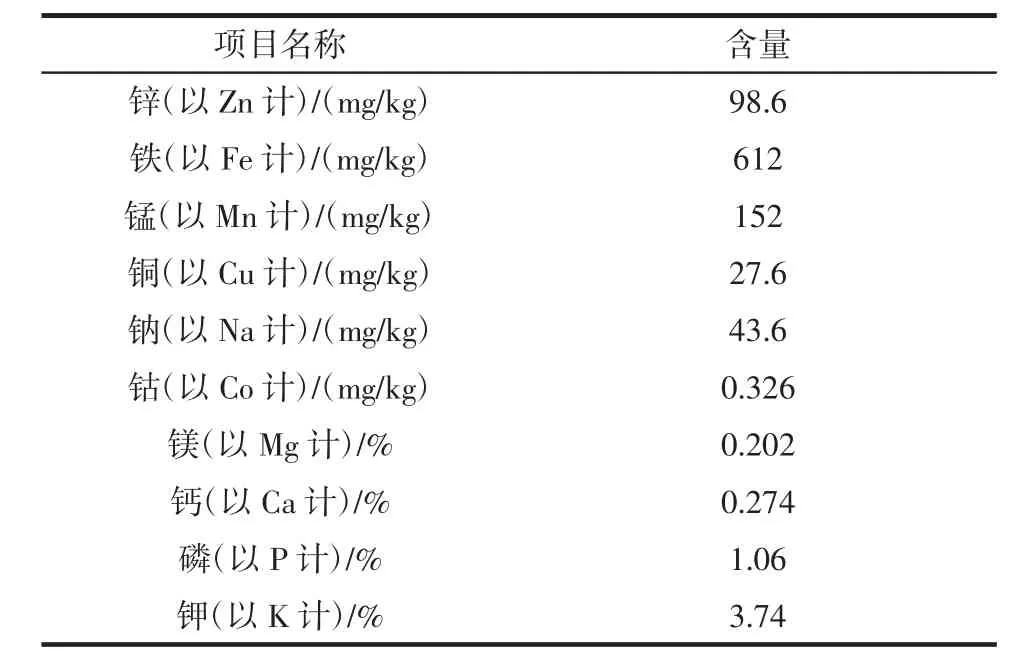
表3 高大鹿药矿质元素含量Table 3 Mineral element content of Smilacina atropurpurea
2.1.3 其他成分的含量测定
高大鹿药其他营养成分含量见表4。

表4 高大鹿药其他营养成分含量Table 4 The major nutritional components of Smilacina atropurpurea
由表2、3、4可知,高大鹿药营养物质丰富,已检测的氨基酸总量14.99%,含有20种氨基酸的17种,必需氨基酸有7种。矿物质元素含量也比较可观,K高Na低,很适合高血压人群,微量元素Fe、Mn、Zn含量较高。干品中蛋白质有42.10%、总碳水化合物42.79%,具有很大开发价值。
2.2 高大鹿药喷雾干燥粉制备工艺条件优化试验
2.2.1 单因素试验
2.2.1.1 助干剂添加量对出粉率的影响
助干剂添加量对出粉率的影响见图1。
由图1可知,随着助干剂添加量的增加,高大鹿药的出粉率呈现出先上升后下降的趋势,在助干剂添加量为14 g时达最大值27.93%,在此之后随着助干剂添加量的增加出粉率反而下降,很可能是适当的添加量可以提高出粉率,但当添加量过多时,浓缩液黏度发生变化,从而影响了喷雾干燥效果,所以选择12、14、16 g进行正交优化试验。
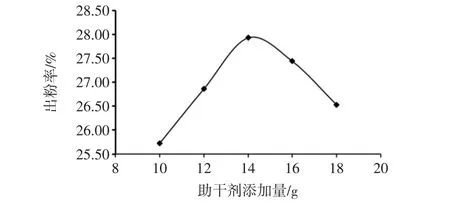
图1 助干剂添加量对出粉率的影响Fig.1 The influence of the amount of dry aid on the output of powder
2.2.1.2 浓缩液浓度对出粉率的影响
浓缩液浓度对出粉率的影响见图2。

图2 浓缩液浓度对出粉率的影响Fig.2 The influence of material concentration on the output of powder
由图2可知,在浓缩液浓度小于10%时,随着浓缩液浓度的增加,出粉率也增加,可能是因为此时含水量比较高,可溶性固形物浓度比较低;在浓缩液浓度大于10%时呈现下降的趋势,此时可溶性固形物较高,含水量低,可能会出现粘璧,减缓进料速度,从而导致出粉率下降的情况;在浓缩液浓度为10%时,出粉率达到最大值28.8%。综合考虑,选取5%、10%、15%的浓缩液浓度进行正交优化试验。
2.2.1.3 进风温度对出粉率的影响
进风温度对出粉率的影响见图3。
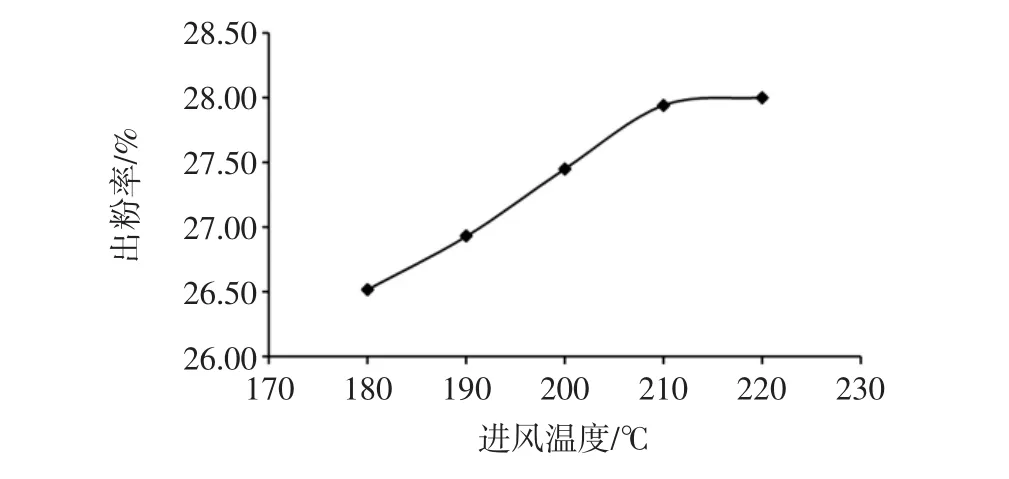
图3 进风温度对出粉率的影响Fig.3 The influence of inlet air temperature on the output of powder
由图3可知,随着进风温度的增加,出粉率呈现出大幅度的上升趋势并且还有继续上升的可能,但在温度为220℃时,出粉率的变化逐渐变小,继续升高温度,出粉率可能会出现下降趋势。可能是温度低时,水分尚未蒸发,粘璧现象较为严重,而温度较高时,里面的糖分融化,粉末相互黏结,甚至粘璧,所以出粉率低。考率到生产成本,高温对设备损耗和喷雾干燥粉品质等问题,遂选取200、210、220℃进行正交优化试验。
2.2.1.4 进料速度对出粉率的影响
进料速度对出粉率的影响见图4。
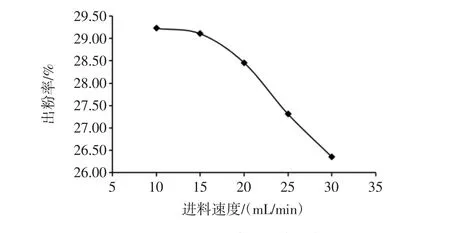
图4 进料速度对出粉率的影响Fig.4 The influence of feed speed on the output of powder
由图4可知,从出粉率的变动趋势来看,随着进料速度的增加,出粉率一直在减小且减小幅度一直在不断增大,可能是进料速度加快时受热不均匀,水分挥发不彻底,出现粘璧现象;进料速度在10 mL/min时出粉率达最大值,如果继续降低进料速度,出粉率还有增大的趋势,但增幅减小。考虑到生产成本,为了节省时间,加快生产进程,遂选取10、15、20 mL/min进行正交优化试验。
2.2.2 正交试验
高大鹿药喷雾干燥出粉率的正交试验结果见表5。

续表5 高大鹿药喷雾干燥出粉率的正交试验结果Continue table 5 Orthogonal test results of spray drying rate of Smilacina atropurpurea
对不同试验组合的综合评价结果进行极差分析,结果表明:各因素对高大鹿药提取物出粉率的影响的主次顺序为:A>C>B>D,最佳配方组合为 A1B2C3D1,即依次加入12 g的助干剂,10%的可溶性物质浓缩液,设置进风温度为220℃,进料速度为10 mL/min对高大鹿药提取物进行喷雾干燥。
2.2.3 验证试验
依据正交试验进行验证试验,按最佳配方组合为:A1B2C3D1,进行3次平行试验,出粉率为29.87%,符合正交试验试验结果,可得出L9(34)正交法得到的高大鹿药喷雾干燥粉出粉率的工艺参数具有客观实用价值。
2.3 高大鹿药喷雾干燥粉抗氧化活性分析
2.3.1 DPPH自由基清除能力测定
喷雾干燥粉与VC对DPPH自由基清除效果见图5。
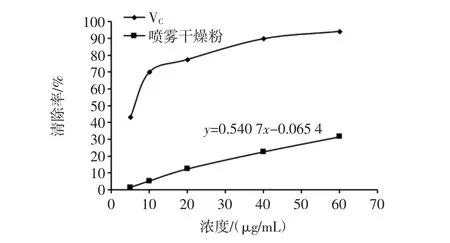
图5 喷雾干燥粉与VC对DPPH自由基清除效果Fig.5 The DPPH free radical scavenging effect of spray drying powder and VC
由图5中可以看出,样品对DPPH自由基的清除效果不如VC,但是考虑到VC的纯度和样品中杂质较多,故高大鹿药喷雾干燥粉的抗氧化性效果良好,从图中可以看出DPPH自由基的清除能力随着高大鹿药喷雾干燥粉溶液的质量浓度增加而增加,高大鹿药喷雾干燥粉对DPPH自由基清除率的IC50根据公式计算可得到为 92.594 μg/mL。
2.3.2 羟基自由基清除能力测定
喷雾干燥粉与VC对羟基自由基清除效果见图6。

图6 喷雾干燥粉与VC对羟基自由基清除效果Fig.6 The hydroxyl free radical scavenging effect of spray drying powder and VC
由图6可以看出,高大鹿药喷雾干燥粉清除羟基自由基的能力随着浓度的增加而逐渐增强,但低于同浓度的VC,在检测浓度区间高大鹿药喷雾干燥粉对羟基自由基清除效果上升明显,根据公式高大鹿药喷雾干燥粉对羟基自由基的IC50值为25.85 μg/mL。
2.3.3 ABTS+自由基清除能力测定
喷雾干燥粉与VC对ABTS+自由基清除效果见图7。
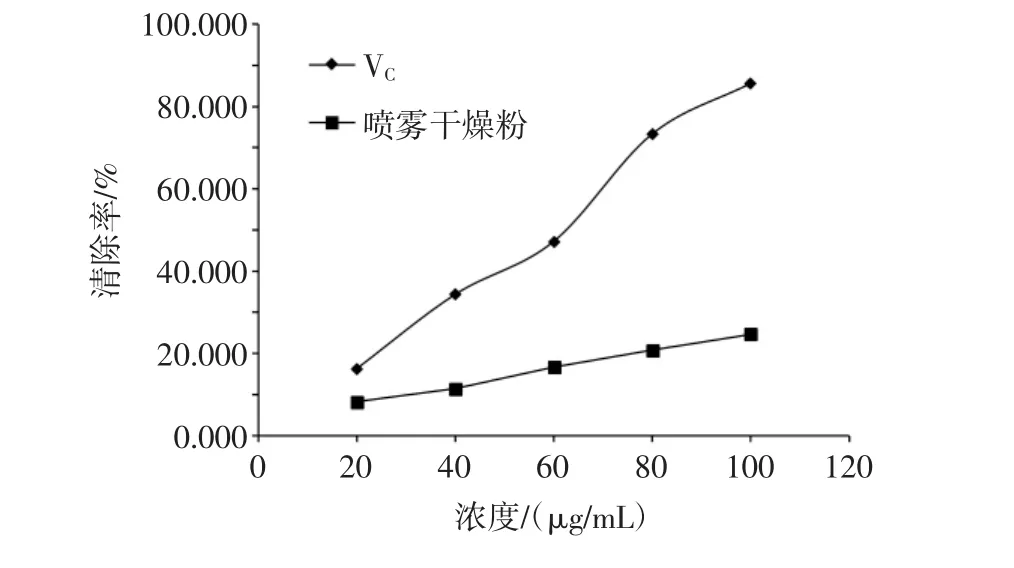
图7 喷雾干燥粉与VC对ABTS+自由基清除效果Fig.7 The ABTS+free radical scavenging effect of spray drying powder and VC
由图7可以看出,VC与高大鹿药喷雾干燥粉对ABTS+自由基的清除率都随着物质浓度的增加而增加,而且呈现出较为良好的线性关系,同浓度的高大鹿药喷雾干燥粉清除率低于VC,高大鹿药喷雾干燥粉对ABTS+自由基清除效果明显,高大鹿药喷雾干燥粉对ABTS+自由基清除率的IC50值为219.27 μg/mL。
3 结论
本试验对高大鹿药营养成分进行测定和喷雾干燥粉最佳制备工艺条件进行探讨,可为后续继续深入研究高大鹿药的深度开发利用提供一定的研究基础。高大鹿药营养物质丰富,干燥茎叶中蛋白质为42.1%,碳水化合物为42.79%,氨基酸和矿质元素含量丰富,K高Na低。高大鹿药营养成分中氨基酸的种类有17种,与桂明英[2,3]孙玉敏[4]所测一样,各营养成分间的含量略有偏差,造成这样的原因可能是和材料的采集地点、时期、部位及检测方法有关。
通过正交试验确定了喷雾干燥最优工艺为:助干剂的添加量7 g/100 mL、浓缩液浓度10%、进风温度220℃以及进料速度14 mL/min,在此条件下出粉率达29.87%。本研究的出粉率较低,分析可知喷雾干燥过程中β-环糊精添加量是影响出粉率的主要因素。β-环糊精添加量过低,粘壁现象严重,添加量过多,最终产品纯度太低;粘璧现象严重也是致使出粉率低的原因。对其喷雾干燥粉进行抗氧化活性分析,对DPPH自由基、羟基自由基及ABTS+自由基均表现出清除作用,但低于VC,可能是喷雾干燥粉中的活性成分略低。Kha T C[32]和赵玉丹[33]分别对苦瓜和马甲子喷雾干燥粉进行抗氧化研究,发现在一定浓度范围内对DPPH自由基的清除能力有明显的量效关系;丁玉松[34]对不同干燥方式葡萄籽提取物抗氧化性进行研究结果表明喷雾干燥的抗氧化性略高于自然干燥。本研究尚未对喷雾干燥粉的品质特征和溶解性进行研究,其中的活性成分后期也会深入探索。
