常温下黑曲霉对刺伤红提葡萄的致病规律研究及拮抗菌筛选
2020-08-24李丽梅刘霞李喜宏杨鸿远赵亚婷
李丽梅,刘霞,李喜宏,杨鸿远,赵亚婷
(1.天津科技大学食品工程与生物技术学院,天津300457;2.长融汇通(天津)食品科技研发有限公司,天津 300457)
霉菌侵染是引起生鲜葡萄采后霉变腐烂的主要原因。我国每年因此而导致的葡萄等大宗果蔬损失占其总产量的30%~40%左右[1],尤其在常温、亚常温的运输和销售过程中,挤压及机械伤口极易引起黑曲霉(Aspergillus niger)的大范围的感染,即黑粉病,导致果蔬失去其食用价值和商品价值。
近年来,国内外研究更多地利用生物防治的方法来对葡萄等大宗果蔬进行保鲜,致力于筛选非致病微生物抑制某些致病致腐霉菌的生长和繁殖。范青等[2]研究发现季也蒙假丝酵母能够抑制成熟的桃果实的软腐病,成熟的桃果实用酵母菌细胞悬浮液处理后,在25℃条件下储藏4 d,其软腐病的发病率为零。Lucia Parafati等[3]研究证明酿酒酵母对葡萄采后灰霉病具有较好的防治作用。秦丹[4]筛选到一株季也蒙毕赤氏酵母对葡萄果实采后灰霉葡萄孢病害具有拮抗作用,并研制出拮抗酵母的生防制剂。
本试验以红提葡萄为试材,以黑曲霉为模式菌株,模拟常温销售过程中不同方式的机械伤及黑曲霉侵染方式对葡萄造成的病害程度,通过离体和活体双重试验,研究不同拮抗菌对黑曲霉采后病害及生物防治的效果。
1 材料与方法
1.1 试验材料
红提葡萄:天津市经济技术开发区金元宝批发市场;拮抗菌株:天津科技大学食品科学与工程学院321实验室自行分离于葡萄等果蔬表面,并保藏于-80℃条件下;黑曲霉:天津科技大学食品科学与工程学院321实验室自行分离于葡萄表面,并保藏于-80℃条件下。
1.2 培养基
马铃薯葡萄糖(potato dextrost agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL,121℃灭菌20 min。
营养酵母葡萄糖肉汤(nutrient yeast dextrost broth,NYDB)培养基:营养肉汤8 g,酵母浸膏5 g,葡萄糖10 g,蒸馏水 1 000 mL,121℃灭菌 20 min。
1.3 试验仪器与设备
LB-BC58F高压蒸汽灭菌锅:上海三申医疗器械有限公司;CBV-1500A无菌实验台:上海瑞仰净化装备有限公司;5804(R)冷冻离心机:德国 Eppendorf公司;JJ-1000精密型电子天平:常熟双杰测试仪器厂;BMJ-250C霉菌培养箱:上海博迅实业有限公司医疗设备厂。
1.4 试验方法
1.4.1 黑曲霉的致病曲线研究
设置1 mm~2 mm、2 mm~3 mm、3 mm~4 mm 3个伤口刺破直径,104、105、106spores/mL 3 个致病菌浓度,采用活体接种致病菌的方式模拟常温销售过程中的可能机械伤害[5],通过定期测定病斑直径确定最适的活体试验接种参数。
1.4.2 拮抗菌对黑曲霉的生防效果研究
拮抗菌菌悬液的制备[6]:将分离的酵母菌接种于盛有40 mL营养酵母葡萄糖肉汤(NYDB)液体培养基的100 mL三角瓶中,于28℃、200 r/min振荡培养36 h~48 h,5 000 r/min离心10 min,收集酵母菌体细胞,用0.9%的无菌生理盐水重新悬浮,血球计数器计数,用分光光度计配成浓度1.0×108CFU/mL~1.2×108CFU/mL的菌体悬浮液备用。
病原菌孢子的制备:病原菌于28℃下PDA平板培养4 d~6 d至孢子大量产生后,用0.9%无菌生理盐水洗下病原菌孢子,血球计数板计数,调节孢子浓度为 1×104spores/mL~1.2×104spores/mL,备用。
1.4.3 拮抗菌的生防效果离体试验
采用滤纸片法测定拮抗菌对优势致病菌的离体拮抗效果。用移液枪吸取100 μL病原菌孢子悬浮液于平板上,并用涂布棒涂布均匀。在培养基上放置直径为5.0 mm的滤纸片,用移液枪吸取10 μL的拮抗菌菌悬液于滤纸片上,每个平板放2个滤纸片,于28℃培养3 d~4 d后,采用十字交叉法用游标卡尺测量滤纸片周围抑菌圈直径[7]。
1.4.4 拮抗菌的生防效果活体试验
葡萄果实的处理[8]:挑选大小、成熟度一致的果粒,用剪刀将葡萄果粒从叶茎上剪下,防止葡萄果粒干枯,每个葡萄果粒上留有5 mm的果梗[9]。将葡萄果粒浸入无菌的2%次氯酸钠溶液中2 min,然后用无菌水冲洗,在无菌操作台中晾干。
活体筛选:待葡萄果粒表面无水分残留时,用无菌牙签刺破果实胴部人为造成伤口[10],伤口直径3 mm~4 mm,深5 mm,每一伤口加入10 μL酵母菌培养液(108cfu/mL),2 h后,加入10 μL病原菌孢子悬浮液(104spores/mL),室温(25℃)下放置 1 h,待果实风干至伤口边缘无流动菌液后置于无菌培养皿盖中,用保鲜膜进行密封,以30℃/93%湿度恒温保湿培养,5 d~7 d后测量伤口病斑大小和腐烂率,对照组加入无菌水和对应的病原菌孢子悬浮液,每个处理6个平行。

1.5 数据处理
试验所得数据利用Excel 2016软件进行计算平均值和偏差,Origin pro 8.0进行作图。
2 结果与分析
2.1 不同刺伤直径对黑曲霉发病的影响
不同接种浓度对刺破伤口1 mm~2 mm时病斑直径的影响见图1。
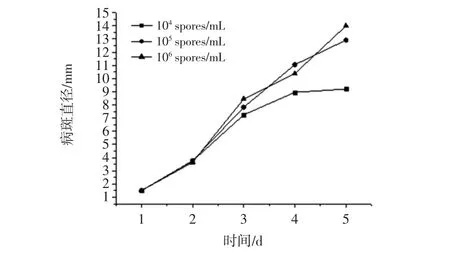
图1 不同接种浓度对刺破伤口1 mm~2 mm病斑直径的影响Fig.1 Effects of different inoculation concentrations on lesion diameter of wound 1 mm-2 mm
葡萄常温物流过程中尤其在果梗基部或是受机械伤害后极易受到黑曲霉快速接触侵染[11],引起黑粉病,导致葡萄组织非水渍状腐烂、褐变。由图1可知,伤口刺破直径为1 mm~2 mm时,在接种2 d后,黑曲霉发病的病斑直径变化较快,均呈现较好的线性关系。随着接种浓度的增大,病斑直径也呈线性增加,接种病原孢子浓度为106spores/mL时,病斑直径在第5天最大,平均值为13.99 mm,与接种病原孢子浓度为105spores/mL处理组的病斑直径无显著性差异。
不同接种浓度对刺破伤口2 mm~3 mm时病斑直径的影响见图2。
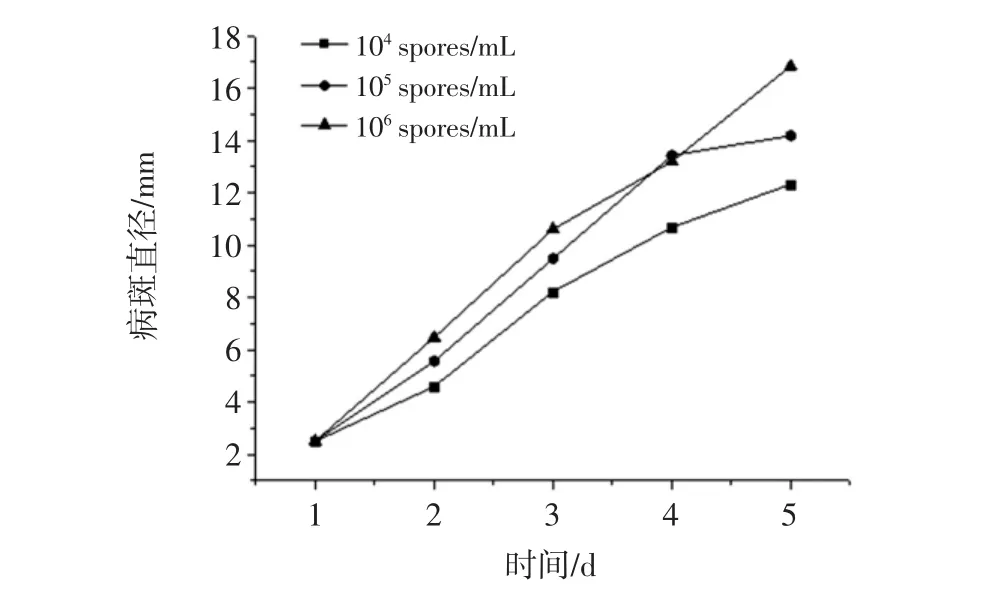
图2 不同接种浓度对刺破伤口2 mm~3 mm病斑直径的影响Fig.2 Effects of different inoculation concentrations on lesion diameter of wound 2 mm-3 mm
由图2可知,伤口刺破直径为2 mm~3 mm时,1 d就呈现明显的发病症状,此后发病3个接种浓度的病斑直径变化较一致,第5天时,病原孢子浓度106spores/mL时病斑直径较其他两组稍大,其平均病斑大小为16.85 mm。
不同接种浓度对刺破伤口3 mm~4 mm时病斑直径的影响见图3。

图3 不同接种浓度对刺破伤口3 mm~4 mm病斑直径的影响Fig.3 Effects of different inoculation concentrations on lesion diameter of wound 3 mm-4 mm
图3结果表明,当伤口直径3 mm~4 mm时,在接种量相同,接种浓度为105spores/mL时,5 d后病斑直径最大,可能的原因是伤口内表面面积与病原菌孢子液接触面有差异,伤口直径较前两个伤口直径大,孢子液没有完全覆盖伤口,导致表面病斑直径较小。比较图1、图2和图3,病原孢子液浓度与伤口直径均会影响到病斑直径,接种浓度为105spores/mL、伤口直径为3 mm~4 mm时,病斑变化最大并且在5 d后病斑直径最大,病斑平均大小为20.30 mm。
2.2 拮抗菌的离体抑菌效果
在前期拮抗菌筛选中,拮抗酵母筛选方法参照李莉[10]的方法,得到了5株酵母,将其编号为YT-1、YT-2、YT-3、YT-4、YT-5。拮抗菌 YT-2 对黑曲霉的离体拮抗效果见图4,5株拮抗菌对黑曲霉的离体拮抗效果见表1。

图4 拮抗菌YT-2对黑曲霉的离体拮抗效果Fig.4 Antagonistic effect of antagonistic bacterium YT-2 on Aspergillus niger in vitro
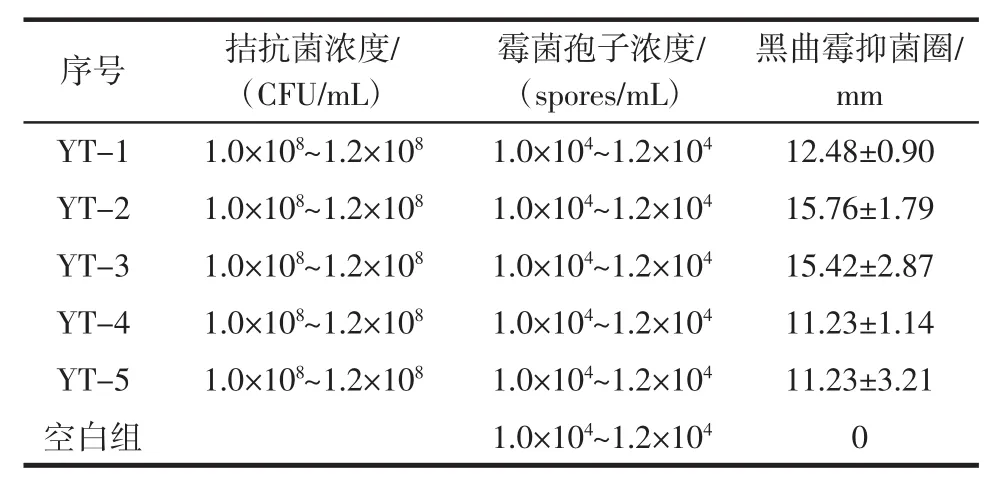
表1 5株拮抗菌对黑曲霉的离体拮抗效果Table 1 Antagonistic effect of five antagonistic bacteria against Aspergillus niger in vitro
由表1的抑菌圈结果可知,5株酵母对黑曲霉均有不同程度的拮抗效果。对黑曲霉抑菌效果最好的是YT-2,其抑菌直径为(15.76±1.79)mm,其次为 YT-3,抑菌圈直径(15.42±2.87)mm。YT-4和YT-5抑菌效果相对较差,抑菌圈直径仅为(11.23±1.14)mm和(11.23±3.21)mm。从图4可以看出,YT-2拮抗菌的抑菌圈外缘并没有明显的无菌圈,由此可推测拮抗菌的抑菌机理可能为营养与空间竞争或其他,可能拮抗菌并没有在体外分泌抗菌物质[12],拮抗酵母的抑菌效果可结合活体试验综合评价拮抗菌的拮抗效果。
2.3 黑曲霉拮抗菌的活体抑菌效果
通过果实活体接种法,分别将前期分离到的5种拮抗菌与黑曲霉共同接种到果实伤口处。拮抗菌YT-2对黑曲霉的活体拮抗效果见图5,5株拮抗菌对黑曲霉的活体拮抗效果见表2。

图5 拮抗菌YT-2对黑曲霉的活体拮抗效果Fig.5 Antagonistic effect of antagonistic bacterium YT-2 on Aspergillus niger in vivo
从表2可以看出,拮抗菌培养后筛选到对黑曲霉有显著抑菌效果的拮抗菌株YT-2,其次为YT-5,接种该菌株的葡萄果粒均没有明显黑粉病症状,但是病斑直径分别为(3.20±0.46)mm 和(5.90±3.22)mm,显著低于对照和其他菌株。从图5中可以看出,接种YT-2菌株的试验组病斑直径比初始伤口直径略大,并且伤口表面比较干燥及周围葡萄果粒组织均较好,无黏稠软烂现象,呈现愈合现象。原因可能是接种拮抗酵母后,拮抗酵母迅速繁殖,同时与病原菌竞争营养与生存空间,快速利用了伤口表面的营养物质并占据生存空间,导致病原菌失去营养物质和生存空间,无法生长繁殖以及产生有毒物质,从而在宏观上抑制了病害的发生[13]。此外,可能是拮抗酵母在葡萄果实或者果实伤口的生长与繁殖能够诱导果实自身抗性酶增加或者抗性酶活性增强,从而发挥拮抗作用[14],YT-2与YT-3在离体筛选中也表现较强的抑菌效果,活体条件下,YT-2对黑曲霉抑制率为100%。
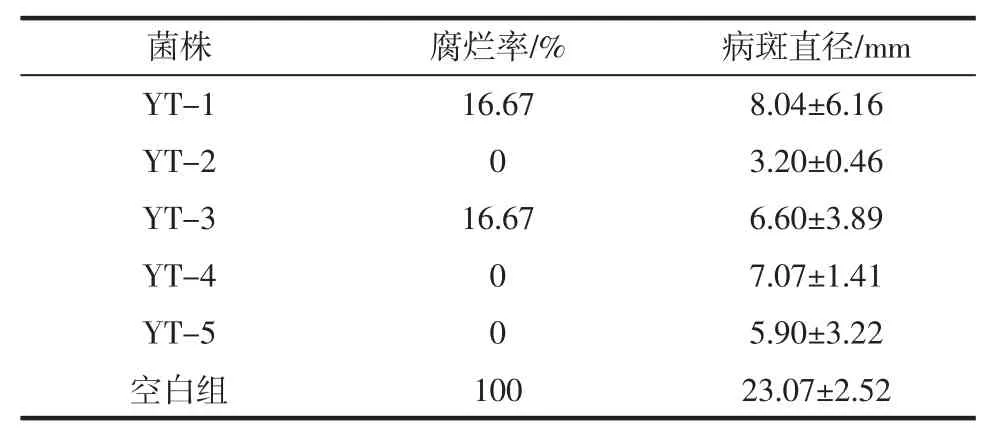
表2 5株拮抗菌对黑曲霉的活体拮抗效果Table 2 Antagonistic effect of five antagonistic bacteria against Aspergillus niger in vivo
3 结论
通过离体和活体双重试验,筛选出采后黑曲霉病害的最佳拮抗菌为YT-2。研究得出模拟刺破伤口3 mm~4 mm,病原菌接种量105spores/mL时,病斑伤害最大,拮抗酵母菌对黑曲霉抑制效果最佳,离体抑菌直径为(15.76±1.79)mm,活体条件下对黑曲霉抑制率为100%。拮抗酵母YT-2常温下能够有效抑制黑曲霉,显著降低机械伤引起的微生物病害问题,抑制霉变。
