熊果酸类似物的结构改造及其体外抗肿瘤活性研究
2020-08-23佟思淼孟艳秋
佟思淼 孟艳秋


摘 要: 以熊果酸为先导化合物,设计并合成其衍生物并检测体外抗肿瘤活性。利用熊果酸与各种芳香醛的缩合反应, 采用计算机辅助设计, 对设计的化合物进行筛选;合成分子对接分最高的的12个化合物。对其C-2位Claisen Schmidt 缩合反应, C-3位以及C-28位羧基进行结构改造; 采用MTT法测试目标化合物对人肝癌细胞(HepG2)和人肺癌细胞(A549)的体外抗肿瘤活性。目标化合物对这两种细胞株的抑制活性均优于母体熊果酸,其中化合物Ⅰ6和Ⅱ4表现出较强的抗肿瘤活性。经结构改造后的熊果酸衍生物具有一定的抗肿瘤活性,值得进一步研究。
关 键 词:熊果酸;结构改造;抗肿瘤活性;分子对接
中图分类号:R914.5 文献标识码: A 文章编号: 1671-0460(2020)07-1261-05
Structural Modification and in vitro Antitumor
Activity of Ursolic Acid Analogues
TONG Si-miao, MENG Yan-qiu
(Shenyang University of Chemical Technology, Shenyang Liaoning 110142, China)
Abstract: Ursolic acid was used as the lead compound, its derivatives were designed and synthesized, and its in vitro antitumor activity was tested. In this paper, the condensation reaction between ursolic acid and various aromatic aldehydes was used to screen the designed compounds by computational aided design.The 12 compounds with the highest molecular score were synthesized.The C-2 Claisen Schmidt condensation reaction, C-3 and C-28 carboxyl groups were modified; The anti-tumor activity of the target compound against human liver cancer cells (HepG2) and human lung cancer cells (A549) in vitro was measured by MTT assay. Inhibitory activity of the target compounds against the two kinds of cell lines was superior to the parent ursolic acid, compoundⅠ6 and Ⅱ4 showed stronger antitumor activity. The structurally modified ursolic acid derivatives have certain antitumor activity and are worthy of further study.
Key words: Ursolic acid; Derivatives; Antitumor activity; Molecular docking
熊果酸是从天然植物中提取出的一种五环三萜类的化合物,具有抗艾滋病[1]、抗白血病[2]、抗糖尿病[3]、抗癌等多种生物学效应,属于乌苏烷型五环三萜类化合物,具备五环三萜的典型结构及药理活性。但熊果酸对癌细胞的细胞毒性较强,不仅仅能够诱导癌细胞十七进入凋亡期,更能够抑制癌细胞的增值。熊果酸并未成为抗肿瘤的明星药物,主要原因是因为其在生物体中的利用程度较低,使得熊果酸的临床应用和市场发展遭受很大阻碍。为了更有效地解决这些问题,本文通过分子对接,设计并合成了12个化合物,并测得体外抗肿瘤活
性[4-9]。
随着医学的发展,越来越多的研究者重视细胞内的发展,也有越来越多的科学家开始利用细胞分离增殖。NF-KB(核因子激活的B细胞的k-轻链)是一种存在于所有动物细胞中的蛋白质复合物,其控制转录的DNA、细胞因子产生和细胞存活。 NF-KB的不正确调节可能会引起感染性休克,病毒感染和免疫发育不当,也可能会诱发癌症、炎症和自身免疫性疾病[10-11]。
1 实验部分
本文采用DS4.0,MVD程序,本文设计的多个化合熊果酸类化合物与NF-kB晶体结构(PDB:3rzf)进行模拟对接,其中C-2位与对硝基苯甲醛、对氯苯甲醛设计连接后的化合物,能与ARG123,LEU386,GLU119和CYS374等关键氨基酸与结构中的配体小分子相结合。模拟表明,对接结果表明(图1-2)化合物和可以很好地嵌入进NF-kB的活性位点,这些表明设计的化合物与靶点具有不错的亲和力。
化合物Ⅰ6与靶点蛋白的分子对接如图1。
化合物Ⅱ4与靶點蛋白的分子对接如图2。
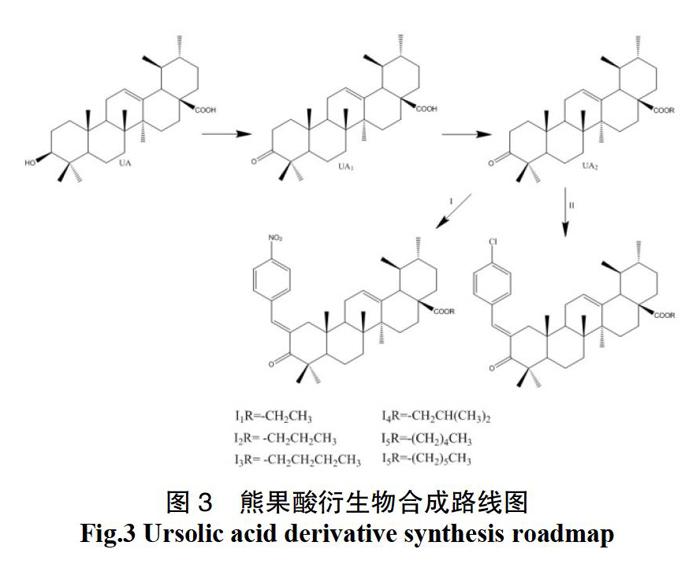
以UA为原料,在C-3被氧化的条件下,C-2连接对硝基苯甲醛、对氯苯甲醛,同时C-28位与卤代烷反应成脂[12-13]。从母核熊果酸UA到合成熊果酸苄啶衍生物包括3个步骤,包括Jones氧化、烷基化、和Claisen Schmidt缩合。在冰水浴的条件下,滴加新配置的的琼斯试剂,用琼斯试剂应得到产率接近98%的C-3氧化衍生物UA1;以UA1为原料,用DMF做溶剂,加入卤代烷1-6,制备了化合物UA2a-UA2f;以UA2a-UA2f为原料加入叔丁醇钾和甲苯,再加入对硝基苯甲醛或对氯苯甲醛,采用Claisen Schmidt缩合法,得Ⅰ1-Ⅰ6或Ⅱ1-Ⅱ6。路线图见图3。
2 结果与讨论
2.1 分子对接
通过MVD等软件的筛选, 发现熊果酸C-2位引入对硝基苯甲醛和对氯苯甲醛的时,氢键的作用力明显高于母体熊果酸的氢键作用力,而其中Ⅰ6与Ⅱ4的氢键作用力最大。数据见表1。
2.2 化学合成
以熊果酸(UA)为母体,经过氧化、酯化、羟醛缩合反应得到十二个化合物,目标化合物经1H NMR以及MS确定,均属于新化合物。数据见表2。
2.3 抗肿瘤活性实验
VP-16和阿霉素为阳性对照物,采用MTT法测试目标化合物体外抗肿瘤活性[14-15]。实验结果表明,合成出的产物对细胞实验中选取的两种细胞存在较为明显的抑制效果,其中化合物I6、II4对人肝癌细胞的IC50值分别为8.72、7.12 μM,化合物I6、II4对人胃癌细胞的IC50值分别为6.85、9.62 μM。将这些化合物对两种肿瘤细胞与选取的阳性对照药对肿瘤细胞的IC50作比较,两者基本相同。由此可以断定产物具有不错的抗肿瘤活性。数据见表3。
3 实验部分
3.1 中间体的合成
氧代-乌苏烷型-12-烯-28羧酸(UA1)的合成: 将UA(0.5 g 0.99 mmol)加入100 mL茄形瓶中,随后加入50 mL丙酮溶解UA,先室温搅拌0.5 h,使其全部溶解。再将其置于冰水中,加入琼斯试剂,缓慢滴加。滴加完毕,恢复至室温,再继续反应2 h, 薄层色谱法监测反应终点。展开剂:PE/EA=10∶1。监测反应到达终点后,向茄形瓶中加入20 mL异丙醇反应45 min淬灭进行淬灭处理。先加入乙酸乙酯,再加入饱和食盐水,进行萃取,选取有机相,加入少量无水硫酸镁及无水硫酸钠,静止超过4 h后,抽滤旋转蒸发柱层析得UA1,产率为90.28%, m.p. 233.0~234.4 ℃。
3-氧代-乌苏烷型-12-烯-28-羧酸乙酯(UA2a)的合成:将UA1(0.5 g , 0.98 mmol)和溴乙烷(2 g, 0.017 mol)溶于20 mL DMF中,0.5 g碳酸钾做催化剂,常温反应,薄层色谱法监测反应终点,反应终点后,用5%稀盐酸水洗,加入乙酸乙酯萃取干燥后,柱层析。展开剂:PE/EA=15∶1。得白色固体UA2a。
3-氧代-乌苏烷型-12-烯-28-羧酸丙酯(UA2b)的合成:将UA1(0.5 g , 0.98 mmol)和溴丙烷(2 g, 0.017 mol)溶于20 mL DMF中,0.5 g碳酸钾做催化剂,常温反应,薄层色谱法监测反应终点,反应终点后,用5%稀盐酸水洗,加入乙酸乙酯萃取干燥后,柱层析。展开剂:PE/EA=15∶1。得白色固体UA2b。
3-氧代-乌苏烷型-12-烯-28-羧酸丁酯(UA2c)的合成:将UA1(0.5 g, 0.98 mmol)和溴丁烷(2 g, 0.016 mol)溶于20 mL DMF中,0.5 g碳酸钾做催化剂,常温反应,薄层色谱法监测反应终点,反应终点后,用5%稀盐酸水洗,加入乙酸乙酯萃取干燥后,柱层析。展开劑:PE/EA=15∶1。得白色固体UA2c。
3-氧代-乌苏烷型-12-烯-28-羧酸异丁酯(UA2d)的合成:将UA1(0.5 g , 0.98 mmol)和溴异丁烷
(2 g, 0.016 mol)溶于20 mL DMF中,0.5 g碳酸钾做催化剂,常温反应,薄层色谱法监测反应终点,反应终点后,用5%稀盐酸水洗,加入乙酸乙酯萃取干燥后,柱层析。展开剂:PE/EA=15∶1。得白色固体UA2d。
3-氧代-乌苏烷型-12-烯-28-羧酸戊酯(UA2e)的合成:将UA1(0.5 g, 0.98 mmol)和溴戊烷(2 g, 0.015 mol)溶于20 mL DMF中,0.5 g碳酸钾做催化剂,常温反应,薄层色谱法监测反应终点,反应终点后,用5%稀盐酸水洗,加入乙酸乙酯萃取干燥后,柱层析。展开剂:PE/EA=15∶1。得白色固体UA2e。
3-氧代-乌苏烷型-12-烯-28-羧酸己酯(UA2f)的合成:将UA1(0.5 g, 0.98 mmol)和溴己烷(2 g, 0.017 mol)溶于20 mL DMF中,0.5 g碳酸钾做催化剂,常温反应,薄层色谱法监测反应终点,反应终点后,用5%稀盐酸水洗,加入乙酸乙酯萃取干燥后,柱层析。展开剂:PE/EA=15∶1。得白色固体UA2f。
3.2 目标化合物的合成
2-对硝基苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸乙酯(Ⅰ1)的合成: 首先将第一步生成的UA2a(0.2 g 0.37 mmol)和对硝基苯甲醛投入50 mL茄形瓶中,并用甲苯将其溶解,加入叔丁醇钾,在室温下反应6 h,薄层色谱法监测反应终点。反应介素后,用5%的稀盐酸酸洗,再用乙酸乙酯萃取。无水硫酸镁与无水硫酸钠干燥后,柱层析得到浅黄色固体,洗脱剂:PE/EA=30∶1。产率为63.28%, m.p. 185.1~189.8 ℃。
2-对硝基苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸丙酯(Ⅰ2)的合成: 按照Ⅰ1 的合成方法,UA2b 和对硝基苯甲醛反应得到粗品,得到浅黄色固体。洗脱剂:PE/EA=30∶1。产率约为68.91%, m.p. 188.8~192.7 ℃。
2-对硝基苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸丁酯(Ⅰ3)的合成: 按照Ⅰ1 的合成方法,UA2c 和对硝基苯甲醛反应得到粗品,浅黄色固体。洗脱剂:PE/EA=30∶1。产率约为63.11%, m.p. 193.1~195.8 ℃。
2-对硝基苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸异丁酯(Ⅰ4)的合成: 按照Ⅰ1 的合成方法,UA2d 和对硝基苯甲醛反应得到,到浅黄色固体。洗脱剂:PE/EA=30∶1。产率约为62.76%, m.p. 192.3~194.8 ℃。
2-对硝基苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸戊酯(Ⅰ5)的合成: 按照Ⅰ1 的合成方法,UA2e 和对硝基苯甲醛反应得浅黄色固体。洗脱剂:石油醚/乙酸乙酯=30∶1。产率约为60.30%, m.p. 196.3~201.0 ℃。
2-对硝基苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸己酯(Ⅰ6)的合成: 按照Ⅰ1 的合成方法,UA2f 和对硝基苯甲醛反应得到浅黄色固体。洗脱剂:PE/EA=40∶1。产率为64.4%,m.p. 198.5~202.1 ℃。
2-对氯苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸乙酯(Ⅱ1)的合成: 首先将第一步生成的UA2a(0.2 g 0.37 mmol)和对氯苯甲醛投入50 mL茄形瓶中,并用甲苯将其溶解,加入叔丁醇钾,在室温下反应6 h,薄层色谱法监测反应终点。反应介素后,用5%的稀盐酸酸洗,再用乙酸乙酯萃取。无水硫酸镁与无水硫酸钠干燥后,柱层析得到淡黄色固体,洗脱剂:PE/EA=25∶1,产率为 产率为67.48%, m.p. 188.9~191.6 ℃。
2-对氯苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸丙酯(Ⅱ2)的合成: 按照Ⅱ1 的合成方法,UA2b 和对氯苯甲醛反应得淡黄色固体。洗脱剂:PE/EA=25∶1产率59.03%, m.p. 193.9~196.5 ℃。
2-对氯苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸丁酯(Ⅱ3)的合成: 按照Ⅱ1 的合成方法,UA2c 和对氯苯甲醛反应得到淡黄色固体。洗脱剂:PE/EA=25∶1。产率为66.51%,m.p. 198.9~201.7 ℃。
2-对氯苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸异丁酯(Ⅱ4)的合成: 按照Ⅱ1 的合成方法,UA2d 和对氯苯甲醛反应得淡黄色固体。洗脱剂:PE/EA=25∶1。产率为64.86%,m.p.197.3~199.5 ℃。
2-对氯苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸戊酯(Ⅱ5)的合成: 按照Ⅱ1 的合成方法,UA2e 和对氯苯甲醛反应得淡黄色固体。洗脱剂:PE/EA=25∶1。产率为60.51%,m.p. 201.4~205.1℃。
2-对氯苯亚甲基-3-氧代-乌苏烷型-12-烯-28-羧酸己酯(Ⅱ6)的合成: 按照Ⅱ1 的合成方法,UA2f 和对氯苯甲醛反应得淡黄色固体。洗脱剂:PE/EA=25∶1。产率为63.65%,m.p. 205.9~208.1 ℃。
基金项目: 国家自然科学基金(项目编号:21372156);辽宁省创新团队资助立项(项目编号:LT2017009);辽宁省教育厅科研项目(项目编号:LFD2017004);辽宁省重点研发计划项目(项目编号:2019JH2/10300034)。
收稿日期: 2019-10-13
作者简介:佟思淼(1994-),锡伯族,女,辽宁沈阳人,硕士研究生,研究方向:药物化学。E-mail:tsm0115@qq.com。
通讯作者:孟艳秋(1963-), 女,辽宁义县人,博士,教授,研究方向:天然化合物有效成分的结构改造及其抗癌活性的研究、新型半合成抗生素的研究、促智药的研究。
参考文献:
[1]刘丹, 孟艳秋, 陈立功. 3种五环三萜类化合物及其衍生物抗艾滋病的研究进展[J]. 中草药, 2008, 39(9):1434-1436.
[2]王晓芹,曹波,高宁.熊果酸诱导人急性白血病细胞凋亡及其作用机制[J].第三军医大学学报,2009,31(2):105-108.
[3]张明发,沈雅琴.熊果酸抗糖尿病并发症药理作用的研究进展[J].抗感染藥学,2016(2):247-251.
[4]艾宏儒, 孟艳秋, 赵娟, 等. 熊果酸衍生物的合成[J]. 当代化工, 2008, 37(3):238-240.
[5]KAZMI I, RAHMAN M, AFZAL M, et al. Anti-diabetic potential of ursolic acid stearoyl glucoside: A new triterpenicgycosidic ester from Lantana camara[J]. Fitoterapia, 2012, 83(1):142-6.
[6]孙澄玥, 戚荣鑫, 张茜,等. 熊果酸在肿瘤治疗中的研究进展[J].现代生物医学进展, 2016, 16(22): 4393-4397.
[7]PRASAD S, YADAV V R, SUNG B, et al. Ursolic acid inhibits the growth of human pancreatic cancer and enhances the antitumor potential of gemcitabine in an orthotopic mouse model through suppression of the inflammatory microenvironment[J]. Oncotarget, 2016, 7(11):13182-
13196
[8]WANG M, ZHAO T, LIU Y, et al. Ursolic acid liposomes with chitosan modification: Promising antitumor drug delivery and efficacy[J]. Materials Science & Engineering C, 2017, 71:1231-1240.
[9]CARGNIN ST, GNOATTO SB. Ursolic acid from apple pomaceand traditional plants: a valuable triterpenoid with functional properties[J]. Food Chem., 2017, 220: 477-489.
[10]孙爱平,刘小梅,胡华,等.熊果酸对THP-1细胞HMGB1表达和NF-kB活性的影响[J]. 基础医学与临床,2016,36(9):1257-1261.
[11]BABAK N L, GELLA I M, SEMENENKO A N, et al. α,β-Unsaturated ketones based on allobetulone[J]. Russian Journal of Organic Chemistry, 2014, 50(7):1048-1055.
[12]Synthesis and spatial structure of new chiral dopants from allobetuline series for cholesteric liquid-crystal compositions[J]. Structural Chemistry, 2016, 27(1):295-303.
[13] 張静,邓涛,陈会敏,等.熊果酸抑制胃癌细胞BGC-823增殖并诱导凋亡[J].武汉大学学报(医学版),2005,26(3):375-378.
[14]王琼,陈建军,向谨逸.熊果酸对人胃癌细胞株MGC-803的抑制作用及机制[J]. 山东医药, 2007, 47(27):30-31
[15]YANG Y, JIANG M, HU J, et al. Enhancement of radiation effects by ursolic acid in BGC-823 human adenocarcinoma gastric cancer cell line[J]. Plos One, 2015,10(7): e0133169.
