2-羟丙基-β-环糊精/葡萄籽提取物包合物对羊肚腐败菌的抑制作用及保鲜效果
2020-08-22钟媛媛李文慧卢士玲王庆玲冉丽丹
钟媛媛,李文慧,卢士玲,王庆玲,冉丽丹,董 娟
(石河子大学食品学院,新疆 石河子 832000)
羊肚即羊胃,是羊的副产品之一,含有丰富的营养成分。据《本草纲目》记载,羊肚性味甘平、口感柔脆、易于消化,具有健脾补虚等功效,是一种健康食品。但在贮藏过程中,易受到内源性微生物和外界环境的影响,从而发生腐败变质。有研究表明,不适当的屠宰、分割和贮藏会导致肉中微生物繁殖和交叉污染,包括沙门氏菌和引起食源性疾病的李斯特氏菌,造成了严重的经济损失[1]。因此,寻找控制肉与肉制品在加工贮藏中微生物污染的有效方法是非常必要的。
近年来,天然抗氧化剂植物多酚抑菌机理的探究成为了热点。Bukvički等[2]将精油加入猪肉后针对单核细胞增生李斯特氏菌进行研究,发现精油处理成功地抑制了猪肉中单核细胞增生李斯特氏菌的增殖,使猪肉的颜色和风味得到明显改善。董璐[3]、钱丽红[4]、王慧敏[5]等研究发现,茶多酚能增加大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌、腐败希瓦氏菌的细胞膜通透性,影响膜流动性,阻碍细菌蛋白质的正常表达,产生良好的抑菌活性。因此,植物多酚取代合成抗氧化剂和抑菌剂已是大势所趋[6]。酿酒后的副产物葡萄籽提取物(grape seed extract,GSE)是丰富且廉价的多酚来源,主要单体是黄烷-3-醇和低聚葡萄籽原花色素(grape seed proanthocyanidins,GSP),其中GSP可有效清除超氧化物和羟基自由基[7]。GSE的抗氧化活性受聚合度的影响,聚合程度越高,抗氧化活性越高[8]。实验证明GSE的抗氧化活性是VE的20 倍,是VC的50 倍;同时,对人类健康具有有益的作用。另外,GSE也被证明具有很强的抗菌活性,特别是对人类致病微生物如金黄色葡萄球菌、凝固葡萄球菌、弗氏柠檬酸杆菌、大肠杆菌和植物致病真菌[9]。
GSE广泛应用于肉制品贮藏加工中,但其自身特性在食品工业中的应用已受到限制,因为GSE在水中的溶解度、生物利用度有限,见光易分解、吸潮,具有不稳定性。环糊精是由α-1,4-葡萄糖苷键连接的无毒环状低聚糖,因为具有中空圆锥形的特殊结构,使得形状和大小合适的疏水性客体分子或官能团能嵌入其空穴中,形成包合物[10]。而水溶性环糊精衍生物,如2-羟丙基-β-环糊精((2-hydroxypropyl)-β-cyclodextrin,HP-β-CD),因具有亲水外表面和亲脂内腔的结构,且客体分子被封装到腔中可以不改变宿主的化学结构而被广泛应用在食品或医药领域[11-12]。已发现客体分子的许多化学和物理性质在包合物形成过程中被优化,例如客体分子的抗氧化、抗光诱导变化和热稳定性增强,客体分子的溶解度增加、挥发性降低,有利于保持食品品质[13]。Abarca等[14]研究发现,通过共沉积法制备了精油与β-环糊精的包合物,可有效降低其挥发性,在微生物分析中,可以观察到包合物对暴露于体外的丝状真菌Botrytis cinerea的径向生长有抑制的作用,证明了包合物对Botrytis cinerea的抑菌行为。巫春宁等[15]采用单因素正交试验制备了GSE与环糊精的包合物,发现GSE通过包合,其稳定性明显提高,同时在水中的溶解度增加了3 倍。Lucas-Abellán等[16]研究指出白藜芦醇中酚羟基与CD羟基形成氢键后其自由基清除能力提高。然而,有关GSE与HP-β-CD的包合物在肉制品中防腐抑菌方面的应用鲜有报道。因此,本实验针对HP-β-CD/GSE包合物对羊肚腐败菌的抑制作用及保鲜效果进行了研究,以期为肉类食品防腐保鲜提供新的途径。
1 材料与方法
1.1 材料与试剂
新鲜绵羊(8 月龄)羊肚由新疆西部牧业股份有限公司提供,购买后将其装入含有冰袋的保温箱中快速运回实验室,去除羊肚表面的污物及油脂后清洗干净。
葡萄籽提取物(纯度95%) 上海麦克林生化科技有限公司;HP-β-CD、蛋白酶K 北京索莱宝科技有限公司;酵母浸粉、琼脂粉 北京奥博星生物技术有限责任公司;蛋白胨 天津市北方天医化学试剂厂;DNA提取试剂盒 天根生化科技北京有限公司。
1.2 仪器与设备
Beta 2-8 LD plus冷冻干燥机 德国Christ公司;Seamus Nicolet IS10傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国赛默飞世尔科技有限公司;DSC200F3差示扫描量热(differential scanning calorimetry,DSC)仪 德国耐驰仪器公司;JSM-6490LV扫描电子显微镜(scanning electron microscope,SEM) 日本电子公司;TC-512聚合酶链式反应(polymerase chain reaction,PCR)仪英国Techne公司;pHS-3C标准型pH计 上海精密仪器有限公司;Mini-protein Ⅲ凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 包合物的制备
采用共沉积法制备包合物[17-18],并以不同物质的量之比(1∶0.5、1∶1、1∶2)进行HP-β-CD/GSE包合物的制备。将0.16 g GSE完全溶解在用铝箔纸包裹的锥形瓶中,加入40 mL、体积分数30%乙醇溶液,再加入不同量的HP-β-CD以得到不同物的质量之比的二者混合溶液。将溶液置于摇床中恒温(40 ℃)搅拌72 h后,于4 ℃的冰箱中过夜。通过抽滤获得沉淀物并用体积分数30%乙醇洗涤后于-80 ℃下预冷24 h后,通过冷冻干燥机冷冻干燥而获得固体HP-β-CD/GSE包合物。物理混合物是将HP-β-CD与GSE以物质的量之比1∶1在研钵中完全混合研磨制备。
1.3.2 HP-β-CD/GSE包合物的表征
1.3.2.1 FTIR光谱的测定
采用溴化钾压片法测定HP-β-CD/GSE包合物以及物理混合物的红外光谱吸收曲线。使用FTIR仪以2 cm-1的分辨率在4 000~500 cm-1的范围内扫描样品。
1.3.2.2 热特性的测定
将5 mg HP-β-CD/GSE包合物以及物理混合物均匀分散在坩埚中,使用DSC仪测量样品的热特性。样品在30~400 ℃的范围内扫描,升温速率为10 ℃/min,干燥氮气流速为25 mL/min。
1.3.2.3 微观结构的测定
将适量HP-β-CD/GSE包合物以及物理混合物依照SEM仪操作要求制片,并进行喷金处理后,置于显微镜下观察(加速电压10 kV)。
1.3.3 羊肚中菌落总数及腐败菌的分离、鉴定
1.3.3.1 菌落总数的测定
菌落总数的测定参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[19]。将羊肚放置在4 ℃贮藏7 d(羊肚有明显的腐败变质现象),在此期间每天进行菌落总数的测定。在无菌操作台上取5 g羊肚放入无菌操作袋中,加入45 mL、质量分数85%的生理盐水,在匀浆器上拍打2 min,制成1∶10的样品匀液。再用无菌盐水进行10 倍梯度稀释,取200 μL稀释4、5、6 倍的3 个梯度稀释样液加入PCA培养基中,进行涂布后,放置在37 ℃恒温培养箱中培养24 h,平板中菌落总数在30~300之间作为有效平板。
1.3.3.2 腐败菌的分离纯化
在1.3.3.1节测定菌落总数后的平板中挑选菌落形态好的菌落在LB固体平板上进行反复划线分离,挑取纯化后的单菌落进一步在LB液体培养基中富集,取适量菌液接入体积分数30%的甘油管中,并在-80 ℃中保藏。
1.3.3.3 DNA提取与测序
使用细菌基因组DNA提取试剂盒进行提取。将提取到的DNA进行16S rDNA PCR扩增,体系为:2×Planta Max MasterMix 12.5 μL、ddH2O 9.5 μL、上游引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')1 μL,下游引物1492R(5'-GGTTACCTTACGACTTGGT-3')1 μL,DNA模板1 μL,反应条件为:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1.5 min,30 个循环重复;72 ℃彻底延伸5 min。
琼脂糖凝胶电泳检测PCR产物的纯度,反应条件为:20 mL质量分数0.8%的琼脂糖凝胶、2 μL核酸染料、样品量(1 μL PCR产物+5 μL loading buffer)、电泳缓冲液1×TAE、电压110 V、电流200 mA。电泳条带在凝胶成像仪下进行观察,并将凝胶条带送至上海生工生物工程公司测序。
1.3.3.4 系统发育树的构建
在NCBI网站输入碱基序列,搜索BLAST进行分析比对。将同源性在98%以上的目的序列复制到文本上,用MEGA 7.0软件构建进化树。
1.3.4 HP-β-CD/GSE包合物对腐败菌的抑菌实验
参照文献[20]的方法,采用滤纸片法做抑菌圈直径实验。将分离纯化得到的腐败菌挑取单菌落到营养肉汤液体培养基中,37 ℃恒温培养活化18 h后,将得到的菌液稀释至108CFU/mL。取100 μL稀释后菌液均匀涂布在营养肉汤固体培养基上,放入灭菌的滤纸片,加入5 μL 5 g/L HP-β-CD/GSE包合物(1∶2,物质的量之比,后同)溶液在滤纸片上,于37 ℃培养24 h后,测定抑菌圈直径。
1.3.5 HP-β-CD/GSE包合物对羊肚保鲜效果的测定
1.3.5.1 原料处理
将羊肚切分成长7~10 cm左右,随机分成4 组,每组3 个平行。其中第一组不做任何处理(空白组),第2~4组分别在5 g/L的HP-β-CD/GSE包合物(1∶0.5、1∶1、1∶2)溶液中浸泡20 min后取出晾干,装入自封袋,4 ℃下贮藏9 d,期间每天对样品进行指标测定。
1.3.5.2 pH值测定
在无菌操作台上取5 g羊肚,并用灭菌后的剪刀剪碎于烧杯中,加入50 mL灭菌后的蒸馏水浸泡30 min,用pH计测定浸泡羊肚后的蒸馏水pH值,待pH计稳定后进行计数,每个样品重复3 次。
1.3.5.3 总挥发性盐基氮含量测定
总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量根据GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[21]进行测定。
1.3.5.4 感官评价
由20 位具有感官评定知识且自身健康的食品专业的老师与同学组成感官评定小组,要求小组全体成员在同一时间分别对样品进行感官评价,且保证相互之间无任何交流。感官评分取值在0~9 分,最终取各感官项目的平均值,具体评分标准见表1。

表1 羊肚的感官评分标准Table 1 Criteria for sensory evaluation of lamb tripe
1.4 数据处理与分析
每组实验重复测定3 次,结果采用SPSS Statistics 17.0软件进行数据分析,使用Origin Pro 8.5软件作图。
2 结果与分析
2.1 HP-β-CD/GSE包合物结构与特性的表征
2.1.1 FTIR分析结果
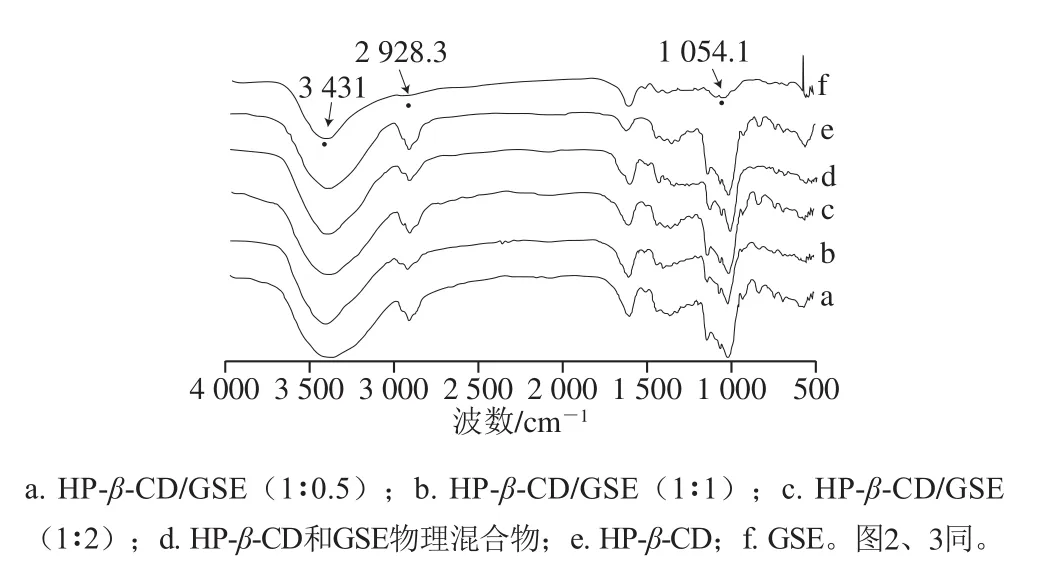
图1 不同主客体比包合物的FTIR图Fig.1 FTIR spectra of inclusion complexes with different host/guest ratios
FTIR能够为分析固体中环糊精和客体分子间的相互作用提供有效信息[22]。共沉积法制备的不同物质的量之比的HP-β-CD/GSE包合物、HP-β-CD/GSE物理混合物、HP-β-CD及GSE的FTIR图如图1所示。GSE在3 431 cm-1处显示出特征吸收峰,这可能是由于酚羟基中的O—H键的伸缩振动,特征骨架振动主要集中在1 000~1 650 cm-1和700~850 cm-1区域。HP-β-CD在3 416.08 cm-1处有明显的—OH伸缩振动吸收带,在2 928.33 cm-1处存在—CH伸缩振动峰,在1 159 cm-1处和1 032 cm-1处为C—O—C的对称和不对称伸缩振动峰[23]。在形成HP-β-CD/GSE包合物后,GSE特征峰逐渐减少(主要呈现HP-β-CD的峰),移位或丢失。GSE中对应的苯骨架在3 431 cm-1处的吸收峰轻微移动至3 410 cm-1,1 000~500 cm-1处的C—O拉伸振动被HP-β-CD的特征性吸收峰被遮蔽,这可能是HP-β-CD/GSE包合物的形成所致[24],表明GSE可能已完全嵌入HP-β-CD的空腔中。物理混合物是HP-β-CD和GSE单一组分之间的FTIR光谱的简单叠加。FTIR的结果证实了HP-β-CD/GSE包合物的形成,结果与Pu Hongyu等[25]用HP-β-CD包合特丁基对苯二酚的研究结果一致。
2.1.2 热特性分析结果

图2 不同主客体比包合物的DSC图Fig.2 DSC patterns of inclusion complexes with different host/guest ratios
由图2可知,GSE在238.21 ℃处出现了急剧的吸热熔融峰。对于HP-β-CD,在82.56 ℃处显示出较宽的吸热熔融峰,这与HP-β-CD水分损失有关;在349.38 ℃处观察到第二吸热熔融峰,这可能是热分解所致。物理混合物的DSC曲线是HP-β-CD和GSE曲线的简单叠加,该结果表明这两种物质仅物理混合但彼此不相互作用。
在具有不同物质的量之比的HP-β-CD/GSE包合物中,除了在283 ℃处GSE熔融峰的消失外,HP-β-CD/GSE(1∶0.5)包合物的DSC曲线中其特征吸收峰仅在71.15 ℃处很明显。在HP-β-CD/GSE(1∶1)包合物的DSC曲线中,在74.99 ℃和341.70 ℃处有两个吸热熔融峰。在HP-β-CD/GSE(1∶2)包合物的DSC曲线中,在73.65 ℃和323.35 ℃处存在两个吸热熔融峰,这可能是由于在包合物形成过程中HP-β-CD和GSE之间形成新的分子间或分子内键,使GSE的熔点消失,并且在GSE和HP-β-CD之间形成包合物HP-β-CD后,热性质发生改变,导致熔融峰的移动[26]。DSC分析可用于确定固体包合物的形成,且包合物中客体分子的热峰消失进一步表明包合物的成功制备[27]。
2.1.3 微观结构观察结果
SEM可用于观察物质和电子之间相互作用后的表面形态,是一种检测包合物形成的辅助方法[28]。如图3所示,GSE呈现针状菱形晶体形态,而HP-β-CD呈球形。在HP-β-CD和GSE的物理混合物中两种形态都能被观察到,为不规则的嵌段结构和片段化的球形结构,其中宿主(HP-β-CD)和客体(GSE)的形式未改变。包合物的形状与物理混合物的形状完全不同,其呈现出具有球形腔或腔体碎片结构表面的多层块结构。不同物质的量之比的HP-β-CD/GSE包合物的表面形态不同;HP-β-CD/GSE(1∶0.5)的包合物呈圆球形嵌段结构,而1∶1和1∶2比例的包合物呈现不规则的层状结构。研究表明,当客体分子包含在β-CD中时,包合物的表面由于客体分子结晶度的降低而发生很大变化[29]。在HP-β-CD/GSE包合物中,两种组分的原始形态完全丧失,并被不规则尺寸的小聚集体取代。因此,FTIR、DSC和SEM的结果表明HP-β-CD/GSE包合物制备成功。

图3 不同主客体比包合物的SEM图Fig.3 SEM of inclusion complexes with different host/guest ratios
2.2 羊肚中的菌落总数及腐败菌的分离、鉴定结果
2.2.1 贮藏过程中羊肚的菌落总数变化
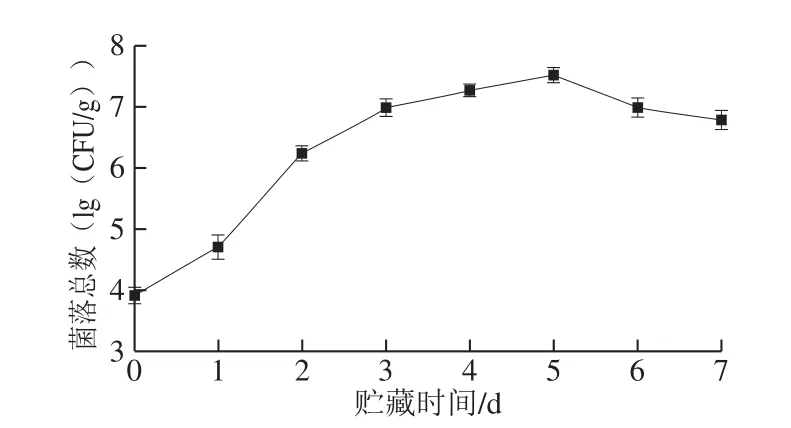
图4 4 ℃贮藏过程中羊肚的菌落总数Fig.4 Total number of colonies in lamb tripe stored at 4 ℃
如图4所示,新鲜羊肚的菌落总数为3.91(lg(CFU/g)),在贮藏的前4 d,菌落总数呈现快速上升的趋势,可能是由于在此期间羊肚中的微生物处于对数生长期,微生物利用羊肚中的营养物质后进行大量繁殖。随后,微生物的繁殖与营养物质达到平衡状态,在贮藏第5天菌落总数为7.52(lg(CFU/g))。一般来说,生鲜肉定菌落总数高于6(lg(CFU/g))时表示肉品质已经腐败变质[30],而羊肚在贮藏第2天时的菌落总数已高于6(lg(CFU/g)),说明已腐败变质。
2.2.2 腐败菌的鉴定及进化树的构建结果
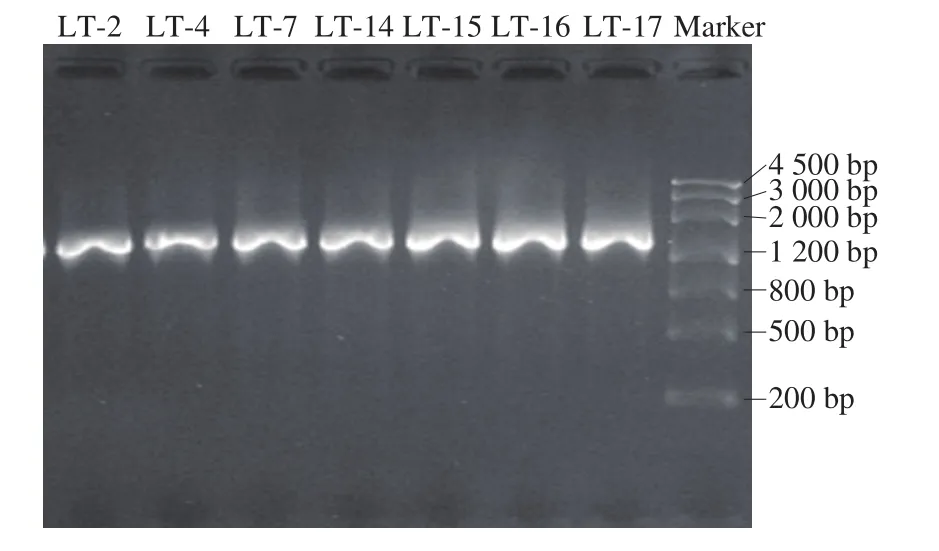
图5 分离腐败菌株的16S rDNA PCR扩增电泳图Fig.5 Electrophoresis pattern of 16S rDNA polymerase chain reaction amplification products of isolated spoilage strains
对羊肚中微生物进行分离纯化后,共筛选出7 株腐败菌,对7 株腐败菌进行DNA提取和PCR扩增,扩增后的条带如图5所示,特异性扩增条带均出现在1 250 bp左右,且条带清晰、无杂带。
对条带进行测序后,在BLAST上比较测序结果,选择了98%以上的相似菌株,并使用MEGA 7.0构建了腐败菌系统发育树(图6),得到分离纯化出的7 株腐败菌菌株分别为表皮葡萄球菌(Staphylococcus epidermidis)、金黄色葡萄球菌(Staphylococcus aureus)、蜡状芽孢杆菌(Bacillus cereus)、吉氏库特菌(Kurthia gibsonii)、肠溶沙门氏菌亚种(Salmonella entericasubsp.)、大肠杆菌(Escherichia coli)、棕色类香味菌(Myroiddes phaeus)。

图6 基于16S rRNA序列的同源性菌株系统发育树Fig.6 Phylogenetic tree of homologous strain based on 16S rRNA sequence
2.3 HP-β-CD/GSE包合物(1∶2)对腐败菌的抑制作用
实验中发现物质的量比为1∶2时包合物的抗氧化效果最好,且物质的量比为1∶0.5和1∶1对腐败菌的抑制效果没有1∶2时好(未列出相应实验结果),所以只对1∶2的最优效果进行讨论。从表2可以看出,HP-β-CD/GSE包合物(1∶2)对分离的7 种菌均具有一定的抑菌效果,其中对大肠杆菌和金黄色葡萄球菌抑菌活性效果最强,其次是表皮葡萄球菌。图7为抑菌实验中包合物对大肠杆菌和金黄色葡萄球菌的抑菌结果。

表2 包合物(1∶2)对7 株腐败菌的抑制作用结果Table 2 Inhibitory effect of inclusion complex (1:2) on seven strains of spoilage bacteria
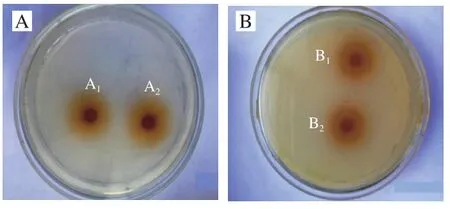
图7 包合物(1∶2)对金黄色葡萄球菌(A)及大肠杆菌(B)的抑菌效果Fig.7 Antibacterial effect of inclusion complex (1:2) against Staphylococcus aureus (A) and Escherichia coli (B)
2.4 HP-β-CD/GSE包合物对羊肚的保鲜效果
2.4.1 pH值的变化

图8 贮藏期间羊肚的pH值变化Fig.8 Changes in pH of lamb tripe during storage
pH值影响肉的品质(如持水性、风味)和货架期,可以作为评价肉的新鲜度的指标之一[31]。如图8所示,空白组中的羊肚在第0天时pH值为6.62,而处理组的pH值在第0天时为6.53,处理组的pH值低于空白组可能是因为与HP-β-CD/GSE包合物溶液本身的pH值有关。在贮藏期间羊肚的pH值均呈现缓慢上升趋势,可能是因为蛋白质在组织蛋白酶类和腐败微生物作用下逐渐分解产生氨基酸,随后继续分解为氨和三甲胺等碱性物质[32]。不同物质的量之比的HP-β-CD/GSE包合物(1∶0.5、1∶1、1∶2)处理的羊肚在贮藏期间的pH值始终低于空白组,说明在使用HP-β-CD/GSE包合物溶液浸泡后,GSE进入羊肚的组织中,抑制了羊肚中的蛋白降解,减缓了羊肚腐败变质的过程。相比较下,1∶2 HP-β-CD/GSE包合物处理组的羊肚pH值在贮藏的前6 d保持在较小的范围波动,这对羊肚品质保持十分有利。
2.4.2 TVB-N含量的变化

图9 贮藏期间羊肚TVB-N含量的变化Fig.9 Changes in TVB-N content of lamb tripe during storage
TVB-N指在酶和微生物的作用下,肉制品中的蛋白质腐败分解产生氨及胺类等具有挥发性碱性含氮类物质[33]。TVB-N含量越高,表明肉制品中蛋白质破坏分解得越多,因此TVB-N含量在很大程度上能反映肉制品的新鲜度[34]。如图9所示,在第0天时,新鲜的羊肚中TVB-N含量为8 mg/100 g左右。在后期贮藏过程中,各处理组的TVB-N含量均呈现上升的趋势。空白组中TVB-N含量上升趋势较快,贮藏期在第2天时已超过GB 9961—2008《鲜、冻胴体羊肉》中对鲜肉TVB-N的限量15 mg/100 g。而不同物质的量之比的HP-β-CD/GSE包合物(1∶0.5、1∶1、1∶2)处理的羊肚在贮藏期间的TVB-N含量始终低于空白组,说明HP-β-CD/GSE包合物能有效抑制由微生物引起的TVB-N含量增加。其中,物质的量比为1∶2的HP-β-CD/GSE包合物TVB-N含量增长较缓慢,在贮藏的前6 d均低于15 mg/100 g,保鲜效果较好,这一结果与pH值的变化趋势相似。
2.4.3 感官品质的变化

图10 贮藏期间羊肚的感官评分Fig.10 Sensory evaluation of sheep tripe during storage
感官评分是品评人员对羊肚在贮藏过程中直观判定的结果,根据羊肚的颜色、质地、气味进行打分,该得分可以用于辅助理化指标判定羊肚在冷藏过程中的品质变化。在贮藏开始时,羊肚的颜色色泽均匀,富有光泽,有弹性,质地坚实,具有羊肚固有浓郁气味,无异味。贮藏2 d后,空白组的感官评分明显低于用HP-β-CD/GSE包合物处理组。贮藏时间超过4 d后,空白组色泽极度不均匀,羊肚表面水分过多,无弹性,质地非常柔软,固有气味消失,有明显异味,感官评分小于6 分,并呈现急速下降趋势;包合物处理组(除1∶0.5)在6 d内感官评分大于6,保持在可接受范围。结果表明,HP-β-CD/GSE包合物处理组可有效延长羊肚的货架期3~4 d,与理化指标研究结果一致。
3 结 论
本实验以HP-β-CD为主体成功制备了不同物质的量之比(1∶0.5、1∶1、1∶2)的HP-β-CD/GSE包合物,利用FTIR、DSC和SEM表征手段证明了包合物的形成。另外,对羊肚腐败菌进行分离后,鉴定出了表皮葡萄球菌(Staphylococcus epidermidis)、金黄色葡萄球菌(Staphylococcus aureus)、蜡状芽孢杆菌(Bacillus cereus)、吉氏库特菌(Kurthia gibsonii)、肠溶沙门氏菌亚种(Salmonella entericasubsp.)、大肠杆菌(Escherichia coli)、棕色类香味菌(Myroiddes phaeus)7 株主要腐败菌,且HP-β-CD/GSE包合物(1∶2)对金黄色葡萄球菌和大肠杆菌具有明显的抑制作用。将HP-β-CD/GSE包合物应用于羊肚的保鲜(4 ℃)中,发现其对羊肚的品质起到一定的保持作用,且物质的量之比为1∶2的HP-β-CD/GSE包合物对羊肚的抑菌保鲜效果较好。
