氟[18F]化钠注射液细菌内毒素检查及无菌检查方法建立
2020-08-22孙祥敏杜建冬吴艳丽郭飞虎
孙祥敏,骆 丹,杜建冬,吴艳丽,张 云,郭飞虎
(原子高科股份有限公司,北京 102413)
氟[18F]化钠注射液是一种用于骨显像的正电子放射性药物。该药物由静脉注射进入血液系统后,可选择性的吸附于骨骼系统,是一种优良的骨显像剂,能够高灵敏度、高特异性地对肿瘤骨转移进行早期诊断和检测复发[1-3],也能够有效鉴别破裂斑块和高风险的冠状动脉粥样硬化斑块[4]。目前我国并未有该产品上市,因此对该产品的开发研究具有较广阔的市场前景和社会意义。新药质量研究作为新药开发的重要组成部分,是保障药品安全性、有效性的基础。细菌内毒素和微生物进入人体后会引起严重的后果,严重时甚至会引起死亡[5-6],因此细菌内毒素检查和无菌检查对注射剂的安全性尤为重要。目前国内尚未有氟[18F]化钠注射液细菌内毒素检查和无菌检查相关质量标准和具体检验方法的收载,因此,对该产品的细菌内毒素检查、无菌检查的相关质量标准和具体检验方法的研究对保障用药安全具有十分重要的作用。
氟[18F]化钠注射液为放射性药品,放射性药品具有生产批量小、样品存在放射性等特点,要求检验快速有效[7],另外还需考虑操作时间对人员辐照剂量的影响和放射性废物处理等因素。细菌内毒素检查宜采用凝胶限度法,无菌检查宜采用直接接种法。本文对氟[18F]化钠注射液产品的细菌内毒素检查和无菌检查方法进行研究,建立适宜于该产品的检验方法,以保证检验结果的准确可靠,对产品质量进行控制,保障用药安全。
1 仪器与材料
1.1 主要仪器
TAL-40D型试管恒温仪:湛江安度斯生物有限公司;XW-80A型旋涡混合器:海门市其林贝尔仪器制造有限公司;DHG-9145A型电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;BSC-1600IIB2型生物安全柜:苏州安泰空气技术有限公司;RT1600S型隔离器:浙江泰林生物技术股份有限公司;YXQ-LS-100SII型压力蒸汽灭菌器、恒温培养箱(BSP-250型、SPX-250C型):上海博讯实业有限公司医疗设备厂;MP1100B型电子天平:上海舜宇恒平科学仪器有限公司。
1.2 主要材料与试剂
氟[18F]化钠注射液:原子高科股份有限公司提供;细菌内毒素工作标准品:80 EU·支-1,中国食品药品检定研究院提供;细菌内毒素检查用水(BET水):湛江安度斯生物有限公司产品;鲎试剂:0.5 EU·mL-1,湛江安度斯生物有限公司产品(批号1406032)和厦门鲎试剂实验厂有限公司产品(批号150103);菌珠:103·颗-1,4代,北京三药科技开发公司产品;培养基:北京三药科技开发公司产品;0.9%氯化钠注射液:石家庄四药有限公司产品。
2 实验方法
2.1 细菌内毒素检查方法
2.1.1细菌内毒素限值(L) 按公式L=K/M[8]计算。其中,K为人每千克体重每小时最大可接受的内毒素剂量,放射性药品注射剂K=2.5 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,人均体重按60 kg计算,注射时间不足1 h,按1 h时计算。
2.1.2鲎试剂灵敏度复核 取细菌内毒素工作标准品用1 mL BET水复溶后,在旋涡混合器上混匀15 min,逐步稀释制备2λ、λ、0.5λ、0.25λ的内毒素标准溶液(λ为鲎试剂灵敏度标示值),每步稀释均混匀30 s以上。每批鲎试剂,各取18支进行实验。其中16支分别用0.1 mL BET水复溶,然后分别加入0.1 mL浓度为2λ、λ、0.5λ、0.25λ的内毒素标准溶液,每个浓度平行做4支;剩余2支,每支加入0.2 mL BET水,作为阴性对照(NC)。混匀,(37±1) ℃恒温培养(60±2) min。若2λ管均为阳性(+),0.25λ管均为阴性(-),NC均为(-)时,实验有效。计算鲎试剂灵敏度测定值λc=antilg(∑X/4)(X为反应终点浓度的对数值)。λc在0.5λ~2λ范围内时,该批鲎试剂符合规定,并以标示灵敏度λ为该批鲎试剂的灵敏度。
2.1.3最大有效稀释倍数(MVD) 按公式MVD=cL/λ计算。其中c为供试品溶液浓度,当L以EU/mL表示时,c为1.0 mL/mL。
2.1.4预干扰实验 选用0.5 EU·mL-1的鲎试剂进行实验。将供试品溶液以BET水稀释至不同浓度。供试品溶液组(NPC),每个浓度平行两管,每管以0.1 mL BET水复溶鲎试剂,然后加入0.1 mL供试品溶液;供试品阳性对照组(PPC),每个供试品浓度平行两管,每管以0.1 mL 2λ细菌内毒素标准溶液复溶鲎试剂,然后加入0.1 mL供试品溶液;阳性对照(PC),平行两管,每管以0.1 mL BET水复溶鲎试剂,然后加入0.1 mL 2λ细菌内毒素标准溶液;阴性对照组(NC),平行两管,每管加入0.2 mL BET水。混匀,(37±1) ℃恒温培养(60±2) min。当NPC、NC平行管均为阴性(-),PC均为阳性(+)时,实验有效。PPC中第一个出现阳性结果的浓度即初步将其判断为样品的无干扰浓度。
2.1.5干扰实验 以两个厂家的鲎试剂进行实验[9]。对于每批鲎试剂,供试品溶液组平行两管,每管用0.1 mL BET水复溶鲎试剂,然后加入0.1 mL供试品溶液;干扰实验系列,每管加入0.1 mL供试品溶液,然后加入0.1 mL内毒素标准溶液(共四个浓度2λ、λ、0.5λ、0.25λ),每个浓度平行四管;鲎试剂标示灵敏度对照系列,每管用0.1 mL BET水复溶鲎试剂,然后加入0.1 mL内毒素标准溶液(共四个浓度2λ、λ、0.5λ、0.25λ),每组平行两管;阴性对照组平行两管,每管加入0.2 mL BET水。(37±1) ℃恒温培养(60±2) min。按公式计算BET水和供试品稀释液反应终点浓度的几何平均值(Es和Et)。Es=antilg(∑Xs/2),Et=antilg(∑Xt/4)。Es和Et值均在0.5λ~2λ范围内时,判定供试品在该浓度下无干扰。
2.1.6氟[18F]化钠注射液细菌内毒素检查 采用建立好的内毒素检查方法,对氟[18F]化钠注射液进行细菌内毒素检验。对于每批次供试品的检查,取8管鲎试剂进行实验。其中2管为供试品溶液组(S),每管以0.1 mL BET水复溶鲎试剂,然后加入0.1 mL供试品溶液;2管为供试品阳性对照组(PPC),每管加入0.1 mL供试品溶液,然后加入0.1 mL浓度为2λ内毒素标准溶液;2管为阳性对照组(PC),每管用0.1 mL BET水复溶鲎试剂,然后加入0.1 mL浓度为2λ内毒素标准溶液;2管为阴性对照组(NC),每管加入0.2 mL BET水。(37±1) ℃恒温培养(60±2) min。NC平行管均为(-),PPC、PC平行管均为(+),实验有效;S均为(-),判供试品符合规定。
2.2 无菌检查方法
2.2.1菌液制备 金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、铜绿假单胞菌、生孢梭菌、白色念珠菌、黑曲霉菌珠均以1.1 mL 0.9%氯化钠注射液溶解,静置约30 s,旋涡混合5~10 s,然后取1 mL菌液加入9 mL 0.9%氯化钠注射液进行10倍稀释。
2.2.2菌落计数 金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、铜绿假单胞菌、生孢梭菌的计数采用胰酪大豆胨琼脂培养基;白色念珠菌、黑曲霉的计数采用沙氏葡萄糖琼脂培养基。每皿加入0.3 mL菌液,浇注20 mL约45 ℃的培养基,混匀,冷却凝固后,倒置培养,每种实验菌平行制备两个平板。另以稀释液代替菌液同法操作作为阴性对照。生孢梭菌放入厌氧袋中厌氧培养。接种后的胰酪大豆胨琼脂培养基平板置33 ℃培养3 d,沙氏葡萄糖琼脂培养基平板置24 ℃培养5 d,观察结果,点计菌落数。
2.2.3培养基适用性检查 培养基适用性检查包括无菌性检查和灵敏度检查[10]。取11支装量为12 mL的硫乙醇酸盐流体培养基(FTM),分别接种0.3 mL的金黄色葡萄球菌、生孢梭菌、铜绿假单胞菌菌液各2支,另5支不接种作为培养基无菌性检查用,加菌管33 ℃培养3 d,无菌检查管培养14 d;取11支装量为9 mL的胰酪大豆胨液体培养基(TSB),分别接种0.3 mL的枯草芽孢杆菌、白色念珠菌菌液、黑曲霉孢子悬液各2支,另5支不接种作为培养基无菌性检查用,加菌管24 ℃培养5 d,无菌检查管培养14 d。当加菌培养基管均生长良好,无菌性检查管均无菌生长,可判培养基适用性检查均符合规定。
2.2.4方法适用性实验和产品无菌性检查 取3批氟[18F]化钠注射液进行实验。对于每批产品的无菌检查方法适用性实验,取6管装量为7.5 mL的FTM,分别接入小于100 cfu的金黄色葡萄球菌、生孢梭菌、大肠埃希菌各2管;取6管装量为7.5 mL的TSB,分别接入小于100 cfu的枯草芽孢杆菌、白色念珠菌、黑曲霉各2管。其中1管接种0.2 mL的供试品,另一管不接种作为对照。另取FTM、TSB各2管,每管接入0.2 mL的供试品作为供试品的无菌检查。方法适用性用FTM管置33 ℃培养3 d,TSB管置24 ℃培养5 d,无菌检查管培养14 d,逐日观察结果。阳性对照管生长良好,与阳性对照管相比,供试品阳性对照管均生长良好,则该检验量在该检验条件下无干扰。无菌检查管溶液澄清、无菌生长,则供试品无菌检查符合规定。
3 结果与讨论
3.1 细菌内毒素检查方法
3.1.1细菌内毒素限值(L) 氟[18F]化钠注射液最大给药体积为10 mL,注射时间小于1 h,计算M=10 mL/(60 kg·h);放射性药品注射剂K=2.5 EU/(kg·h),计算L=K/M=15 EU·mL-1。氟[18F]化钠注射液的L定为15 EU·mL-1。
3.1.2鲎试剂灵敏度复核 对批号为1406032和150103,λ为0.5 EU/mL的鲎试剂进行灵敏度复核实验,实验结果列于表1。2批鲎试剂的λc均在0.5~2.0λ范围内,鲎试剂灵敏度复核均符合规定,可用于细菌内毒素检查。
3.1.3最大有效稀释倍数(MVD) 目前用于药品检验的鲎试剂灵敏度一般在0.03~0.5 EU·mL-1之间,氟[18F]化钠注射液的L=15 EU·mL-1,按公式MVD=cL/λ计算所对应的MVD为30到480倍(表2)。
3.1.4预干扰实验 取一批次氟[18F]化钠注射液,用BET水稀释制成10倍、30倍、60倍、120倍的供试品溶液进行实验。结果列于表3。预实验结果初步表明,将供试品稀释10倍后对细菌内毒素实验无干扰作用。

表1 鲎试剂灵敏度复核Table 1 The confirmation of the labelled lysate sensitivity

表2 最大有效稀释倍数Table 2 The maximum valid dilution
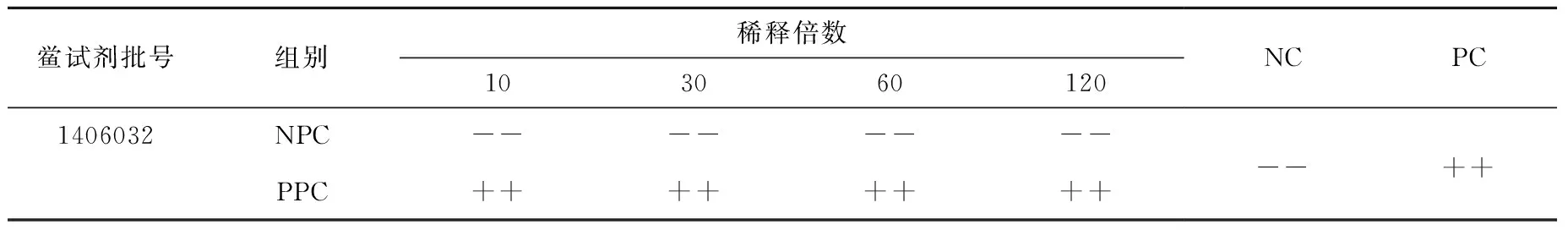
表3 氟[18F]化钠注射液预干扰实验结果Table 3 Results of interference advance tests of Na18F
3.1.5干扰实验 将连续生产的三批氟[18F]化钠注射液稀释10倍进行实验,各批次放射性浓度均合格(合格标准为0.37~7.40 GBq/mL),放射性浓度分别为1.59 GBq/mL(20160406-1)、1.03 GBq/mL(20160407-1)、0.93 GBq/mL(20160407-2)。实验结果列于表4。各组Es和Et值均在0.5λ~2λ范围内,将氟[18F]化钠注射液稀释10倍,对不同厂家的鲎试剂与内毒素的反应均无干扰作用,可以采用将供试品至少稀释10倍进行该产品的细菌内毒素检查。
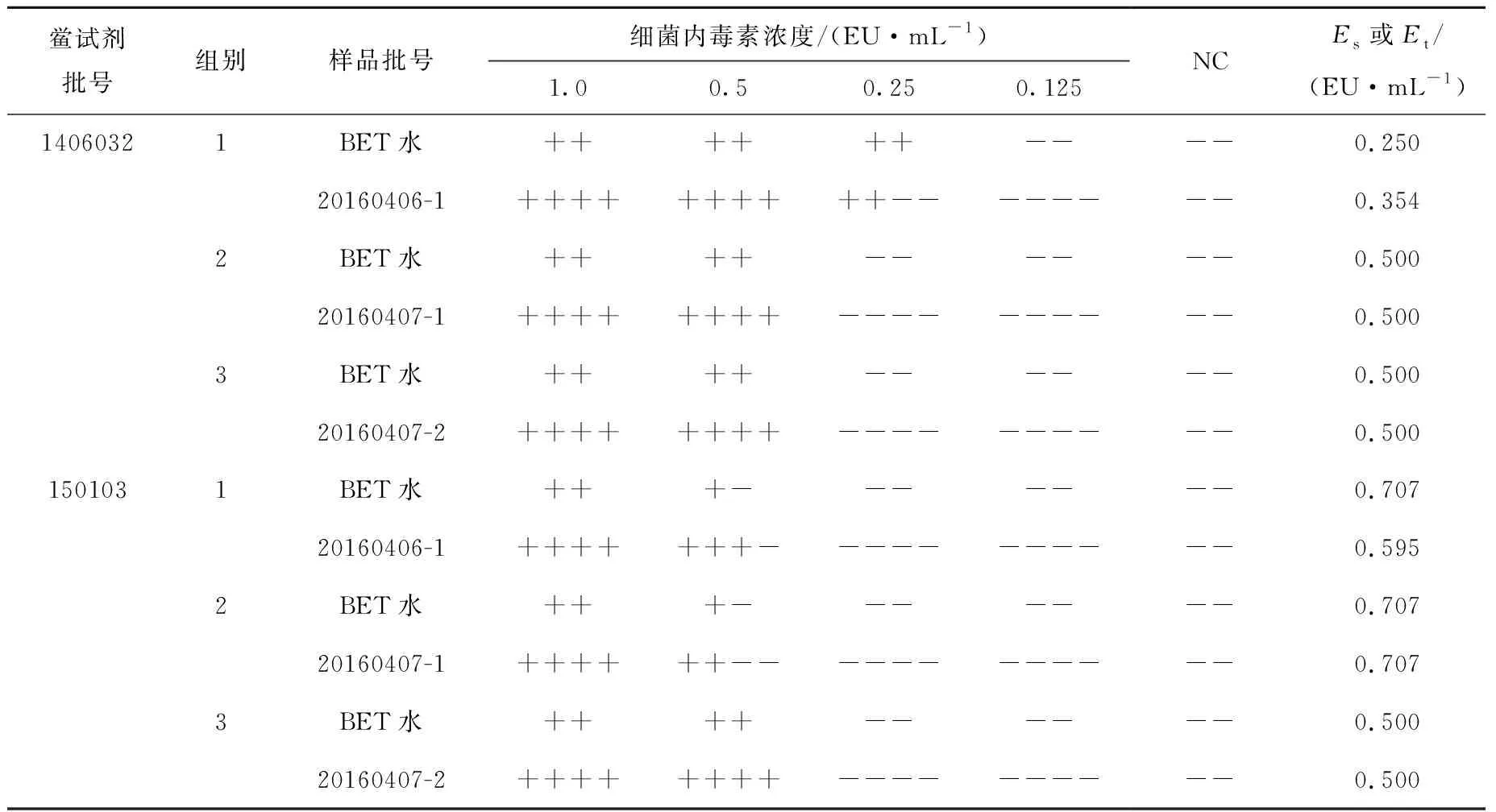
表4 氟[18F]化钠注射液干扰实验结果Table 4 Results of interference tests of Na18F
3.1.6氟[18F]化钠注射液细菌内毒素检查 采用0.5 EU·mL-1的鲎试剂,将供试品直接稀释30倍进行实验。3批次氟[18F]化钠注射液的细菌内毒素检查结果见表5。结果均符合规定。
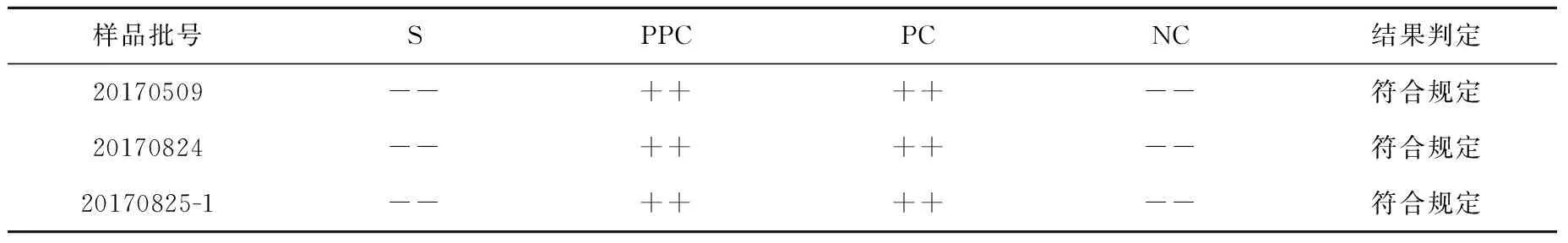
表5 氟[18F]化钠注射液细菌内毒素检查结果Table 5 Results of bacterial endotoxin test of Na18F
3.2 无菌检查方法
3.2.1菌落计数 对所采用的商业菌株进行浓度测定,每种实验菌取0.3 mL的10倍稀释液进行计数,实验结果见表6。实验结果表明,各实验菌的接种体积均采用0.3 mL时,接种菌量均小于100 cfu。

表6 菌液计数结果Table 6 Results of colony counting
3.2.2培养基适用性检查 对无菌检查用培养基进行培养基适用性检查,无菌性检查各管均无菌生长,灵敏度检查各管均生长良好,培养基适用性检查均符合规定,可用于供试品的检验。
3.2.3方法适用性实验和产品无菌性检查 取3批氟[18F]化钠注射液进行实验。实验结果列于表7、表8。实验结果表明,与对照管相比,三批含供试品的培养基管中各实验菌均生长良好,接种0.2 mL供试品至7.5 mL培养基管中进行无菌检查时无抑菌作用或其抑菌作用可以忽略不计。对三批产品进行无菌检查均合格。
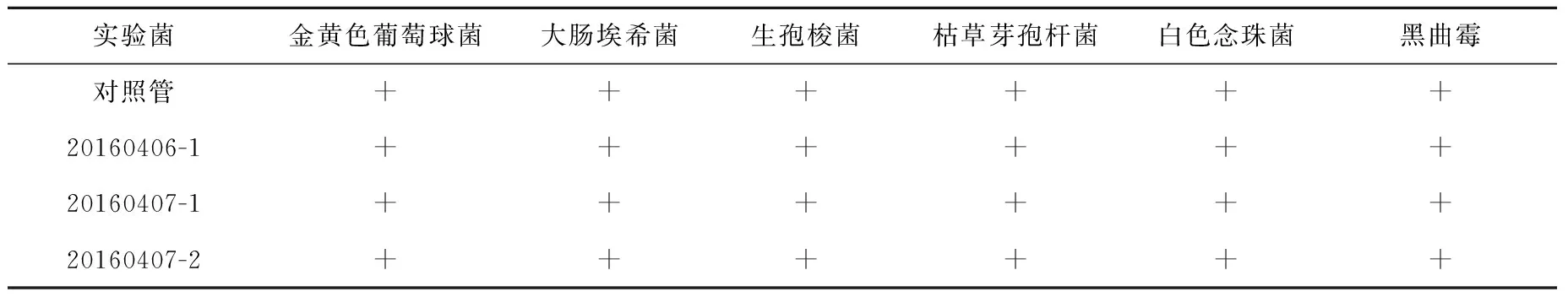
表7 方法适用性实验Table 7 The method suitability test
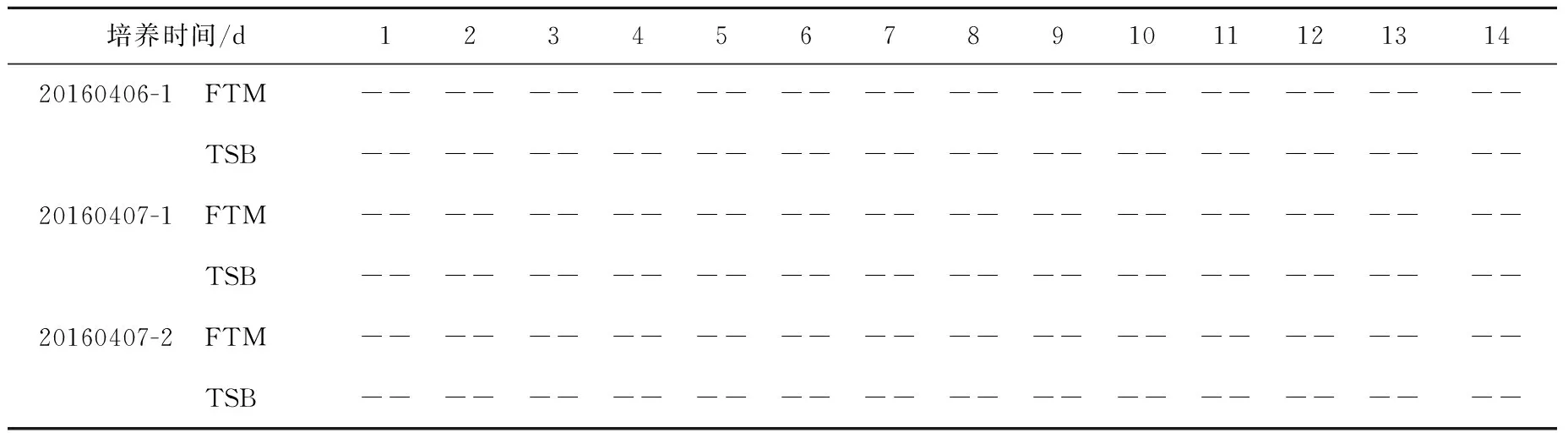
表8 无菌检查Table 8 The sterility test
4 结论
本研究根据药品剂型和用药情况,制定了内毒素检查和无菌检查质量标准,其中细菌内毒素限值为15 EU·mL-1,无菌检查应无菌生长。建立了氟[18F]化钠注射液细菌内毒素检查方法和无菌检查方法,可用于该产品的质量检验、对产品质量进行控制,确保用药安全。
氟[18F]化钠注射液采用凝胶限度法进行细菌内毒素检验时,须将供试品稀释至少10倍进行检验。该法操作简便、快捷,且成本较低,是目前放射性药品常用的检测方法。
氟[18F]化钠注射液的无菌检查可以采用直接接种0.2 mL供试品至7.5 mL培养基管中进行无菌检查的方法。该方法操作简单,产生废物量小,适宜于该产品的无菌检查。
在方法验证实验中,均为生产结束后,即时取样进行实验,射线对检验影响较小。该产品属正电子类放射性药品,细菌内毒素检查和无菌检查可进行追溯性检验[10],为避免检验人员受到过量电离辐射,可将样品进行适当衰变后进行检验。
