L-谷氨酸改性氧化石墨烯对Cu2+的吸附
2020-08-21李仕友伍随意郭圃华欧阳成炜荣丽杉
李仕友,伍随意,张 考,郭圃华,欧阳成炜,荣丽杉
(南华大学 污染控制与资源化技术湖南省重点实验室,湖南 衡阳 421001)
随着工业化的快速发展,产生了大量含重金属废水,部分未经完全处理废水的排放,加重了水土污染。铜是工业生产中使用最多的重金属之一,也是人体必须的微量元素,但如果摄入过量,可能会导致中毒、抽搐、呕吐甚至死亡[1]。目前,常采用化学沉淀法[2]、膜过滤法[3]、电化学处理法[4]、絮凝法[5]、吸附法[6]等处理重金属废水。吸附法因其操作简单、经济高效、选择性好,在处理重金属废水方面得到越来越多的关注。氧化石墨烯(GO)是由石墨经多步氧化、超声波净化等步骤制备而成,不仅保留了石墨烯本身的高比表面积特点,还引入了大量的含氧官能团(如羟基、羧基等),可作为重金属离子的吸附位点[7]。但这些含氧官能团也使得GO表现出强亲水性,吸附重金属后容易发生团聚,且纳米级的GO难以使用传统分离方法将其从水中分离出来,限制了其循环利用并容易导致二次污染[8]。采用功能基团修饰的GO对金属离子有更好的螯合吸附功能,且分离再生和循环利用性能更好,并可降低其应用成本[9]。
L-谷氨酸(L-Glu)具有疏水性,能提高从水体中分离GO的效果[10],且含有羧基、氨基,能提供丰富的结合位点促进重金属吸附。本工作采用L-Glu改性GO,在GO表面引入氨基这一新的活性位点。采用静态吸附试验,研究L-Glu改性GO(L-Glu/GO)对Cu2+的吸附与脱附能力,以便为处理含Cu2+废水提供经验参考。
1 实验部分
1.1 试剂和仪器
L-Glu、KMnO4、无水乙醇:分析纯;天然鳞片石墨:分析纯;铜标准液:分析纯,Cu2+质量浓度为100 mg/L。
JSM-7500 F型扫描电子显微镜:日本JEOL公司;AA-6300型原子吸收分光光度计:日本岛津公司;Nicolet-460型红外光谱仪:美国赛默飞公司;Bruker D8型X射线衍射仪:德国布鲁克AXS公司。
1.2 实验方法
1.2.1L-Glu/GO材料的制备
采用Hummers法由石墨制备GO[11]。然后将0.4 gL-Glu和0.5 g KOH加入20 mL去离子水中溶解,再将溶液逐滴加入到100 mL 质量浓度为1.0 g/L 的GO分散液中,室温下超声分散均匀后,70 ℃水浴加热搅拌24 h;待混合液冷却至室温后加入乙醇,使L-Glu/GO析出,然后用乙醇、去离子水洗涤至上清液呈中性;最后,产物在50 ℃下真空干燥12 h。
1.2.2L-Glu/GO对Cu2+的吸附
配制质量浓度为1.0 g/L的L-Glu/GO分散液。将适量铜标准液和L-Glu/GO分散液加入150 mL锥形瓶中,使溶液中Cu2+质量浓度为10~70 mg/L,L-Glu/GO质量浓度为0.05~0.40 g/L,采用浓度为0.1 mol/L的NaOH、HCl溶液调节反应体系pH,以150 r/min的速率恒温振荡一定时间,过滤后取上清液,采用火焰法原子吸收分光光度计测定溶液中剩余Cu2+的质量浓度,计算Cu2+吸附量及去除率。
1.2.3L-Glu/GO的解吸
将吸附Cu2+后的L-Glu/GO离心分离,加入50 mL浓度为0.1 mol/L的HCl溶液,30 ℃下恒温振荡90 min,过滤后测定清液中Cu2+的质量浓度。用去离子水将解吸后的吸附剂洗涤若干次,随后于真空干燥箱中60 ℃下干燥至恒重,以备重复使用。解吸率的计算方法见式(1)。

式中:η为解吸率,%;q,q1分别为Cu2+的吸附量及解吸量,mg/g。
2 结果与讨论
2.1 L-Glu/GO的表征
2.1.1 SEM分析
GO改性前(a)后(b)及L-Glu/GO吸附Cu2+前(c)后(d)的SEM照片见图1。由图1a和b可见:GO改性前呈片层结构,表面含褶皱;经L-Glu改性后,表面含突出晶状颗粒,且仍保持原本GO的片层结构,表明L-Glu/GO复合成功。
由图1c可见,L-Glu/GO吸附Cu2+前表面含条纹沟壑、凹槽深浅不均,粗糙不平整且有颗粒黏附,具有片层状结构,这些结构有效增大了材料的表面积,有利于吸附更多Cu2+并向L-Glu/GO内部扩散,使更多的活性位点得到利用,从而提高L-Glu/GO对Cu2+的吸附容量[12]。
由图1d可见,L-Glu/GO吸附Cu2+后其表面条纹沟壑及片层状结构消失,变为表面密实、光滑的平块交接,原先的沟壑、凹槽可能因吸附了Cu2+而变得平整[13]。
2.1.2 FTIR分析
GO和L-Glu/GO的FTIR谱图见图2。由图2可见:GO在3 406 cm-1处的吸收峰归属于O—H键的伸缩振动,1 626 cm-1处的吸收峰归属于芳香环上的C=C双键伸缩,1 735 cm-1处的吸收峰归属于C=O双键伸缩振动[14],1 384 cm-1处的吸收峰归属于C—OH键的伸缩振动,1 054 cm-1处的吸收峰归属于环氧基特征吸收,表明GO上具有许多官能团如羧基、环氧基、羟基等,再次证明已成功制备GO;L-Glu/GO在3 418 cm-1处的吸收峰归属于O—H键的伸缩振动,在1 594 cm-1与1 384 cm-1处有新峰出现,分别归属于C—N键、N—H键的伸缩振动峰,此外,1 735 cm-1、1 054 cm-1处的峰消失,说明GO上的环氧基团与L-Glu上的氨基发生了亲核取代反应,进一步表明L-Glu已成功修饰在GO上。

图1 GO改性前(a)后(b)及L-Glu/GO吸附Cu2+前(c)后(d)的SEM照片

图2 GO和L-Glu/GO的FTIR谱图
2.2 L-Glu/GO对Cu2+的吸附性能
2.2.1 初始pH对吸附的影响
在L-Glu/GO投加量为0.300 g/L、吸附时间为120 min、Cu2+初始质量浓度为20 mg/L、吸附温度为30 ℃的条件下,初始pH对Cu2+吸附量的影响见图3。由图3可知,L-Glu/GO相对于GO对Cu2+表现出更好的吸附性能,随着初始pH的增加,吸附剂对Cu2+的吸附量在pH=3~4之间剧增,之后缓慢增加,在初始pH为7时GO与L-Glu/GO的Cu2+吸附量分别达55.010 mg/g及61.100 mg/g。造成这种现象的主要原由是当pH偏低时,溶液中带电正性的H+会与Cu2+争夺吸附剂上的结合位点[15],同时GO表面的羟基、羧基与L-Glu/GO表面的含氮官能团会被H+质子化而呈电正性,从而使得吸附剂与带正电的Cu2+产生相斥作用;而后随pH的增加,L-Glu/GO表面官能团去质子化增强,更多的结合位点得以暴露,从而增强吸附剂对重金属的吸附能力。另外,Cu2+容易在碱性条件下形成氢氧化物沉淀,使得在计算中将沉淀物质量计入吸附量中。为了充分反映L-Glu/GO对Cu2+的吸附性能,选取pH=5进行后续实验。
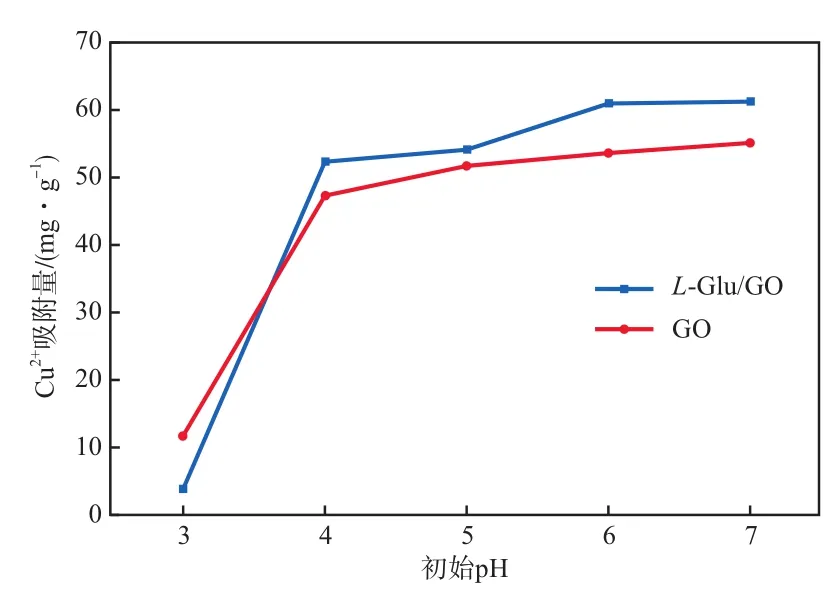
图3 初始pH对Cu2+吸附量的影响
2.2.2L-Glu/GO投加量对吸附的影响
在Cu2+初始质量浓度为20 mg/L、初始pH为5、吸附时间为120 min、吸附温度为30 ℃的条件下,L-Glu/GO投加量对Cu2+吸附效果的影响见图4。由图4可见:随L-Glu/GO投加量增大,Cu2+的吸附率先快速增长而后趋于平缓,而Cu2+吸附量逐渐减小;L-Glu/GO投加量达到0.200 g/L时,Cu2+去除率达89.87%,继续增大投加量时,Cu2+吸附率变化很小。产生这种现象的原因是吸附剂投加量的增多也增加了吸附剂的总吸附位点数,使得Cu2+吸附率增加。加大L-Glu/GO的投加量时,L-Glu/GO相互之间容易发生团聚,从而吸附剂有效结合位点数量降低,吸附剂比表面积降低,导致单位质量L-Glu/GO吸附Cu2+的质量下降即吸附量下降。综合考虑吸附量、去除率及经济效益等因素,选用0.200 g/L作为本实验最适L-Glu/GO投加量。
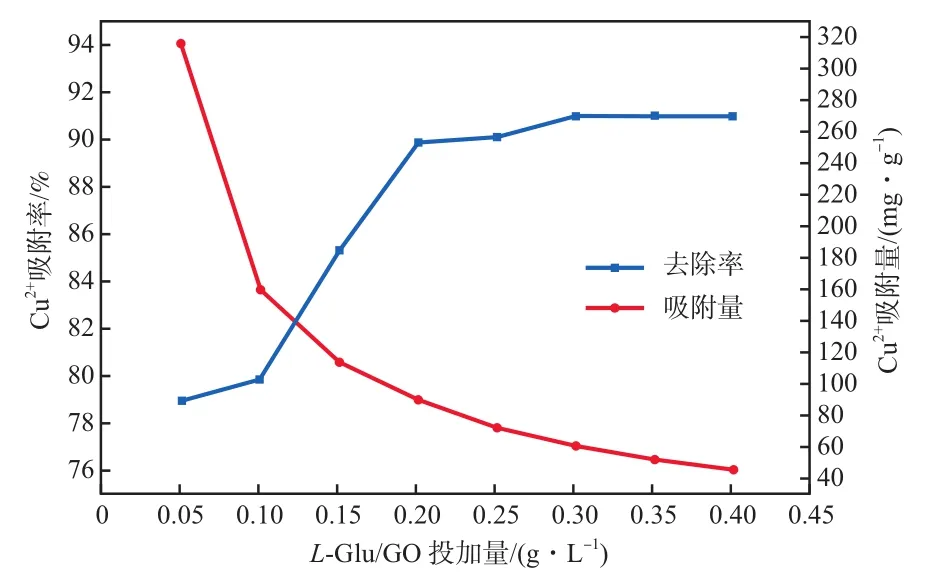
图4 L-Glu/GO投加量对Cu2+吸附效果的影响
2.2.3 吸附时间对吸附的影响及动力学研究
在Cu2+初始质量浓度分别为10,15,20 mg/L、初始pH为5、L-Glu/GO投加量为0.200 g/L、吸附温度为30 ℃的条件下,吸附时间对Cu2+吸附量的影响见图5。由图5可知,反应初始时L-Glu/GO对Cu2+的吸附非常迅速,在10 min内反应已经基本达到吸附平衡。这是由于L-Glu/GO比表面积大且表面含有丰富的吸附位点。在吸附前期,Cu2+被快速吸附到吸附剂表面。随着反应的进行,溶液中Cu2+含量急剧减少,吸附动力减弱,因而吸附速率渐渐变得缓慢,直至反应达到平衡。为使吸附充分,本实验的吸附时间均采用120 min。

图5 吸附时间对Cu2+吸附量的影响
采用拟一级动力学、拟二级动力学和内扩散模型来研究L-Glu/GO对Cu2+的吸附动力学,探讨其吸附机理。不同Cu2+初始质量浓度(ρ0)时L-Glu/GO对Cu2+的吸附动力学拟合参数见表1。由表1可见:准二级动力学模型的相关系数为1.000,且理论平衡吸附量(qe,cal)也与实际平衡吸附量(qe,exp)非常相近,表明准二级动力学模型对L-Glu/GO吸附Cu2+的过程拟合度更准确,其吸附过程以化学吸附为主;颗粒内扩散模型的拟合线未过原点,表明颗粒内扩散不是L-Glu/GO吸附Cu2+的速率控制步骤。

表1 不同Cu2+初始质量浓度时L-Glu/GO对Cu2+的吸附动力学模型拟合参数
2.2.4 Cu2+初始质量浓度对吸附的影响及吸附等温线研究
在Cu2+初始质量浓度为10~70 mg/L、初始pH为5、L-Glu/GO投加量为0.200 g/L、吸附时间为120 min、吸附温度30 ℃的条件下,L-Glu/GO 对Cu2+的吸附等温线见图6。由图6可见,随着Cu2+平衡质量浓度(ρe)的增大,L-Glu/GO对Cu2+的吸附量先快速增长,而后趋于稳定,最高达292.460 mg/g。原因是Cu2+初始质量浓度低时,吸附剂表面尚存在大量吸附位点未与Cu2+结合,导致此时吸附量较低;随Cu2+初始质量浓度的增大,吸附剂有效碰撞几率增大,吸附量增加。当吸附剂表面的吸附位点被完全占据后,吸附量趋于饱和[16]。
采用Langmuir、Freundlich和Temkin等温吸附方程拟合L-Glu/GO对Cu2+的吸附过程,得到的各模型拟合参数见表2。由表2可见,Langmuir模型的相关系数为0.999,证明以单层吸附为主要过程。此外,吸附过程是否有利于L-Glu/GO吸附Cu2+可以通过无量纲Langmuir模型分离因子RL(RL=1/(1+KLρ0)来反映[17]。当RL=0~1(或RL>1)时,表明吸附过程促进(或抑制)Cu2+的吸附;RL=0和RL=1分别表示不可逆吸附和线性吸附。本实验RL值随着ρ0逐渐增大而变小且趋于0,说明随着ρ0的增大,该吸附过程逐渐表现出不可逆的趋势[18]。
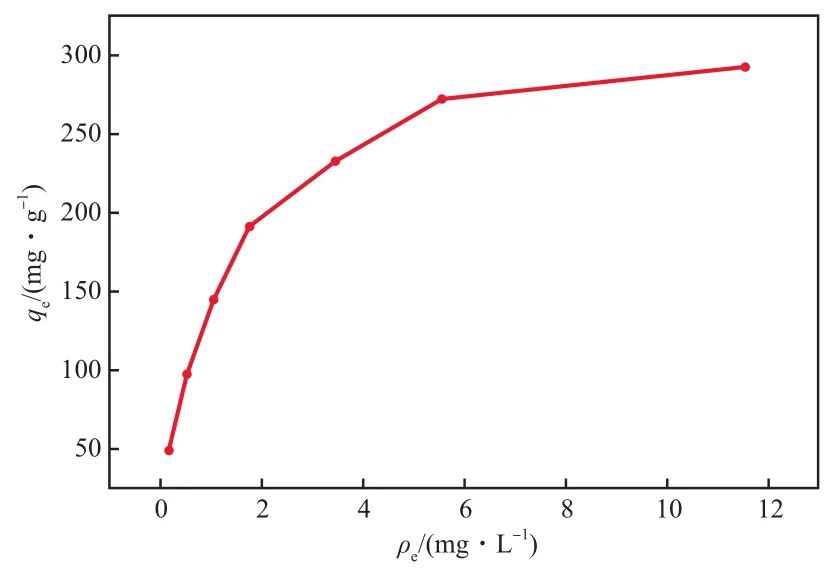
图6 L-Glu/GO对Cu2+的吸附等温线

表2 L-Glu/GO吸附Cu2+的Langmuir、Freundlich和Temkin等温吸附模型拟合参数
2.2.5 吸附温度对吸附的影响与热力学研究
在Cu2+初始质量浓度为70 mg/L、初始pH为5、L-Glu/GO投加量为0.200 g/L、吸附时间为120 min的条件下,吸附温度(以下以绝对温度计)对Cu2+吸附量的影响见图7。

图7 吸附温度对Cu2+吸附量的影响
由图7可见,随着吸附温度的增大,L-Glu/GO吸附量略有减小,312 K与293 K时的吸附量只相差3.808 mg/g,说明温度不是影响L-Glu/GO吸附Cu2+的主要因素。
为进一步考察温度对吸附过程的影响,对吸附过程进行熵焓变分析,见式(2)~式(3)[19]。

式中:ΔH为焓变,kJ/mol;ΔS为熵变,J/(mol·K);ΔG为吉布斯自由能变,kJ/mol。
通过ln(qe/ρe)对1/T进行线性拟合,计算出ΔS与ΔH,计算结果见表3。
由表3可见,ΔH<0,表明L-Glu/GO对Cu2+的吸附行为是放热反应,则降温有利于L-Glu/GO对Cu2+的吸附;ΔG为负值,说明反应是自发进行的;ΔS为负值,这说明此吸附过程渐渐趋向于有序。

表3 L-Glu/GO吸附Cu2+的热力学参数
2.3 L-Glu/GO的解吸性能
解吸率是一个反映吸附剂经济性的重要指标。吸附-解吸循环次数对L-Glu/GO的Cu2+吸附率和解吸率的影响见图8。由图8可见:L-Glu/GO的初次吸附率和解吸率较高,吸附-解吸循环3次后稍有下降且趋于稳定,原因可能是解吸后尚有部分Cu2+占据活性位点,导致再次吸附时有效结合位点减少;5次循环过程中L-Glu/GO对Cu2+吸附率的变化量逐渐减小,且吸附率仍高达92%,表明L-Glu/GO可再生能力强、经济效益好,是一种很有前景的吸附剂。
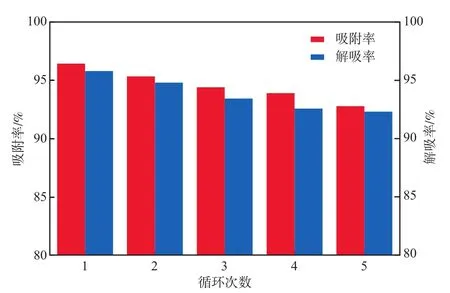
图8 吸附-解吸循环次数对L-Glu/GO的Cu2+吸附率和解吸率的影响
3 结论
a)采用Hummers法制备了GO,并经L-Glu改性得到L-Glu/GO。L-Glu/GO静态吸附Cu2+的实验结果表明:L-Glu/GO对Cu2+的吸附仅10 min即可达到平衡;在Cu2+初始质量浓度为70 mg/L、初始pH为5、L-Glu/GO投加量为0.200 g/L、吸附时间为120 min、吸附温度为30 ℃的条件下,L-Glu/GO的最大吸附量可达292.460 mg/g。
b)温度不是影响L-Glu/GO对Cu2+吸附效果的主要因素;准二级动力学和Langmuir模型对吸附过程的拟合效果更好;热力学参数ΔG、ΔS及ΔH均为负数,表明该吸附过程是一个主要受化学反应控制、自发放热的单分子层吸附。
c)经过5次吸附-解吸循环试验,L-Glu/GO对Cu2+的吸附率仍在92%以上,说明L-Glu/GO可重复利用性能好,应用价值较高。
