氯酸钠氧化盐酸酸洗废液制备聚氯化铁
2020-08-21张登峰
彭 健,朱 印,姚 雯,张登峰
(昆明理工大学 化学工程学院,云南 昆明 650500)
酸洗废液是指采用强酸使钢铁表面性质得到改善后排出的酸性废液[1]。钢材在深加工过程中通常使用盐酸对其表面进行酸洗除锈,产生的废液称为盐酸酸洗废液。盐酸酸洗废液对人类健康和环境均会造成危害,如何对其进行处理处置已成为一个受到广泛关注的问题[2-5]。
酸洗废液的处理方法早期主要为中和沉淀法,将酸洗废液中的重金属通过沉淀与水分离,使得废液可以达标排放[6-8]。但此方法的缺点是将大量宝贵的金属离子和酸液处理后又排放到环境中,即浪费了资源也未达到保护环境的目的。因此,自20世纪90年代以来,很多学者开展了对酸洗废液的综合利用研究,并取得了一系列的成果,主要包括生产铁盐循环再生[9]、制取颜料[10-11]、制备絮凝剂[12-14]等。
本工作以氯酸钠作为氧化剂,由盐酸酸洗废液制备可以作为混凝剂的聚氯化铁。考察了氧化剂加入量、浓盐酸加入量、反应时间、反应温度等因素对Fe2+转化率的影响,找出最佳反应条件,并对所得聚氯化铁产品进行了质量评价,以期为酸洗废液的资源化利用提供有效途径。
1 材料与方法
1.1 废液成分
将取自云南玉溪某钢厂的盐酸酸洗废液浓缩,以浓缩后的废液(以下简称废液)为实验对象,其成分如表1所示。

表1 废液成分 w,%
1.2 实验原理
利用氯酸钠的氧化性,直接将废液中的Fe2+氧化成Fe3+,该过程的主要化学方程式见式(1)。

该反应为本实验的主反应,FeCl2在强氧化剂NaClO3的作用下被氧化成FeCl3,该过程需要在一定的酸性环境下进行。在氧化反应开始之后,就是Fe3+的水解反应。Fe3+作为高价离子,与OH-有极强的亲和力,能够自发水解(见式(2))。

随着溶液酸度的升高,水合Fe3+离子发生配位水分子离解,与H2O中的OH-水解形成各种可溶解的单核羟基络合铁离子并释放出大量H+,而使溶液呈现极强的酸性(见式(3)和式(4))。

通常条件下,水解生成的铁单体络合形态强烈地趋向于聚合,其中最简单的是生成二聚体,即Fe2(OH)24+。水解过程和聚合过程同时发生,水解出来的单核羟基络合物开始聚合成多羟基络合物,最终产物是Fe(OH)3沉淀。上面两个副反应在中性或碱性环境(即OH-充足的溶液中)下进行时会非常迅速,如果不投加酸,其生成的Fe3+会迅速水解为Fe(OH)3沉淀,失去制备氯化铁的条件。因此,本实验设计者考虑加入浓盐酸,以提供充足的H+去抑制水解和聚合的发生[15]。此外,为了满足市场要求,使高浓度聚氯化铁保持稳定,还需加入稳定剂,本实验选取了含磷酸根的稳定剂磷酸二氢钾。
1.3 实验方法
取100 mL废液于三颈烧瓶中,用试管夹夹住烧瓶中间颈,将其固定于恒温水浴锅中(温度恒定,并保证烧瓶里的液体能够完全被水浴浸泡);将增力电动搅拌器从中间颈伸入,调节搅拌转速为5 r/s。加入一定量的浓盐酸(12 mol/L),然后加入一定量的氧化剂,最后加入稳定剂磷酸二氢钾(KH2PO4)0.3 g,塞上两边瓶塞后,开始反应。在反应过程中,溶液颜色由灰绿逐渐变成棕黄直至深棕红色,当溶液变成褐色甚至开始出现沉淀或者部分溶液出现分层现象时,证明反应已趋于结束。反应结束后,测定溶液中Fe2+的质量分数,并计算其转化率。继续熟化24 h,得到聚合氯化铁。
1.4 分析方法
按照文献[9]中的分析方法测定废液成分:Fe2+质量分数采用高锰酸钾氧化法,总铁质量分数采用重铬酸钾氧化法,Fe3+质量分数为二者之差;HCl质量分数采用酸碱滴定法,以NaF为铁锌等的掩蔽剂;在100 ℃恒温干燥箱干燥后称重,得到固体残渣质量分数;以二甲基酚橙为指示剂,采用EDTA标准溶液滴定,得到锌质量分数。
按照《水处理剂 聚氯化铁》(HG/T 4672—2014)[16]中的分析方法测定所制备的聚氯化铁的各项指标:Fe3+质量分数是以淀粉为指示剂,在酸性条件下用硫代硫酸钠标准滴定溶液滴定;Fe2+质量分数是以二苯胺磺酸钠为指示剂,在硫酸和磷酸介质中用重铬酸钾标准滴定溶液滴定;盐基度是在试样中加入过量盐酸,以氟化钾为掩蔽剂,以氢氧化钠标准滴定溶液滴定;水不溶物质量分数是试样用水溶解后,经过滤、洗涤、烘干至恒重后计算;密度是在20 ℃恒温水浴中采用密度计(MH-300G型,力辰科技公司)测量。
2 结果与讨论
2.1 氯酸钠加入量对Fe2+转化效果的影响
在浓盐酸加入量为12 mL、反应时间为30 min、反应温度为30 ℃的条件下,氯酸钠加入量对Fe2+转化效果的影响如图1所示。由图1可知,氯酸钠加入量对于Fe2+的氧化效率的影响至关重要。随着氧化剂氯酸钠加入量的逐渐增大,Fe2+转化率逐渐增高;其关键变化节点在氯酸钠加入量为6.5 g时,Fe2+转化率迅速增高到95.24%;氯酸钠加入量增至7.0 g时,转化率达98.51%,且变化趋势已经趋于平缓,不再有明显升高,说明反应已基本达到平衡阶段;当氯酸钠加入量为8.5 g时甚至出现了转化率降低的趋势,且过量的氧化剂会使生产成本增加。因此,将氯酸钠最佳加入量设定为7.0 g,以进行后续实验。曾小君等[17]研究发现,加入氧化剂理论化学计量的106%是合适的。本实验的最佳氧化剂加入量略高于理论化学计量的106%,这可能是由于废液中含有其他可被氧化的杂质。

图1 氯酸钠加入量对Fe2+转化效果的影响
2.2 浓盐酸加入量对Fe2+转化效果的影响
在氯酸钠加入量为7.0 g、反应时间为30 min、反应温度为30 ℃的条件下,浓盐酸加入量对Fe2+转化效果的影响如图2所示。分析图2发现:随着浓盐酸加入量的增大,Fe2+的转化率持续升高;当浓盐酸的加入量增至8 mL时,转化率的变化趋于稳定;当浓盐酸加入量为8~12 mL时,Fe2+转化率较高,在98%以上;而当浓盐酸的加入量增至14 mL时,Fe2+转化率出现下降趋势。pH的降低会使聚氯化铁黏度变大,有利于贮存和提高絮凝性能[17]。综合考虑,选择浓盐酸加入量为12 mL。

图2 浓盐酸加入量对Fe2+转化效果的影响
上述结果表明,浓盐酸的加入量会对氯酸钠的氧化性能产生重要影响。酸的加入,一方面可以促进氧化反应的正向进行,另一方面还可抑制Fe3+的水解,阻止其沉淀产生Fe(OH)3,因此转化率迅速升高;随着反应的进行,盐酸加入量的增大反而导致转化率下降,这是由于溶液中的H+过多会抑制后续的水解反应和聚合反应,使溶液中难以生成单核羟基络合物,更无法形成聚氯化铁。邱慧琴等[18]在利用盐酸酸洗废液制备聚氯化铁时,得出料液中HCl与总Fe的质量比控制在0.45~0.55时,产品可达质量要求。本实验的最佳盐酸加入量与之吻合。
2.3 反应时间对Fe2+转化效果的影响
在氯酸钠加入量为7.0 g、浓盐酸加入量为12 mL、反应温度为30 ℃的条件下,反应时间对Fe2+转化效果的影响如图3所示。由图3可知,Fe2+的转化率是随着时间变化的。反应初期,Fe2+转化率随着反应时间的延长而迅速升高,原因是此时溶液中的Fe2+浓度高,反应很快,因此氧化效率高;20 min后反应开始变慢,这是由于溶液中的Fe2+大部分已经转化为Fe3+;30 min后Fe2+转化率基本不再变化,反应趋于平衡状态。综上,选择反应时间为30 min。

图3 反应时间对Fe2+转化效果的影响
2.4 反应温度对Fe2+转化效果的影响
在氯酸钠加入量为7.0 g、浓盐酸加入量为12 mL、反应时间为30 min的条件下,反应温度对Fe2+转化效果的影响如图4所示。
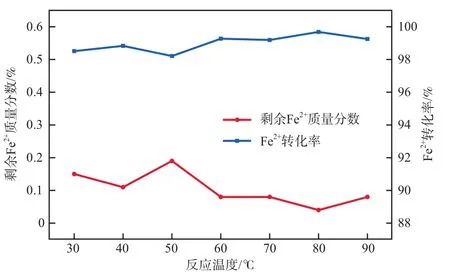
图4 反应温度对Fe2+转化效果的影响
由图4可知,反应温度对Fe2+的转化率影响较小,转化率并未呈现出与温度相同的变化趋势,而是在30~90 ℃间保持在一定范围内波动。这是因为:该反应为放热反应,开始阶段升高温度能使其达到合适的反应条件,加快反应速率;随着温度的升高,反应趋于平衡,产生的热量不易释放,且过高的温度会使溶液中的酸挥发,导致盐酸不足而使反应停滞;此外,温度过高还会引起氧化剂部分分解,氧化剂有效浓度降低,不利于氧化、水解和聚合反应的进行。综上,本实验的最佳反应温度控制在30 ℃即可。
2.5 产品指标
将本实验制备的聚氯化铁的各项指标与《水处理剂 聚氯化铁》(HG/T 4672—2014)对比,结果如表2所示。由表2可见,制备的聚氯化铁产品的各项指标均达到了行业标准。

表2 产品指标与行业标准指标的对比
3 结论
a)实验结果表明,氯酸钠对Fe2+氧化效果显著,在酸性环境下可以快速将盐酸酸洗废液中的二价铁氧化为三价铁,Fe2+转化率可达98.51%,得到的聚氯化铁产品符合《水处理剂 聚氯化铁》(HG/T 4672—2014)标准。
b)采用氯酸钠氧化盐酸酸洗废液制备聚氯化铁的最佳工艺条件为:每处理100 mL废液需加入7.0 g氯酸钠、12 mL浓盐酸(12 mol/L)、0.3 g磷酸二氢钾,反应温度30 ℃,反应时间30 min,搅拌转速5 r/s。
c)利用盐酸酸洗废液制备聚氯化铁,为酸洗废液的综合利用提供了可行途径,同时为混凝剂的应用提供了廉价原料,具备较好的经济效益和环境效益。
