灰化苔草对不同水位环境的生理适应性
2020-08-19尧晓晨郑国砥李梦涵汤思文许令明
尧晓晨,曹 昀,郑国砥,李 枭,李梦涵,汤思文,许令明
1 江西师范大学地理与环境学院,南昌 330022 2 中国科学院地理科学与资源研究所环境修复中心, 北京 100101 3 江西师范大学鄱阳湖湿地与流域研究教育部重点实验室,南昌 330022
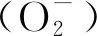
灰化苔草(Carexcinerascens)属莎草科苔草属,根状茎,丛生型多年生草本植物,分布于我国华东和华中地区,是鄱阳湖洲滩分布最广、面积最大的优势物种,对鄱阳湖湿地生态系统功能的发挥起着重要作用[14]。目前关于水位与植物的研究多集中在稳定水环境与植物生理生态响应之间的研究,有学者针对番茄(Solanumlycopersicum)[15]、茄子(Solanummelongena)[16]、绵毛水苏(Stachyslanata)[17]、花揪树(Sorbuspohuashanensis)[18]在水分胁迫或淹水胁迫环境中植物生理生化响应特性开展了相应的研究。对于水位变化与植物之间的研究更多的关注于植物种群与生物量的室外观测分析研究[19-25]。而对于长期生长在水位变化环境中植物生理特性变化研究较少、对于灰化苔草在不同水环境中的生理特性研究尚无报道。本文通过室内模拟试验,研究不同水位环境下灰化苔草生理生化与水位变化之间的响应关系,以明确鄱阳湖湿地中灰化苔草在节律性水文变化背景下其生理响应机制。为进一步揭示湿地植被群落演替机制与分布格局提供数据支持,同时为湿地水文调控、生态恢复与生物多样性保护提供重要科学依据。
1 材料和方法
1.1 试验材料与设计
试验采用双套盆法进行,试验地点为江西师范大学鄱阳湖湿地与流域研究教育部重点实验室植物阳光房、温度为(22±5)℃,光照为自然光照。试验材料于2019年3月15日从南矶湿地国家自然保护区灰化苔草典型分布区(28°55′45″N,116°19′26″E)采取的幼苗植株,先将采集回实验室的灰化苔草栽培于17 cm×18 cm盆中进行预培养,基质为采自鄱阳湖湿地的草甸沼泽土(pH值为5.36,有机质和全氮含量分别为42 g/kg和19.6 g/kg)。4月10日,随机选取长势一致植株放入试验所用有机玻璃桶中、每组平行试验3盆,选取株高大致一致(65—70 cm)的植株每盆10株。每个玻璃桶在距底部10 cm处有直径为4 cm小孔,平时用橡胶塞密封,可用于调节玻璃桶中水位的高度。
试验时间为2019年4月10日—5月20日、共计40 d。上升、下降、稳定水位各设置7个水位梯度组,共21个试验组与水位0 cm(即试验桶中水位刚好没过培养盆培养基质表面)对照组。稳定与下降水位的初始水位分别为8、16、24、32、40、48、56 cm,上升水位试验组初始水位为0 cm,上升和下降变化强度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4 cm/d,稳定水位在试验期内保持水位恒定。即5月20日时下降水位各试验组水位均为0 cm、上升水位各试验组分别为8、16、24、32、40、48、56 cm。每天19:00对各试验组进行水位处理、调节到当日既定水位。
1.2 试验指标测定
试验对各试验组的有机玻璃桶内3个培养盆分别剪取未发黄的水面上苔草叶片进行各指标的测定。测试时间在水位变化前(4月10日)测定一次作为初始参考数据。而后每隔10 d测定1次,水位处理结束后5天(5月25日)再次测定作为最终值。
SOD活性采用氮蓝四唑(NBT)测定,POD活性则是通过愈创木酚在过氧化物酶催化下能被过氧化氢氧化显色进行测定,CAT活性采用紫外吸收法,硫代巴比妥酸法测定丙MDA含量,考马斯亮蓝法测定可溶性蛋白,可溶性糖含量测定参考蒽酮比色法,采用磺基水杨酸法测定叶片脯氨酸含量[26],超氧阴离子产生速率采用羟胺氧化法进行测定[27],每个试样3个重复。
1.3 数据处理与分析
试验数据采用Excel 2010和Origin 2018进行数据处理与制图。SPSS 22.0 软件对测定数据进行统计分析处理,通过单因素方差分析,探讨水位变化对灰化苔草的生理影响、采用LSD进行组间多重比较。采用双因素方差分析不同类型水环境条件下水位强度与时间及两者交互效应对灰化苔草生理影响。
2 结果与分析
2.1 抗氧化酶活性
2.1.1SOD活性
SOD活性在不同的水环境条件下表现不同的变化趋势,据表1在不同水环境下,处理强度与时间、以及处理强度和时间的交互效应对SOD活性影响均显著(P<0.05)(表1)。在稳定水位中,各不同水位处理试验组SOD活性均高于对照组,且在32—56 cm水位梯度中随时间变化先增加后减少、差异性显著(P<0.05),而在8—24 cm范围内SOD活性表现为先增加后趋于稳定。下降水位中,SOD活性随时间先增后减、且各变化强度SOD活性在30—45 d时间范围内无显著性差异(P>0.05)。上升水位在0.6—1.0 cm/d变化强度SOD活性持续增加。3种水环境处理在试验期10—20 d内,SOD活性随水位变化强度增加持续增加,30—45 d的SOD活性先增后减,且不同水位组之间差异性显著(P<0.05)。在0.2—0.6、1.2—1.4 cm/d变化范围内,上升和下降水位SOD活性变化形式一致。在变化强度0.8、1.0 cm/d下,SOD活性持续上升/下降(图1)。
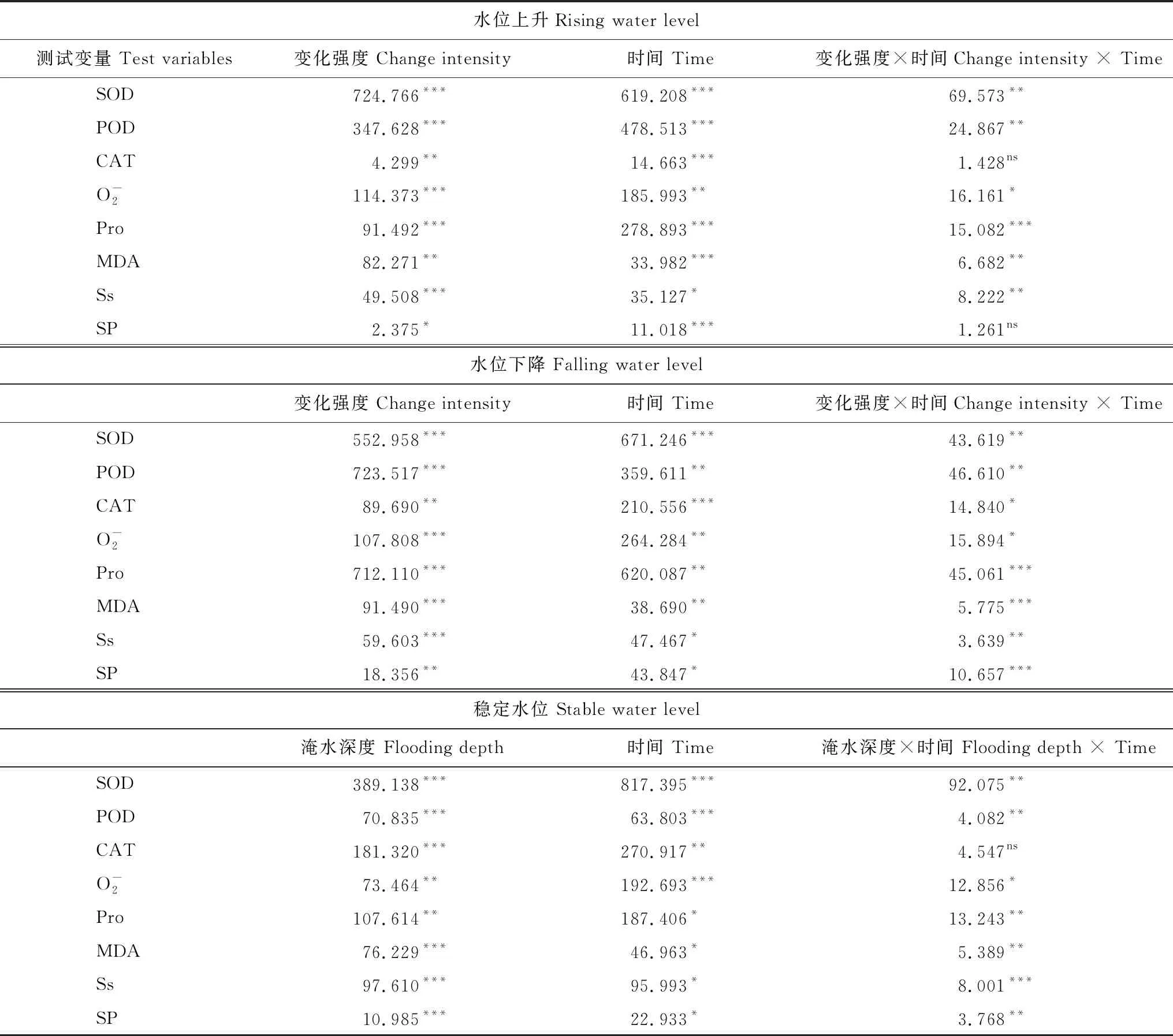
表1 灰化苔草生理指标的双因素方差分析(F值)
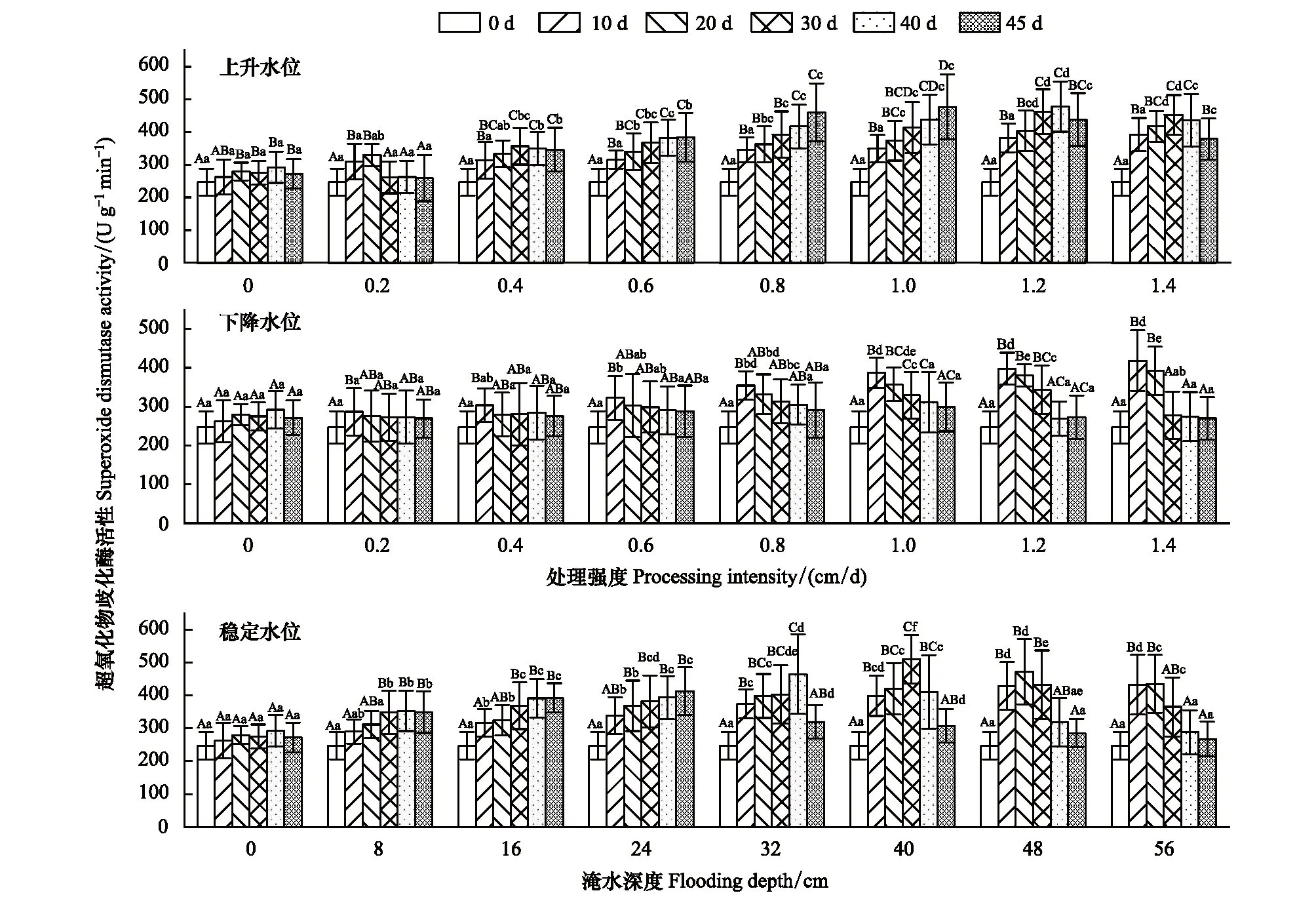
图1 不同试验条件对灰化苔草超氧化物歧化酶活性的影响Fig.1 Effects of different test conditions on Superoxide dismutase (SOD) activity of C. cinerascens柱形图中不同大写字母表示同一水环境处理不同时间测得的指标有显著性差异(P<0.05),不同小写字母表示同一时间不同水环境处理测得的指标有显著性差异(P<0.05)
2.1.2POD活性
双因素方差分析表明,在3种水环境条件下、POD活性受水位、时间及其交互作用影响显著(P<0.05)(表1)。POD活性在不同类型水环境、不同处理强度下随时间的变化趋势不同。稳定水位中,不同淹水梯度中的POD活性随时间变化先上升后下降。上升水位中POD活性随时间持续增加,但随处理强度的增加、增幅随时间变化而减小。下降水位中,在0.2 cm/d的变化强度下、POD活性在30—45 d内与对照组无显著差异(P>0.05),0.4—0.8 cm/d先下降后上升,而1.0—1.2 cm/d范围中的POD活性先下降后上升再下降,而1.4 cm/d强度下,POD活性持续上升。3种水环境类型的不同处理强度的POD活性在10—20、20—30、30—40 d的3个时间范围内中变化较为显著(P<0.05),上升、下降与稳定水位POD活性最大增幅分别为; 79.46%(1.2 cm/d、20—30 d)、117.31%(0.8 cm/d、20—30 d)、228.84%(0.8 cm/d、20—30 d)(图2)。
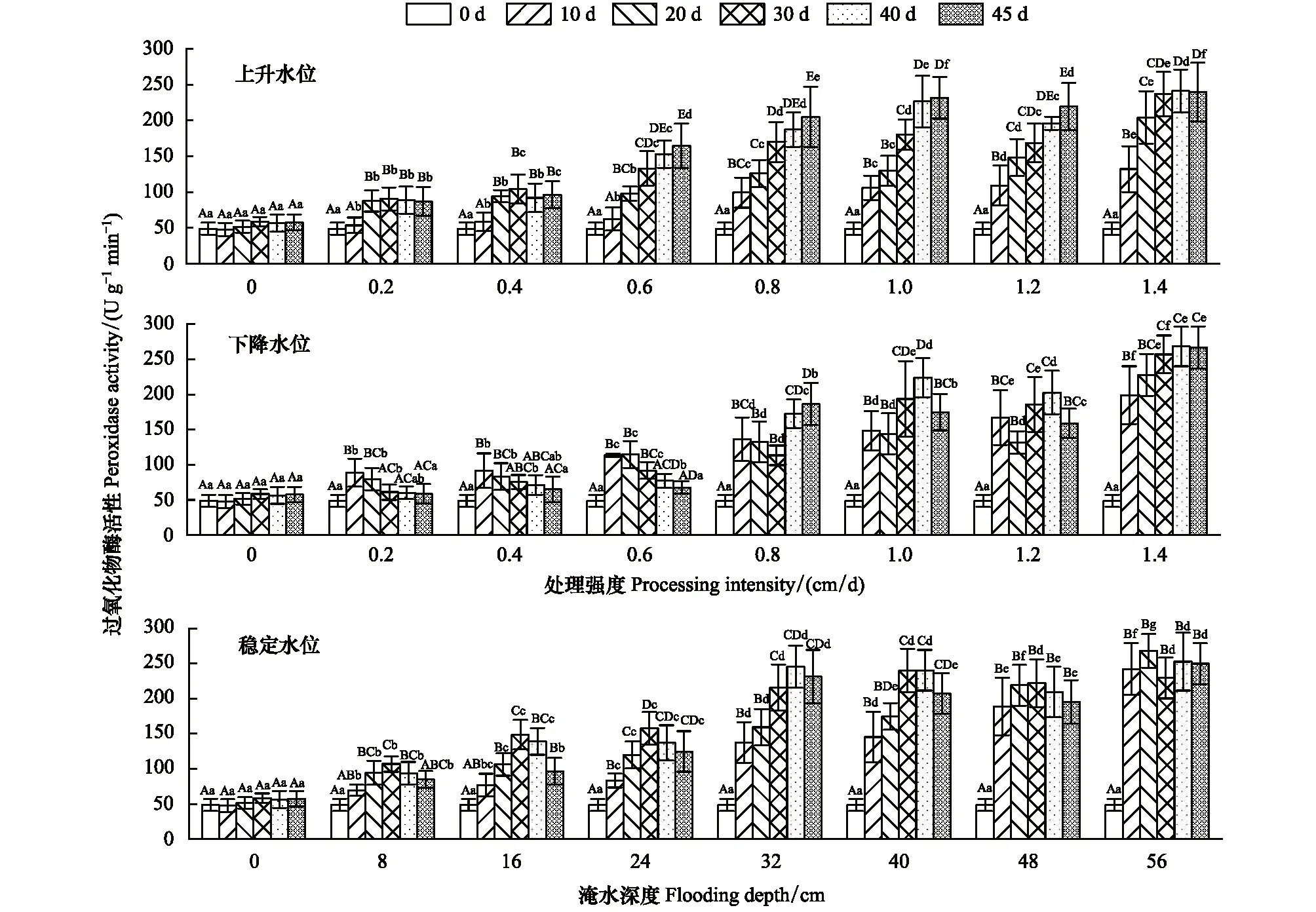
图2 不同试验条件对灰化苔草过氧化物酶活性的影响Fig.2 Effects of different test conditions on peroxidase (POD) activity of C. cinerascens
2.1.3CAT活性
通过时间和水位的双因素方差分析可知,CAT活性在不同类型水环境条件下与水位、时间及两者间交互效应的显著性水平不同(表1),CAT活性变化趋势与SOD活性一致。各不同水位试验组中,除上升水位处理的0.2—0.8 cm/d CAT活性持续增加外,其余均表现为先增加后减少趋势,并且在同一试验水位强度处理组内CAT活性峰值出现时间随处理强度的增加而提前。上升与下降水位在0.4—1.4 cm/d范围相邻时间点CAT活性变化幅度较大、差异性显著(P<0.05、P<0.001),3种水位类型的CAT活性在10、20 d随水位梯度的变化幅度较大,CAT差异极显著(P<0.001),30 d—45 d差异显著(P<0.05)。在变化水位0.2—0.6 cm/d和稳定水位8—24 cm范围内CAT活性随时间的变化差异显著(P<0.05),而在变化水位0.8—1.4 cm/d和稳定水位32—56 cm范围内CAT活性随时间变化差异性较为显著(P<0.01)(图3)。
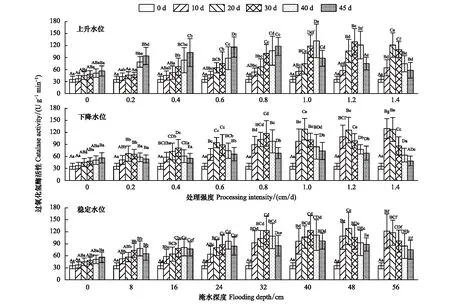
图3 不同试验条件对灰化苔草过氧化氢酶活性的影响Fig.3 Effects of different test conditions on catalase (CAT) activity of C. cinerascens
2.2 渗透调节物质
2.2.1脯氨酸
双因素方差分析表明,脯氨酸含量在上升水位中与处理强度、处理时间及其两者的交互效应差异性极显著(P<0.001),在下降变化与稳定水位环境下影响显著(P<0.05)(表 1)。稳定水位中,各不同水位试验组的脯氨酸含量均高于对照组、且差异显著(P<0.05),在不同水位梯度的脯氨酸含量随时间变化由持续增加到先增加后减小变化。在上升水位中,不同处理强度间脯氨酸含量随时间变化与稳定水位一致、最大值为133.88 μg/g(45 d、1.0 cm/d)。脯氨酸含量在下降水位的七个处理强度内随时间变化具有一致性,均为先增后减,并且在0.2、0.4 cm/d处理中脯氨酸含量在试验中后期维持在较低水平,甚至低于对照组脯氨酸含量。在1.2、1.4 cm/d处理中脯氨酸含量在上升与下降水位都呈现先升后降(图4)。
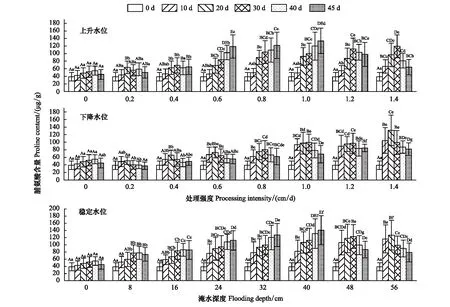
图4 不同试验条件对脯氨酸含量的影响Fig.4 Effects of different test conditions on Proline (Pro) content of C. cinerascens
2.2.2可溶性蛋白含量
可溶性蛋白含量在不同类型水环境下处理强度、处理时间及其交互效应间的差异性显著(P<0.05)(表1)。稳定水位中;在水位梯度8—32 cm深度范围内,试验中前期(0—30 d)可溶性蛋白含量无显著性差异(P>0.05),在试验后期(30—45 d)可溶性蛋白含量显著增加。下降水位中,0.2—0.4 cm/d试验组的可溶性蛋白随时间无显著变化(P>0.05),0.6—1.4 cm/d范围内可溶性蛋白含量呈现U型曲线变化,且随变化强度的增加可溶性蛋白含量差异性越显著。上升水位中,0.2—0.8 cm/d处理范围内,除30 d外可溶性蛋白含量随时间变化均无显著性差异(P>0.05)。上升水位在1.0—1.4 cm/d与下降水位0.6—1.4 cm/d范围的试验组可溶性蛋白含量变化趋势一致。各试验组在0—20 d内可溶性蛋白含量变化幅度相对较小(图5)。
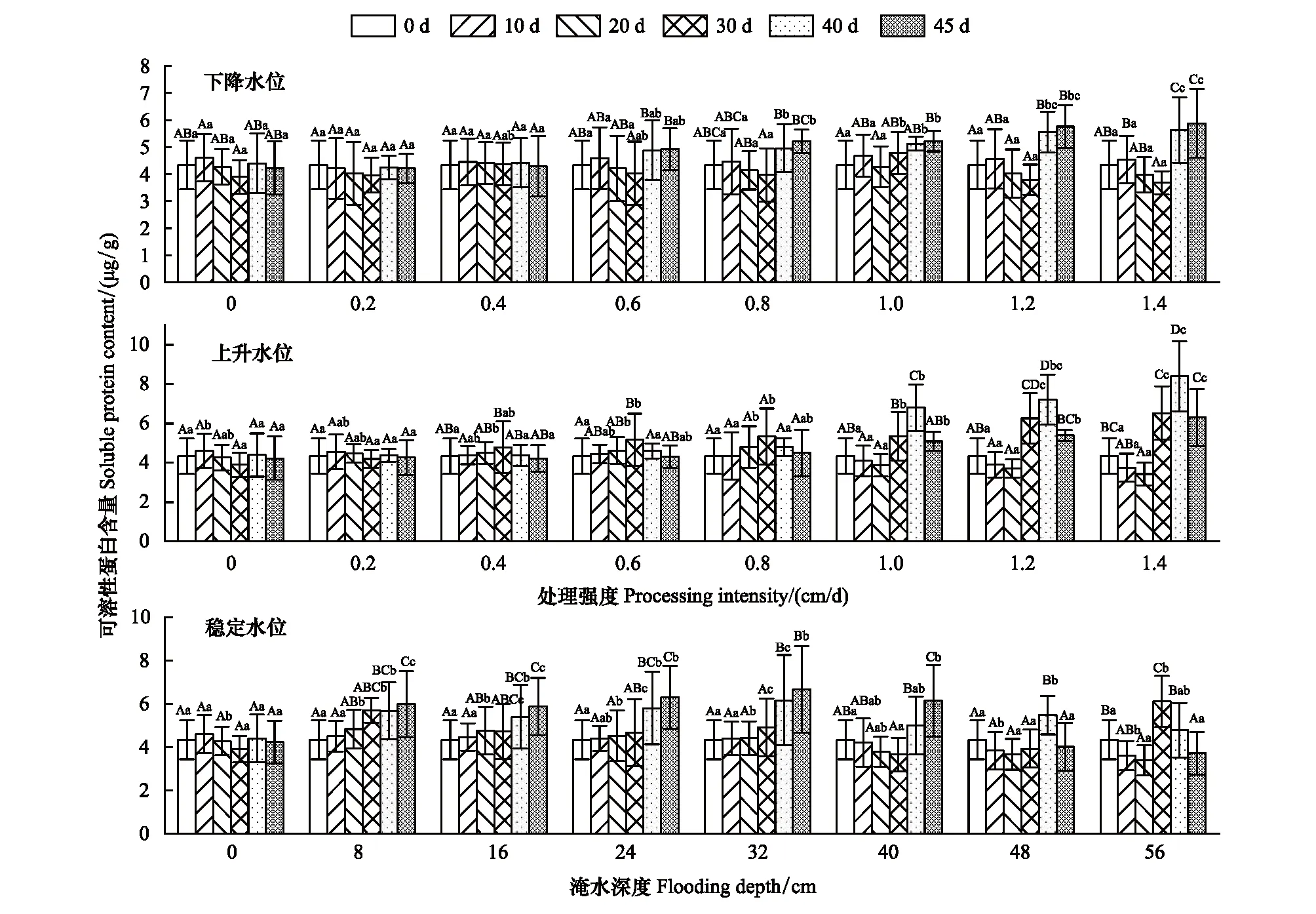
图5 不同试验条件对灰化苔草可溶性蛋白含量的影响Fig.5 Effects of different test conditions on soluble protein (SP) content of C. cinerascens
2.2.3可溶性糖含量
可溶性糖含量与试验处理强度、淹水深度与时间交互作用呈极显著相关(P<0.001),与上升、下降变化的时间与变化强度的交互作用呈现较显著相关(P<0.01),与其他因素显著相关(P<0.05)(表1)。可溶性糖含量在不同水环境下变化趋势与可溶性蛋白大致一致。在稳定水位的8—32 cm与0.8 cm/d的上升变化试验组中,可溶性糖含量随时间变化持续增加、且在20—30 d时间范围内增幅最大。在0.2—0.4 cm/d与8—16 cm范围内不同水位梯度试验组中可溶性糖含量在10 d、20 d间无显著性差异(P>0.05)。40—56 cm范围内淹水强度与可溶性糖含量变化幅度成正比。上升变化中,在相同时间下,0—0.4 cm/d范围变化强度下可溶性糖含量随处理强度变化无显著性差异(P>0.05)。下降水位0.2 cm/d与上升水位0.4 cm/d的试验组可溶性糖含量与对照组之间无显著性差异(P>0.05)(图6)。
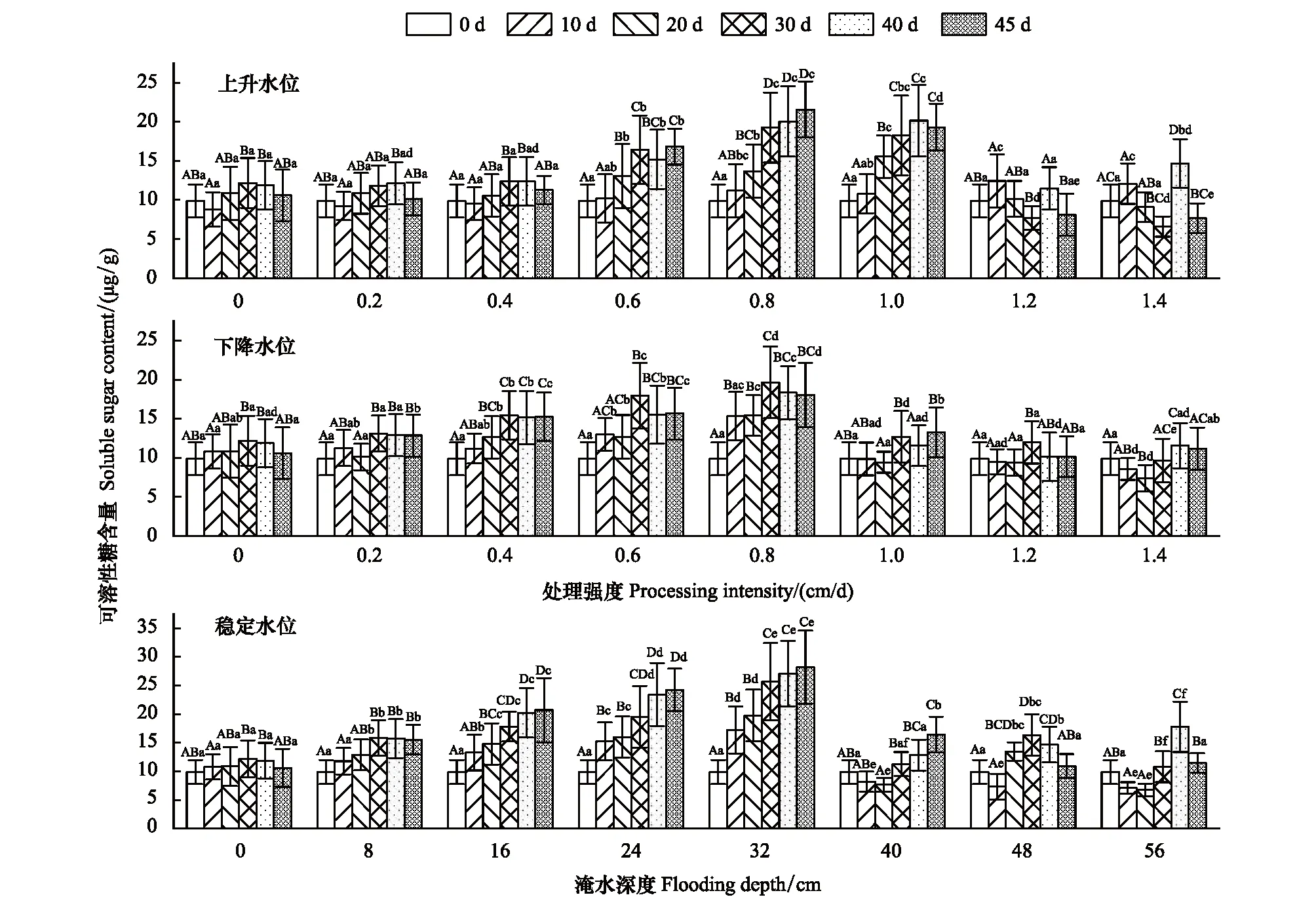
图6 不同试验条件对灰化苔草可溶性糖含量的影响Fig.6 Effects of different test conditions on soluble sugar (Ss) content of C. cinerascens
2.3 细胞膜脂过氧化程度
2.3.1超氧阴离子产生速率
从表1可知超氧阴离子产生速率受水位影响显著性水平最高(P<0.001),时间和水位交互影响显著性水平较低(P<0.05)(表1)。稳定水位中,在不同淹水深度内超氧阴离子产生速率随时间变化呈现U型变化,且在相同时间下超氧阴离子产生速率随淹水深度的整体表现为增加趋势。同一试验处理时间内上升和下降水位的超氧阴离子产生速率均随处理强度的增加而持续增加,且超氧阴离子产生速率最大值均在水位深度最大处(45 d、1.4 cm/d,10 d、1.4 cm/d)。在0.2、0.4 cm/d试验条件下超氧阴离子产生速率在与对照组差异不显著(±15 mol g-1h-1)。在0.6—1.0 cm/d处理强度下上升和下降水位超氧阴离子产生速率表现形式一致,随时间变化先上升/下降后趋于稳定,在1.2、1.4 cm/d试验组中超氧阴离子产生速率随时间持续上升/下降,各组之间差异性显著(P<0.05)(图7)。
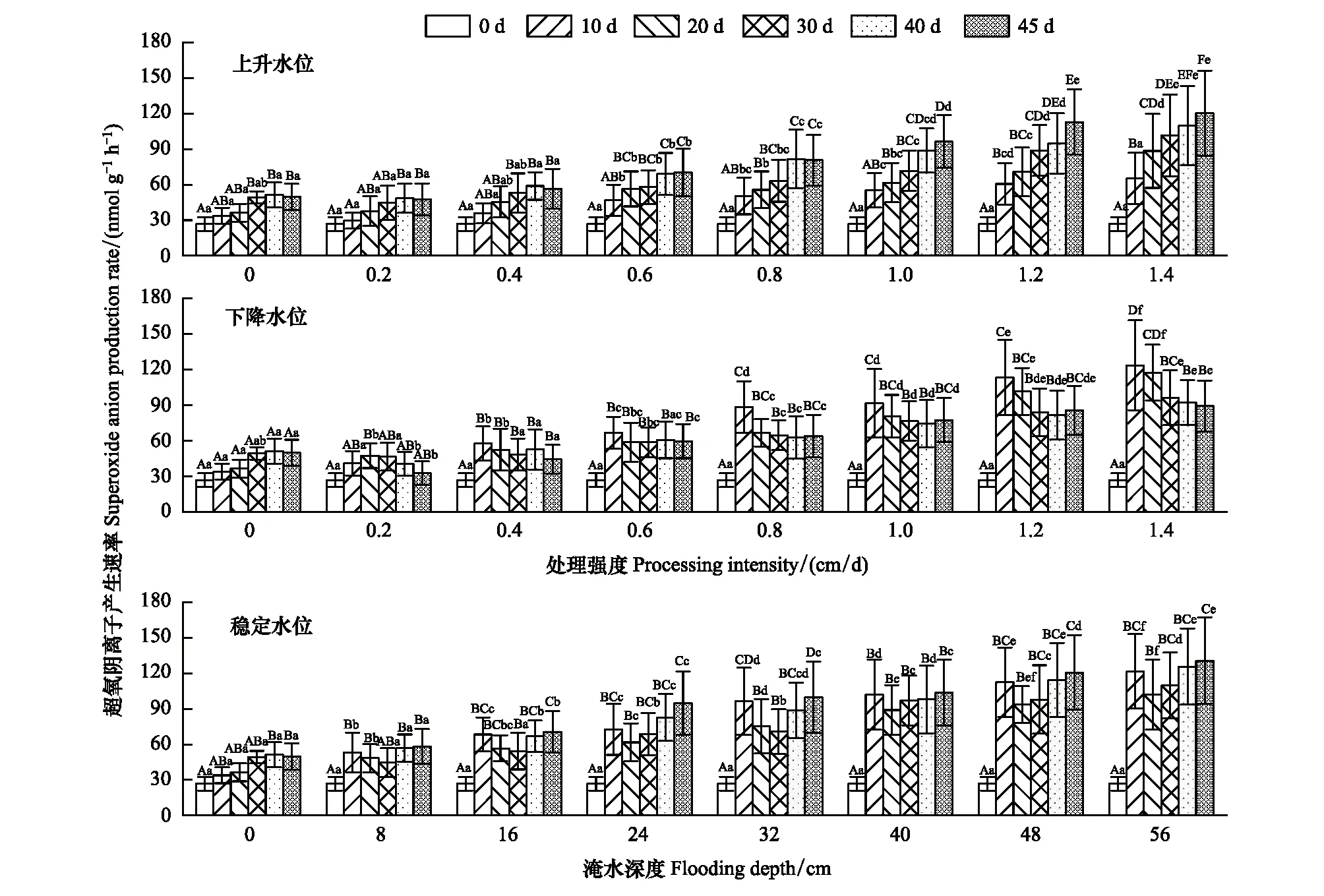
图7 不同试验条件对灰化苔草超氧阴离子产生速率的影响Fig.7 Effects of different test conditions on superoxide anion production rate of C. cinerascens
2.3.2丙二醛含量
丙二醛(MDA)含量在上升水位中变化强度与时间之间的交互效应下差异性不显著(P>0.05),其他水环境处理下差异性显著(P<0.05)(表 1)。不同水环境中MDA含量变化趋势与超氧阴离子产生速率一致。在3种水位处理中,MDA含量均随处理强度的增加而增加。稳定水位与下降水位环境MDA含量变化类似,在8—32 cm、0.2—0.8 cm/d的水位环境中,MDA含量变化幅度较小,40—56 cm、1.0—1.4 cm/d梯度范围内MDA含量先下降后急剧升高,并且处理强度与MDA含量变化幅度呈正相关。上升水位中0.2 cm/d和0.4 cm/d的MDA含量与对照组无显著性差异(P>0.05),0.6 cm/d与0.8 cm/d变化强度下MDA含量随时间先增后减,1.0—1.4 cm/d强度范围内MDA含量持续增加。3种水位环境中MDA含量最大值均出现在试验时间45 d,试验处理强度最大(1.4 cm/d、56 cm)时(图8)。
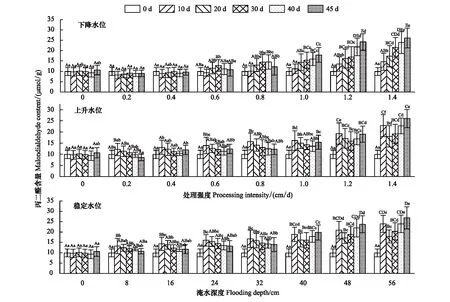
图8 不同试验条件对灰化苔草丙二醛含量的影响Fig.8 Effects of different test conditions on Malondialdehyde (MDA) content of C. cinerascens
3 讨论
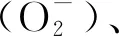
3.1 植物抗氧化系统对变化环境的响应
在本试验中,灰化苔草生理特性对水位变化较为敏感,在稳定水位处理组中;试验10 d,SOD和CAT活性上升应对淹水环境。在30—45 d时的SOD和CAT变化表明灰化苔草能较好的适应24 cm以下的淹水环境(图1、图3),而48 cm以上淹水深度超过植物耐受范围、从而导致植物细胞保护酶受损,表明植物忍耐逆境胁迫的能力有限[39-41]。植物在变化环境中为了适应水位变化环境,湿地植物通常会做出相应的调整响应,以维持自身的生存和生长以减小水位变化对自身的伤害[42-43],并且存在适宜范围[44],在本研究中0.4 cm/d与1.2 cm/d变化强度下抗氧化酶活性与MDA含量的显著差异性变化表明该变化强度可能是灰化苔草耐受的临界值(图1—图3、图8)。在试验过程中POD活性与SOD、CAT活性变化的差异性,尤其与SOD间的差异性变化表明POD与SOD存在明显的补偿机制(图1—图3),这与张虎等[45]对湖北海棠(Malushupehensis)叶片淹水胁迫下的结果一致。在试验后期以及高强度的水位变化/淹水环境下POD活性的变化(图3),可能由于在后期POD对灰化苔草的伤害效应导致,这与淹水胁迫下虉草(Phalarisarundinacea)的研究结果一致[46]。
3.2 渗透调节物质对水位变化环境的响应
渗透调节是植物应对逆境胁迫的一种重要方式,植物通过渗透调节物质以调节细胞渗透势、从而缓解逆境环境对的细胞的伤害[47-49]。因此水生植物在适应环境变化的过程中,经常伴随着渗透物质含量的变化。在本研究中,试验开始时,脯氨酸与可溶性糖含量显著高于对照组(图4、图6),说明此时植物主动积累脯氨酸与可溶性糖调节细胞膨压、以应对水位变化导致的逆境环境。可溶性蛋白含量在试验开始时无明显变化可以解释为正常蛋白合成受到抑制,而后发生显著变化、并与可溶性糖含量变化趋势具有一致性(图5、图6),说明新蛋白的合成与酶活性明显提高。随着时间与处理强度的增加,细胞膜脂过氧化程度加剧。在上升与稳定水位0—1.0 cm/d、0—40 cm处理强度下,脯氨酸含量强度下持续增加(图4),表明通过脯氨酸含量变化以应对环境变化是灰化苔草生长过程中的重要方式,与长喙毛茛泽泻(Ranalismarostratum)在不同水深下脯氨酸含量变化一致[50],而在1.2、1.4 cm/d与48、56 cm处理强度的30—45 d时脯氨酸的下降(图4),表明该处理强度超过植物本身的耐受范围。
3.3 水位环境对细胞质膜的影响
质膜是细胞内外部环境的动态屏障,是细胞物质交换和信息传递的重要通道。植物在受到逆境胁迫时,质膜功能或结构被破坏,膜透性增加,这是膜损伤和变性的重要标志。在本研究中,与对照相比,除0.2 cm/d变化强度外、各组MDA含量、超氧阴离子产生速率均有所增加、且以稳定水位最为显著(图7、图8),因而稳定水位对膜透性损伤较为严重。试验0—20 d,MDA增幅较小、超氧阴离子产生速率的微小变化或先增后减的变化趋势与SOD、POD的急剧增加对比说明(图1、图2、图7、图8),此时抗氧化酶的协同作用在一定程度上对于丙二醛含量和超氧阴离子的产生有所影响。试验高强度处理组(1.2 cm/d、1.4 cm/d、48 cm、56 cm)MDA含量与超氧阴离子产生速率的高数值表明(图8)在该环境下,植物处于高强度淹水逆境胁迫、植物细胞膜系统受到一定程度损伤,从而导致植物细胞内有害物质的持续增加。
4 结论
综上所述,灰化苔草在稳定与变化水位中,当植物受到胁迫时,会通过调节MDA含量、抗氧化酶活性、渗透调节物质等以响应逆境环境。在稳定水环境中,试验所设置淹水梯度均使灰化苔草受到不同程度逆境胁迫,主要表现为植物内稳态平衡的破坏、细胞膜质过氧化。在8、16 cm淹水梯度下、灰化苔草生理能快速适应水位环境,24—40 cm淹水范围内、灰化苔草通过调节各物质的含量对淹水环境进行适应性响应,而在48、56 cm淹水梯度下,淹水梯度超过植物阈值、植株开始出现枯萎死亡现象。在变化水位中,灰化苔草表现较强的调节能力,在0.2 cm/d的变化强度下、植物长势优于对照组,各生理指标较好,在0.4—1.2 cm/d的变化范围内,植物对变化水位环境的适应时间与变化强度成正比。在1.4 cm/d的变化强度下,灰化苔草细胞膜结构受损,超过植物调节极限。因此,以灰化苔草对湿地进行生态恢复时,应避免长期的淹水环境,而对生境中水位变化进行低强度的调控有助于调节植株生理代谢过程。
