温度对海月水母螅状体生长及繁殖的影响
2020-08-19王爱勇王小林刘修泽
段 妍,孙 明,董 婧,柴 雨,王爱勇,王小林,刘修泽,王 彬,吉 光
辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,大连市渔业资源养护重点实验室, 大连 116023
近年来,在全球许多海区出现了胶质水母数量增加甚至暴发的现象,引发了一系列生态和经济问题[1- 3],如堵塞网具、破坏沿岸设施、蛰伤游泳者等[4- 6]。海月水母是东亚海域最常见的致灾水母种类[7- 8],在中国、日本、韩国均出现过大规模暴发现象[9- 11]。近些年,黄渤海海月水母数量呈现逐年增加的趋势,已经成为海区大型水母的优势种[12]。海月水母的大规模暴发给沿岸人类的生活、渔业资源以及海洋生态系统带来巨大的影响。这些近岸海域暴发的水母可以通过有性繁殖和无性繁殖来维持或扩大种群数量。而在水母生活史中,螅状体的无性繁殖是决定水母体种群数量的关键阶段,对此阶段进行研究能更好的阐明水母暴发的机理。
海月水母是世界性种类,广泛分布于北纬70°至南纬40°之间[13],研究显示,海月水母存在多个亚种,而在日本、韩国、中国沿岸分布的海月水母为Aureliacoerulea[14- 16]。海月水母的生活史复杂,底栖固着螅状体和浮游水母体世代交替,螅状体种群的大小、存活率、生活习性会显著影响水母体的种群数量[17]。在无性繁殖阶段,亲代螅状体通过出芽和匍匐茎等方式繁殖子代螅状体,随后释放碟状体,最后发育为成熟水母体。因此,大量的螅状体是造成水母种群暴发的关键。环境因子会显著影响螅状体生长、生存、繁殖等。在众多环境因子中,温度在调节螅状体种群大小上起着至关重要的作用。目前,国内关于温度对海月水母螅状体的影响研究大多关注于螅状体的繁殖数量、横裂周期、横裂比例等[17- 19],较少关注螅状体在生长和繁殖上的能量分配方式及不同温度下的无性繁殖选择,本实验选取我国黄渤海分布的海月水母为实验对象,研究温度对螅状体生长及繁殖的影响,为海月水母螅状体分布及水母暴发的研究提供一定理论依据。
1 材料和方法
1.1 实验材料
实验用海月水母螅状体来自辽宁省海洋水产科学研究院人工培养繁殖的螅状体,亲体采自黄海北部水域,螅状体附着基为塑料波纹板。实验用海水取自大连黑石礁沿岸,经黑暗砂滤沉淀后使用。暂养期间,水温保持在(20.0±0.5)℃,盐度30.0±1.0,溶解氧>5.0 mg/L。每天足量投喂卤虫无节幼体(Artemianauplius),体长约300μm。
1.2 实验设计
实验设6个温度梯度:12、15、18、21、24、27℃。每隔1d升高或降低1—2℃,直至达到设定温度,螅状体在设定温度下适应3d后开始正式实验。每个温度梯度设3 个平行,每个平行10 个螅状体,实验用螅状体培养于15cm×15cm×3cm的隔离盒中。实验过程中每天足量投喂卤虫无节幼体, 用吸管对准喂食,保证每个螅状体获得充足的饵料,投喂后3h换水,将残余未摄食的卤虫饵料去除。实验光照周期为自然光周期,光照条件为室内自然光,用智能光照培养箱 (型号: GXZ- 280B) 控制实验水温。实验期间水体盐度控制在30.0±1.0,溶解氧>5.0 mg/L,每周测量螅状体柄径长度、记录螅状体数量,并将已与母体分离的新生子代螅状体用解剖针去除。实验共持续56d,测量及观察在解剖镜下进行 (Olympus SZX9),时间不超过5min。
1.3 指标测定与统计分析
在本实验中,每周记录一次新生螅状体数量并去除,并非所有新生个体都是初始实验亲体产生的子代螅状体,所以未计算单个螅状体繁殖力,仅将脱离母体之后附着的螅状体计为新生螅状体,而与母体连接的芽体不计为新生螅状体。每周测量一次螅状体柄径,螅状体柄径指口面观圆周最大水平面的直径,当螅状体不为圆形时取直径最大值与最小值的平均值为螅状体柄径长[17]。成活率(survival rate, SR)、日生长率(daily growth rate, DGR)、相对生长率(relative growth rate, RGR),特定生长率(specific growth rate, SGR)计算公式如下:
SR(%)=100×(Nt/N0)
DGR(%day-1)=100×(Dt-D0)∕T
RGR(%)=100×(Dt-D0)∕D0
SGR(% day-1)=100×(lnDt-lnD0)∕T
式中,N0和Nt分别为实验开始和实验t天时螅状体的数量,T为实验持续时间(d),D0和Dt分别为实验开始和实验t天时螅状体的柄径长度(mm)。
采用单因子方差分析比较不同温度之间可能存在的差异水平。所有统计分析使用SPSS 13.0统计软件,以P<0.05为差异显著性。利用Excel 进行数据描述作图。
2 结果与分析
2.1 螅状体摄食行为观察
实验过程中观察了不同温度条件下海月水母的摄食状况,在高温组(27℃)螅状体几乎不摄食,其触手一直处于伸长状态,但并未对靠近的卤虫进行捕捉,随着培养时间延长,螅状体外轮廓逐渐模糊,直至螅状体溶解、消失。而在较高温度组(24、21、18℃),生长状态良好的螅状体,正常状态下触手舒展,当有食物接近时,其触手伸展的范围逐渐增大,直至触手上沾满卤虫。而低温组(15℃和12℃),螅状体触手大部分处于收缩状态,摄食活力与其他处理组相比较低,但本实验均采用过量投饵,卤虫均投喂到螅状体上方,因此,各处理组螅状体均处于食物充足的状态,摄食后的螅状体成粉红色。实验过程中发现,温度能显著影响螅状体对体内饵料生物的消化吸收。摄食2—3h后,较高温度组螅状体逐渐由粉红色转变为透明状态,说明大部分食物已被消化;而较低温度组螅状体依然呈现粉红色,说明卤虫并未被消化完全。
2.2 螅状体的存活与生长
如表1 所示,实验共持续56d,除27℃组外,其余温度组螅状体存活率均为100%。而27℃组,在实验7d时,螅状体存活率为33.33%,随着培养时间的延长,螅状体均不进行摄食,螅状体呈现逐渐缩小、溶解的状态,培养 35d时,螅状体全部死亡。
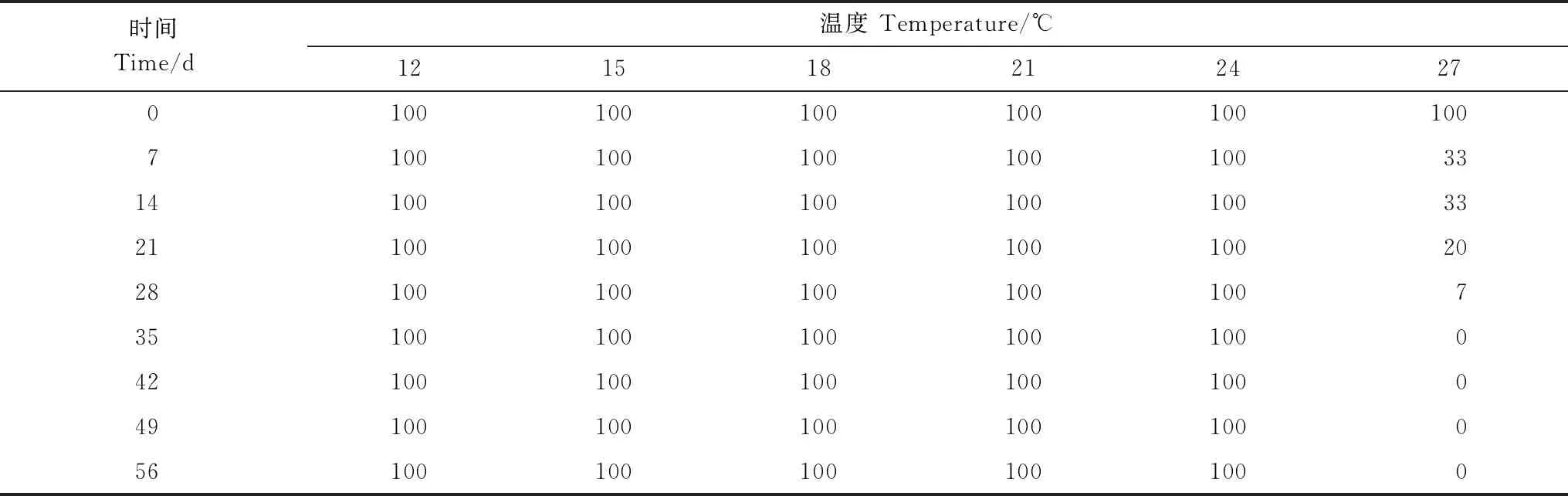
表1 不同温度条件下螅状体存活率/%
经过56d的培养,除27℃组外,各温度组螅状体柄径均呈现了增加的趋势(图1)。方差分析结果显示,培养14d后,不同温度条件下螅状体柄径开始出现明显的差异性,其中,15℃组螅状体柄径显著高于24、27℃组;培养28d,15℃组的柄径增长优势明显,显著高于其他各温度组;随着培养时间的延长,低温组柄径增长明显,直至实验结束,螅状体柄径随着温度的升高呈现降低的趋势,12℃和15℃组螅状体柄径显著高于其他温度组。根据各温度组螅状体的平均柄径结果计算螅状体的DGR,RGR,和SGR,结果显示(图2、3,4),各温度组之间比较,15℃组螅状体柄径的DGR,RGR,和SGR最高;在温度15—27℃范围内,螅状体柄径的DGR,RGR,和SGR呈现随着温度的升高而下降的趋势。培养42d,各温度组柄径的DGR最高,随后在各温度组均呈现降低的趋势,螅状体个体生长渐缓。而螅状体柄径的SGR则在培养21d时最高。实验结束(56d),各温度组螅状体柄径增加幅度分别为157%(12℃),168%(15℃),127%(18℃),67%(21℃)和40%(24℃);而27℃处理组,螅状体柄径未有太大变化,且螅状体状态不佳,成逐渐缩小的趋势,直至螅状体死亡。
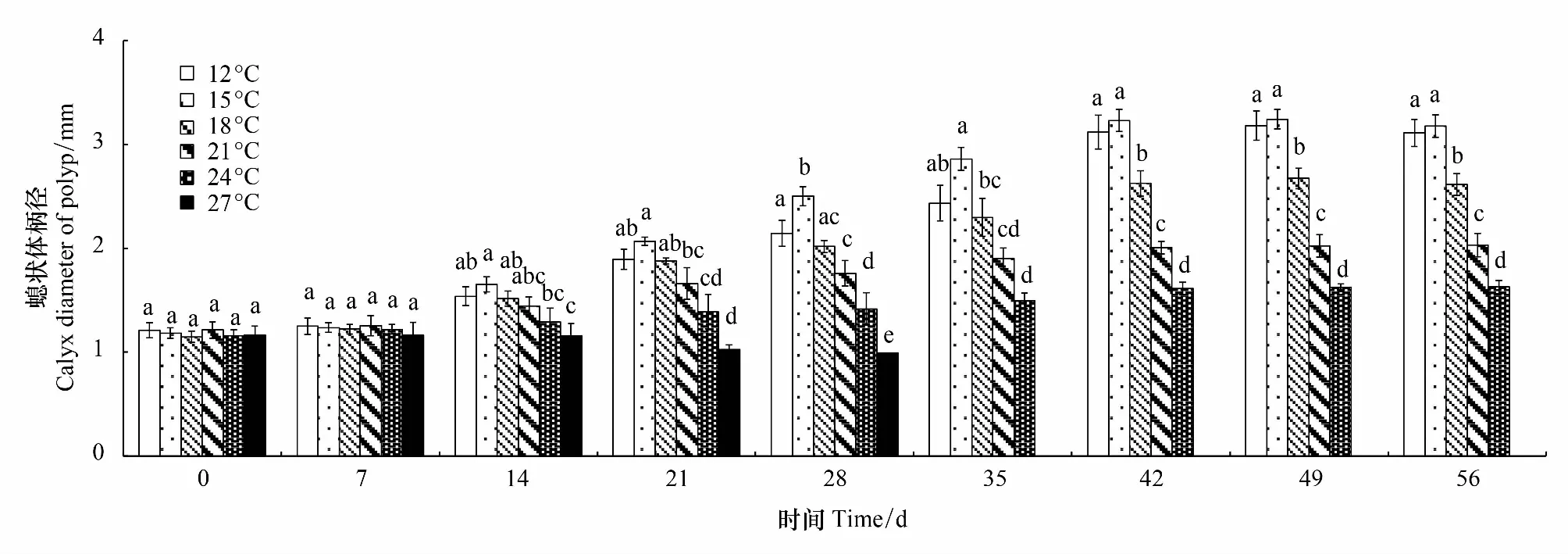
图1 不同温度条件下螅状体柄径Fig.1 The effect of temperature on the calyx diameter of Aurelia coerulea polyp同一簇中不同字母表示差异显著(P<0.05)
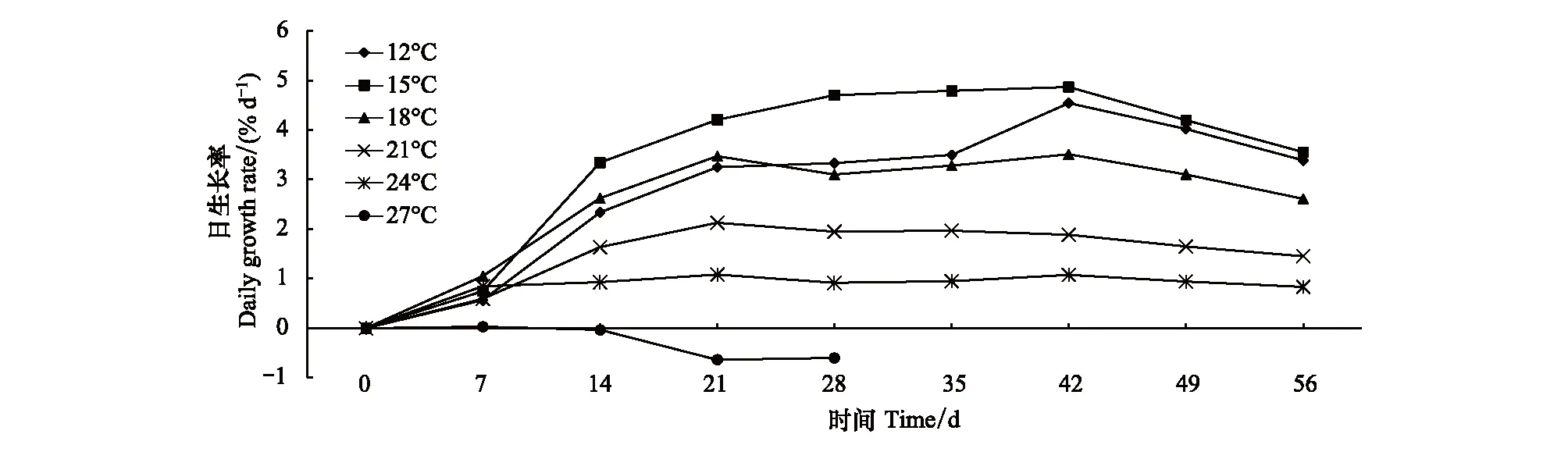
图2 不同温度条件下螅状体柄径日生长率Fig.2 The effect of temperature on the daily growth rate of calyx diameter of Aurelia coerulea polyp
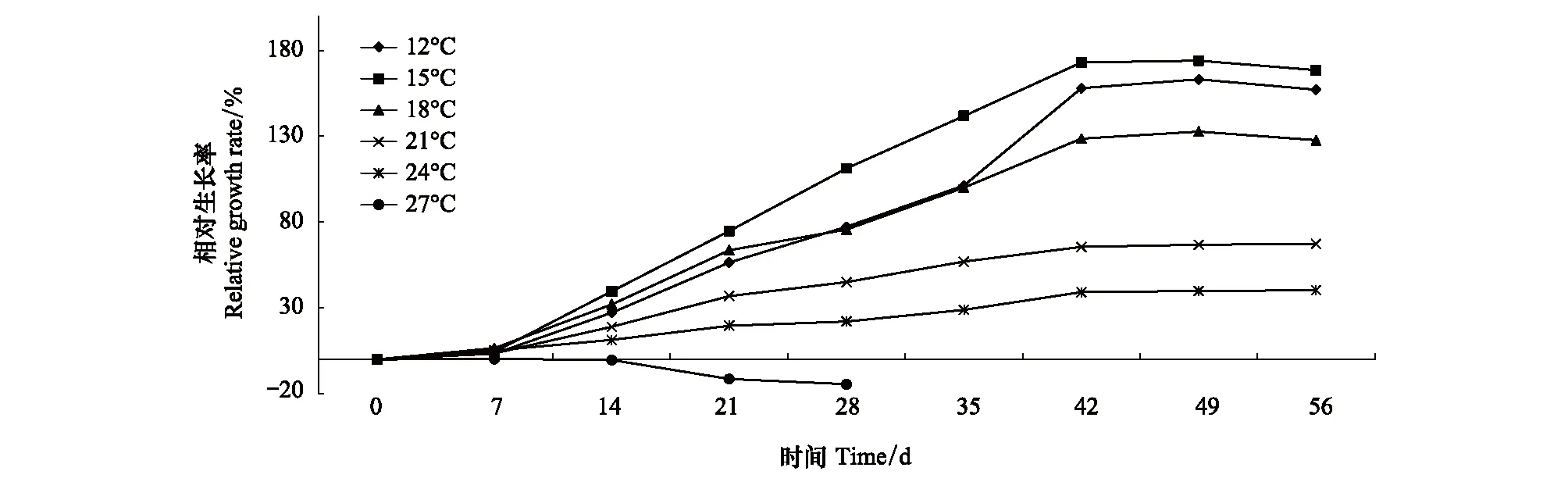
图3 不同温度条件下螅状体柄径相对生长率Fig.3 The effect of temperature on the relative growth rate of calyx diameter of Aurelia coerulea polyp
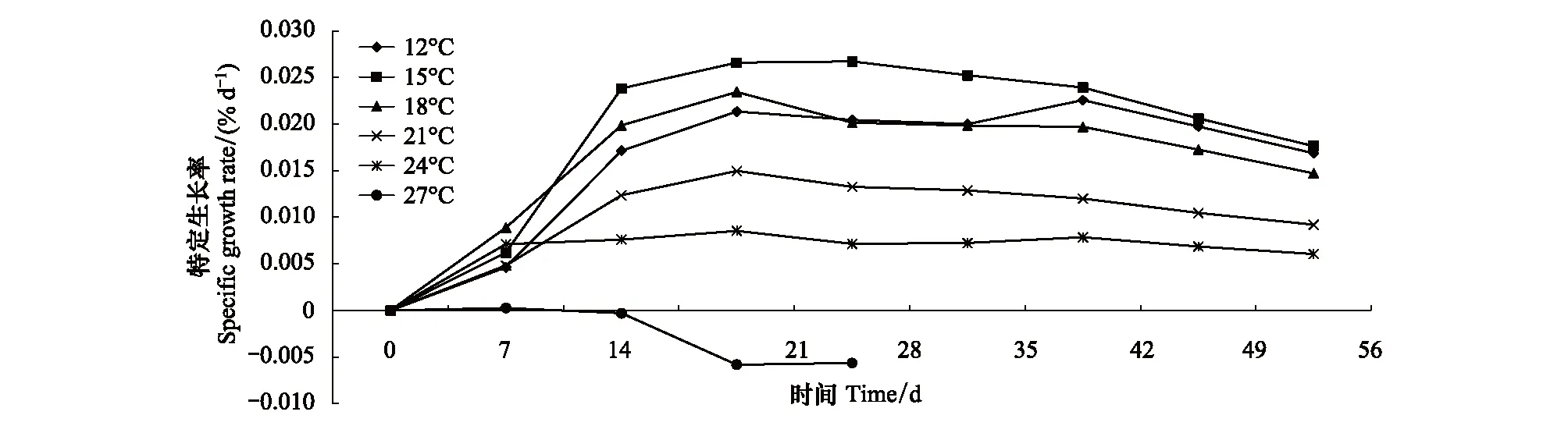
图4 不同温度条件下螅状体柄径特定生长率Fig.4 The effect of temperature on the specific growth rate of calyx diameter of Aurelia coerulea polyp
2.3 螅状体繁殖子代的数量
日平均新生子代螅状体数量如图5所示,结果显示,温度显著影响螅状体繁殖子体的数量;培养第二周(14d),18、21、24℃组螅状体繁殖数量明显高于12℃和15℃处理组;培养第六周(42d),12℃处理组螅状体并未产生新的子代螅状体;培养第8周(56d),螅状体的繁殖数量在21℃和24℃温度组明显高于其他温度处理组,各处理组繁殖子代数量分别为:0个/d(12℃),3个/d(15℃),3.5个/d(18℃),14个/d(21℃),19个/d(24℃)。而27℃处理组,在培养第一周时(7d),繁殖子代的数量为1.29个/d,随后螅状体大量死亡。
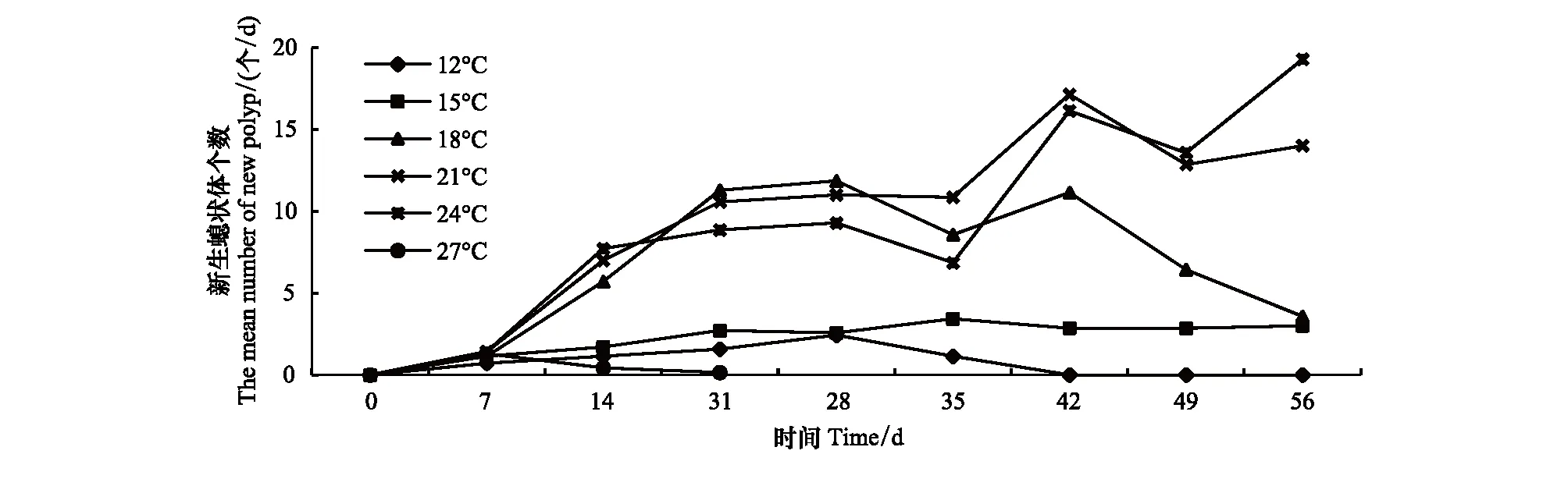
图5 不同温度条件下日平均新生螅状体个数Fig.5 The effect of temperature on the daily number of new polyp of Aurelia coerulea polyp
2.4 螅状体的无性繁殖方式观察
在本实验过程中,共观察到了4种螅状体的无性繁殖方式,包括,匍匐茎生殖、出芽生殖、纵向分裂、足囊繁殖。在各温度组螅状体主要采用匍匐茎生殖和出芽生殖。温度变化会影响螅状体无性繁殖方式的选择,在高温组,匍匐茎繁殖在众多无性繁殖中所占比例较高,新生螅状体距离母体较远,所以整体上螅状体分布较分散;而随着温度降低,出芽生殖在无性繁殖中的比例提升,新生螅状体紧密围绕在母体周围,因此整体上螅状体分布较紧密。与其他温度组相比,21℃和18℃组,螅状体足囊生成较多,而15℃和12℃组,未发现螅状体生成足囊;而18℃条件下,螅状体纵向分裂生殖方式出现较多。
3 讨论
3.1 温度对海月水母螅状体生长及存活的影响
海月水母生活史由有性繁殖的浮游水母体和无性繁殖的底栖螅状体世代交替组成。以前,对于水母暴发的研究一般都关注于碟状体及成体水母[6]。近年来,研究者逐渐认识到海底固着阶段对了解整个水母暴发原因及形成机制上的重要作用,这个过程包括浮浪幼虫附着变态形成螅状体,螅状体通过横裂生殖释放碟状体[6- 7]。营固着生活的螅状体种群数量及个体大小的变化会显著影响通过横裂生殖释放的碟状体的数量及大小,最终影响整个水母体种群的数量[1]。
孙明等[17]研究发现,在0—25℃条件下,海月水母螅状体均可存活,12.5—25.0℃范围内螅状体繁殖倍率增加;本实验结果显示,12—24℃条件下,螅状体个体均有增大趋势,但当温度达到27℃时,螅状体状态不佳,直至逐渐死亡。可见,黄渤海域海月水母螅状体具有较强的耐受低温能力,但对较高的温度环境耐受力较差,这可能与黄渤海区海水温度范围有关,黄渤海区海水温度范围在-2—25℃之间,螅状体种群长期生活在此温度范围内,适应性策略导致对高于这一范围的水温难以适应[17]。研究发现,不同海域生活的海月水母螅状体对温度变化的响应不同,应与其生活的海域环境条件息息相关[1,20-21]。同时,在本实验中,各温度组螅状体柄径的增长及繁殖子代的数量都在培养14d时开始表现出明显的差异性,可见螅状体对环境的短期改变具有一定的耐受力,短期的环境变化允许螅状体产生一定的生理适应对策[1],但当需要长期处于不适的环境条件时,螅状体才需要改变其自身的行为生理响应机制,以应对“环境挑战”。因此,在超过14d的培养周期内,各温度组螅状体表现出了不同的生长和繁殖策略。本实验结果显示,海月水母螅状体在低温条件下,柄径增大,新生子代螅状体数量较少,最终导致种群增长率降低;而较高温度条件下,螅状体个体增长较慢,而新生子代螅状体数量随着培养时间的延长逐渐增加,并明显高于低温处理组,与王彦涛等[18]研究结果一致,在温度10—25℃范围内,A. sp.1螅状体在升温过程中,其繁殖的数量逐渐增加,高温组数量明显高于低温组。研究发现A.aurita对温度也有相同反应机制[21- 23],较温暖的环境条件下,出芽率增加,使得种群数量增加。
对于生产螅状体和生产碟状体上的能量分配方式为海月水母提供了不同的生存策略。在碟状体数量上的投入增加可使得有性水母体阶段种群扩张的可能性加大,相反,在无性出芽繁殖阶段的能量投入增加可提高整个螅状幼体种群成活率,提供一个更大的无性繁殖群体,以便产出更多的碟状体[24]。螅状体在较高温度条件下将能量资源用于生产子代个体,导致种群快速增长,而用于自身生长的能量降低,个体变小。在较寒冷的条件下,能量被用来增加个体体积,导致种群增长缓慢,个体变大,而个体较大的螅状体可以产生更多的碟状体[25]。无性繁殖细胞学说指出,在艰难的环境中释放分散的粒子对个体更有利[22],甚至在低温不适的环境条件下,海月水母A.coerulea可以改变其生活史,越过螅状体阶段,选择直接由浮浪幼虫发育成碟状体,以便分散的个体更容易移动到适合的环境[2]。本实验中,在12℃和15℃组,螅状体个体增大,新生螅状体数量显著降低。在低温条件下,螅状体为了能找到更加适宜的环境条件,选择通过横裂生殖产生能够自由移动的碟状体,因此个体变大,出芽繁殖缓慢是为横裂做准备。研究发现,螅状体在低密度条件下不产生横裂[26],在本实验中,直至实验结束,所有螅状体均未发生横裂,分析可能是因为,实验条件没有给螅状体产生足够大的“压力”,同时,低密度的实验设置也是造成螅状体未发生横裂的原因。
本实验结果表明,黄渤海区海月水母螅状体种群的繁殖策略为,在夏季选择快速扩张种群数量直至秋季速率降低,从而在冬季产生大量的螅状体。在冬季,温度的降低导致出芽繁殖速率逐渐降低,螅状体个体体积增大然后发生横裂,较大的螅状体产生更多的碟状体,此种繁殖策略导致冬季大量碟状体通过横裂释放。此时横裂更有助于碟状体在春季长成水母体,呈现暴发现象。冬季横裂之后,螅状体种群迎来温度升高,食物来源丰富的环境条件,利于螅状体种群的增加以补充在横裂过程中的损耗。然而,其他的影响因子,例如空间竞争[27],食物的可利用性[24], 和捕食者[28]在螅状体种群生长和存活中也起到了重要的作用。
3.2 温度对海月水母螅状体无性繁殖的影响
与其他钵水母种类相比,海月水母的无性繁殖方式复杂多样,目前已报道的繁殖方式包括匍匐茎繁殖、出芽繁殖、纵裂繁殖、足囊繁殖、横裂繁殖、内外繁殖体繁殖、水母体直接退化成螅状体的无性繁殖方式[7,24,29-32]。海月水母的众多无性繁殖方式使其对不同的环境条件具有较强的适应性。
已有研究表明,繁殖方式及发生时间受多种环境因子影响,例如光照[20]、温度[18, 33- 34]、食物[19, 33]、化学物质[35]、捕食者[36]等。在温度22℃盐度34条件下,出芽繁殖是海月水母最主要的繁殖方式;内繁殖体繁殖是仅在高密度下(大约7.5个/cm2)发生的繁殖方式[37]。食物水平对出芽生殖影响显著,在低食物水平下未发现出芽繁殖方式[9, 38- 39]。石岩等[19]对海月水母的研究发现,温度9—18℃条件下,匍匐茎繁殖是主要方式,出芽繁殖次之,纵向分裂以及足囊出现几率极低。
本实验研究发现,在海月水母的众多无性繁殖方式中,匍匐茎繁殖和出芽繁殖依然占主要地位,但温度对海月水母无性繁殖具有一定的影响。在较高温度处理组,螅状体主要采用匍匐茎繁殖作为主要的繁殖方式,因此,新生螅状体距离母体较远,螅状体种群扩充范围较大,而随着温度降低,出芽繁殖比例增高,新生螅状体更加紧密的排列在母体周围。出芽繁殖与匍匐茎繁殖的主要区别在于出芽繁殖是螅状体在柄部生成子螅状体后两者再分离,而匍匐茎繁殖则是螅状体产生匍匐茎,远离母体,先分离后生长发育成子螅状体。这也是海月水母螅状体应对温度变化的一种适应性机制,当温度适宜时,新生螅状体成活率较高,因此选择匍匐茎繁殖,以便迅速的扩充种群范围;而当环境条件逐渐恶劣,新生螅状体的成活成为主要目的,因此选择出芽繁殖,新生子代螅状体在母体上发育完全后再与母体分离,保证了螅状体的成活率。
实验结果显示,足囊繁殖仅发生在21℃和18℃,较低温度和较高温度未发现足囊,与海蜇、沙蜇的足囊繁殖不同,海月水母的足囊繁殖方式是仅在食物缺乏或不摄食的高温条件下产生,夏季高温期是足囊繁殖的最适季节[8-9,40],虽然足囊繁殖并非海月水母在适宜环境下的主要繁殖方式,但却是其适应极端环境最有效的繁殖策略,既可以抵御敌害生物的捕食,又能耐受不利的环境条件[7]。本实验在较高温度条件下,适宜的环境条件和充足的饵料导致螅状体并未产生足囊,而低温条件下,螅状体选择增加个体大小,并未将能量用于足囊繁殖。
本实验中,研究单个螅状体的生长繁殖,对于单个螅状体的研究能更清晰的阐明无性繁殖的细节变化[6, 20],特别是在种群密度控制条件下,更能清晰的反应环境条件通过诱导个体的行为变化导致的种群大小的改变。但在自然界中,螅状体是成群存在的,种群的生长和繁殖受多种因素控制。研究发现,决定海月水母螅状体数量及分布的因素有3个[13]:(1)浮浪幼虫附着对螅状体种群的补充;(2)螅状体自身的无性繁殖;(3)种间和种内竞争。由于这些复杂的影响因素,要想弄清海月水母暴发的原因,首要弄清调节螅状体种群变化的影响因子。自然或人工构筑物均可以成为海月水母螅状体附着基,螅状体附着后可迅速扩张[13,38],此时,有效附着基是限制种群大小的关键;假设食物充足,螅状体的扩张范围较小时,此时种内竞争会降低螅状体的繁殖率,螅状体的密度升高,直至达到一个平衡状态,此时螅状体可能会通过产生浮浪体芽的游离方式寻找新的附着基;而在附着基和食物充足的基础上,温度会显著影响螅状体种群大小,温度适宜时,螅状体的扩张范围增大,更加有利于种群的增加。研究表明,预计海洋表面的温度将在2100年增加4℃,因此,海底生境会变得更加温暖,全球气温的变化会影响底栖螅状体的数量及分布[1];同时,温度也会显著影响螅状体的能量分配方式及无性繁殖选择,从而调控螅状体种群,最终影响水母体的数量及分布。
4 结论
海月水母螅状体具有较强的温度适应能力,但在27℃时,螅状体不能存活。在较低温度条件下,螅状体个体增大,新生子代螅状体数量降低;而在较高温度组,螅状体生长缓慢,新生子代螅状体数量增加。温度会显著影响海月水母螅状体的无性繁殖方式,在较高温度条件下,螅状体主要通过匍匐茎繁殖产生子代,而随着温度降低,出芽繁殖在无性繁殖中的比例逐渐升高。结果表明,海月水母螅状体可以通过调节体内能量分配方式及无性繁殖选择以适应不同的环境条件,达到维持种群数量的目的。
