双头涡虫模型的建立
2020-08-19席兴字王红亮马克学
席兴字, 王红亮, 马克学
(1. 新乡学院 教育科学系, 新乡 453003; 2. 河南师范大学 生命科学学院, 新乡 453007)
淡水涡虫属于扁形动物门涡虫纲的代表性动物,具有极强的再生能力[1]。涡虫头部被切除后,3 d能够再生出新的眼点,7 d能够再生出新的头部[2-3]。著名的遗传学大师摩尔根把它描述为 “切不死的动物(Immortal under the edge of the knife)”。此外,一条涡虫无论横切多少段,总是面向前端的伤口再生出头,面向后端的伤口再生出尾。摩尔根认为,从前到后有一种物质浓度梯度决定了涡虫前后轴的极性[4]。在地中海涡虫(Schmidteamediterranea)中研究发现,Wnt/β-catenin 信号通路对涡虫前后轴极性的重新建立具有决定作用。用RNAi(RNA interference)技术抑制β-catenin-1基因表达诱导涡虫后端再生出头部,产生双头涡虫[5-6]。但是,β-catenin-1控制了哪些信号分子导致涡虫前后轴极性的改变仍不十分清楚。为了回答这一问题,建立稳定可靠的双头涡虫模型就显得非常重要。鉴于此,作者尝试建立双头涡虫模型,为涡虫领域RNAi研究提供参考。
1 材料与方法
1.1 材料
日本三角涡虫(Dugesiajaponica)单克隆系,本实验室建立和保存。本实验所用的Taq酶,pMD19-T载体、质粒DNA提取试剂盒、PCR产物纯化试剂盒等分子生物学试剂购自宝生物工程有限公司。实验所用的引物和测序由苏州金唯志公司完成。
1.2 方法
1.2.1 总RNA提取和Dj-β-catenin-1基因的克隆
取6条涡虫用液氮研磨成粉末后加入Trizol 试剂抽提总RNA,然后用RNase-free DNase I 消化模板去除基因组DNA。取2 μg 总RNA用宝生物cDNA合成试剂盒(TaKaRa PrimeScriptTMII 1st strand cDNA synthesis kit, Code No. 6210A)合成cDNA置于-20 ℃保存备用。根据日本三角涡虫β-catenin-1基因序列(GenBank MG599480)设计一对5′端带有T7启动子的特异性引物(上游引物:5′-GGATCCTAATACGACTCACTATAGGGACA ACC ATC GAA TCT TAT CCG CCA G-3′; 下游引物:5′-GGATCCTAATACGACTCACTATAGGGCAT TGT GTA ACC GAA TTA TGT CTGT-3′)扩增1325 bp cDNA序列。PCR产物连接pMD19-T载体,提取质粒DNA送金唯志测序,以保证合成dsRNA模板的正确性。
1.2.2 dsRNA的合成
根据参考文献[7],按照MEGAscript RNAi kit (Ambion 1626) 操作说明进行。以上述测序正确的质粒为模板,制备PCR反应体系:10×buffer 20 μL,dNTP 20 μL,上下游引物各8 μL,Taq酶2 μL,模板50 ng质粒DNA,总体积200 μL。PCR参数如下:94 ℃ 预变性5 min; 98 ℃变性10 s, 68 ℃ 退火2 min,共33个循环;72 ℃终延伸10 min。PCR产物用TaKaRa 试剂盒纯化后作为合成dsRNA 模板。1 μg DNA模板加入到反应混合液中(含有2 μL 10×T7 reaction buffer, 8 μL rNTP mixture, 2 μL T7 enzyme mix, 总体积20 μL)。反应混合液在37 ℃孵育4~6 h,再用DNA酶消化模板,产物用5 mol/L醋酸铵沉淀dsRNA, 测定浓度并用琼脂糖凝胶电泳鉴定完整性。
1.2.3 喂食dsRNA的策略
分别取0.5、1和2 μg dsRNA与20 μL牛肝匀浆液混合后喂食 4~6 mm 虫子20条,间隔3 d喂食1次,连续喂食4次。喂食结束后,次日把涡虫从咽前咽后切割成头部、躯干和尾部3个片段,观察涡虫再生表型。体视显微镜拍照并保存图片。实验重复3次。
1.2.4 整体原位杂交干扰效果鉴定
PC2基因在涡虫中枢神经系统特异性表达[8],作为涡虫中枢神经系统的分子Marker广泛应用于涡虫再生研究。本实验所用的DjPC2探针采用Roche 地高辛标记试剂盒(SP6/T7, Cat.No. 11175025910)合成。整体原位杂交主要步骤如下:涡虫用2% HCl处理5 min去除黏液,4%多聚甲醛室温固定30 min,PBST洗涤后用系列甲醇脱水,100% 甲醇-20 ℃放置至少2 h,6% H2O2白光漂白16 h,然后经100% 甲醇和50%甲醇洗涤后用PBST洗涤2次,用20 μg/mL Proteinase-K处理涡虫10 min,4%多聚甲醛再次固定20 min,PBST洗涤2次后加入预杂交液56 ℃ 2 h,然后加入 400 ng/mL 探针 56 ℃ 杂交 16 h。杂交结束洗涤后用Anti-Dig-AP 抗体(1∶2000稀释),BCIP/NBT显色,Leica DFC300FX 体式显微镜拍照保存实验结果。
2 结果
2.1 RNAi- Dj-β-catenin-1 表型观察
实验结果(图1)显示,对照组涡虫切割后都能够正常再生,头部片段再生出新的尾,躯干部分前端再生出头后端再生出尾。RNAi干扰组涡虫头部片段的后端和躯干部分的后端却再生出异位头部,眼点清晰可见。另外,对实验数据进行统计,结果(表1)表明,双头涡虫表型诱导率与dsRNA的量有浓度效应,0.5 μg诱导组双头涡虫表型率为35%±3.8%,1 μg诱导组双头涡虫表型率为70%±10.3%,2 μg 诱导组双头涡虫表型率为100%。
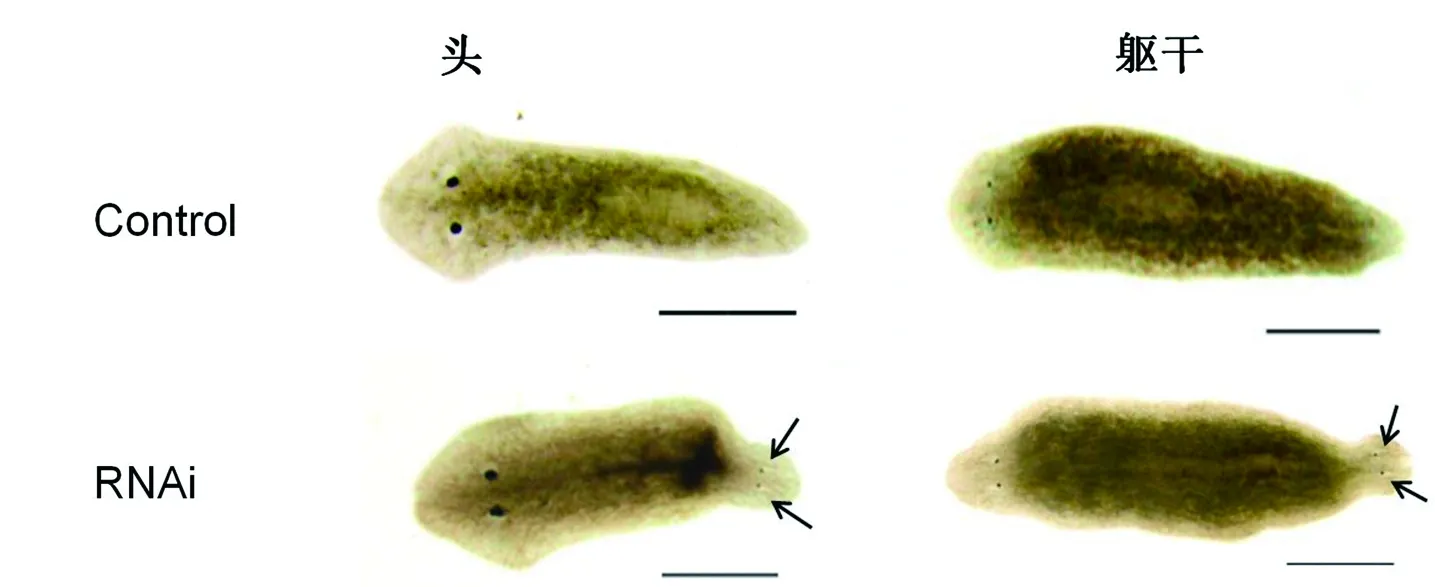
再生10 d;箭头示后端眼点;Scale bar: 0.5 mm
2.2 整体原位杂交干扰效果鉴定
为了进一步验证确实形成了双头涡虫,用涡虫神经marker基因DjPC2进行验证。原位杂交显示,干扰组涡虫前后两端都显示出涡虫中枢神经系统(图2),结果表明实验方法正确。干扰Dj-β-catenin-1表达确实能使涡虫前后轴极性改变。
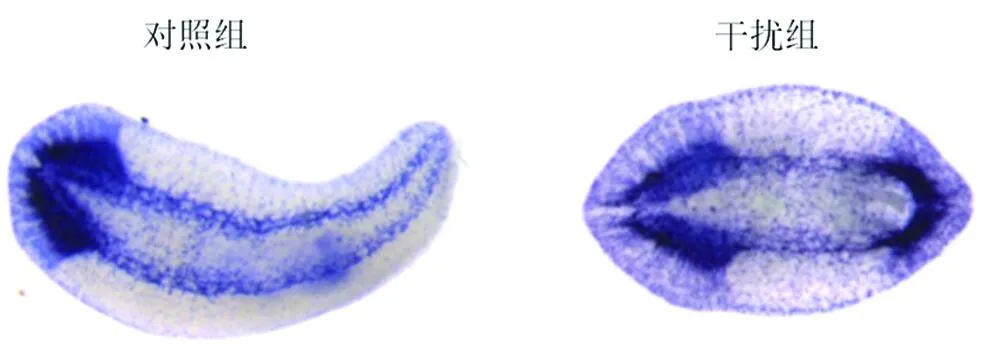
DjPC2探针检测,NBT/BCIP显色
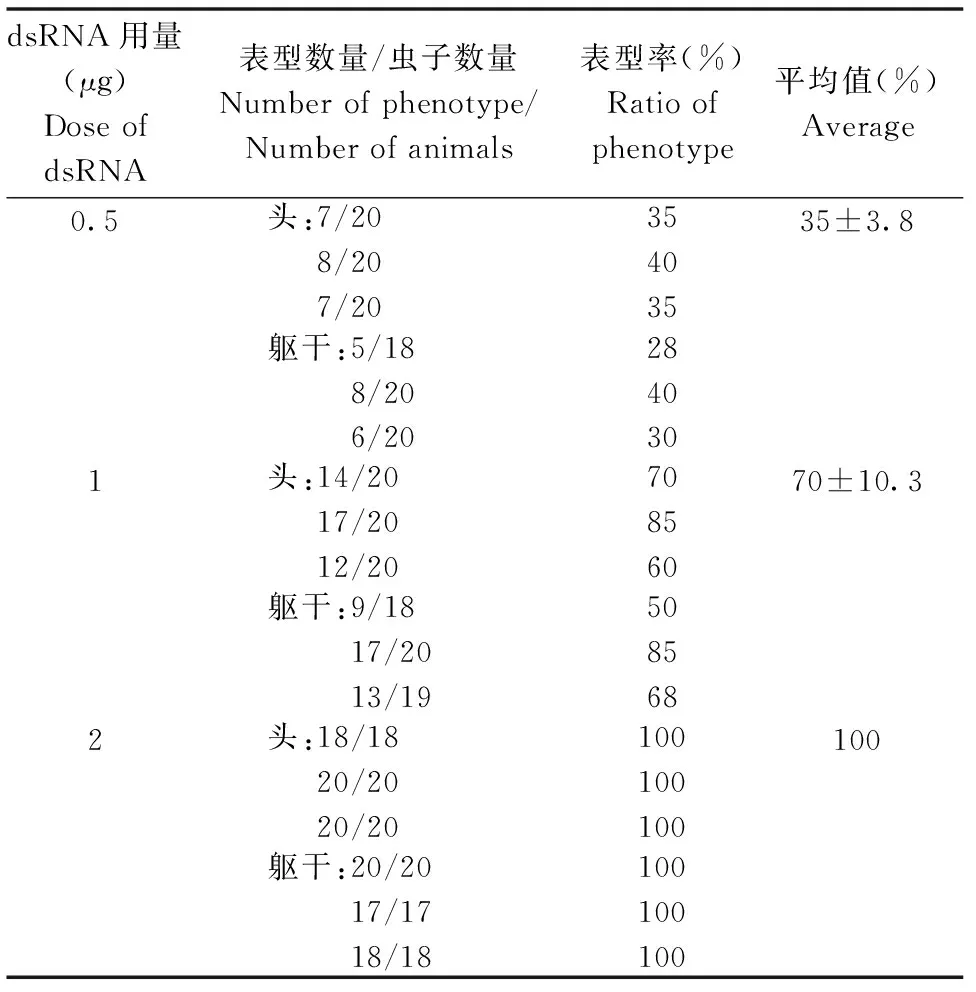
表1 实验数据及统计
3 讨论与结论
自扁形动物开始,动物在体形上开始具备前后左右之分。中枢神经系统向前端集中形成脑是动物进化史上的重要事件,但是动物确立前后轴的分子机制仍不十分清楚[9]。在涡虫中研究表明,wnt/β-catenin信号通路在前后轴极性的建立和维持中具有重要作用[10-11]。目前研究认为,wnt/β-catenin信号沿涡虫前后轴有一个浓度梯度,后端最强,因此决定涡虫后端形成尾部结构[5-6]。阻断wnt/β-catenin信号通路后,表达后端决定基因的细胞不能形成。相反,表达前端决定基因的细胞在后端分化形成,因此再生出后端头部[11]。众所周知,Hox基因沿动物前后轴分布,其有序表达是动物正常发育的基础[12-13]。阻断wnt/β-catenin信号通路对Hox基因表达模式有何影响?阻断wnt/β-catenin信号通路通过何种机制改变细胞的命运,这其中涉及哪些分子机制?因此,建立稳定可靠的双头涡虫模型,研究相关基因的表达模式,是回答这些关键生物学问题的基础。本实验通过喂食涡虫dsRNA,建立了稳定可靠的双头涡虫模型诱导技术,表型率达到100%。与其他方法相比较,本方案有显著的优势。除喂食dsRNA外,涡虫领域RNAi技术还有显微注射dsRNA法和喂食表达dsRNA的细菌法[14-15]。显微注射法需要精密的显微注射装置,显微注射费力费时且普通研究人员很难掌握。喂食细菌法相对容易,但是细菌被诱导后表达的dsRNA的量很难确定,且喂食细菌诱导双头涡虫表型率不高。本实验建立的喂食dsRNA法量可控,操作简单,容易实施和推广,对涡虫领域RNAi 研究具有参考价值。
致谢:特别感谢上海交通大学荆清教授和韩晓帅博士提供的技术指导和帮助!
