低温胁迫下斑马鱼胚胎成纤维细胞(ZF4)应激颗粒的探究
2020-08-19程鹏丽胡瑞芹李根芳陈良标
程鹏丽, 胡瑞芹, 李根芳, 陈良标
(1. 上海海洋大学 水产科学国家级实验教学示范中心;2. 水产种质资源发掘与利用教育部重点实验室; 3. 海洋生物科学国际联合研究中心 中国科学技术部, 上海 201306)
真核细胞中,mRNA调控在细胞的许多区域和细胞周期的多个阶段中进行。mRNA的重要贮存库是RNA颗粒,包括p-body[1-2]、应激颗粒(Stress granules,SGs)[3-5]以及其他类型的含mRNA的细胞质颗粒。这些RNA颗粒的分类是由它们的组成、大小和细胞来源决定的。RNA颗粒的一个显著特点是没有膜包裹,从而使RNA和相关的RNA结合蛋白在动态平衡状态下自由穿梭于颗粒之间,所以这种聚集体是不稳定的[6]。因此,从细胞中分离含RNA的颗粒以及在体外进一步表征仍然是亟待解决的问题。在这些RNA颗粒中,近年来对应激颗粒的研究也逐渐增多。
应激颗粒是细胞在受到环境胁迫 (如热休克、氧化性刺激、病毒感染等) 时,未翻译的mRNA与一些RNA结合蛋白如G3BP (GTPase-activating protein SH3 domain binding protein )[7],TIA-1 (T-cell-restricted intracellular antigens1)[8]等结合,在经过蛋白与蛋白的相互作用而形成的致密颗粒[9-10]。G3BP1、TIA-1通常作为经典的应激颗粒形成的标记蛋白。研究表明,低温胁迫可诱导哺乳动物细胞和酵母形成应激颗粒[11],并且应激颗粒的形成对细胞存活起到积极影响。哺乳动物细胞处于稳态条件下,G3BP1会使USP10的抗氧化功能失活。USP10是G3BP1的绑定配体。亚砷酸盐、缺氧、热休克等外界环境胁迫下能诱导SGs的形成,此时还可激活ATM。SGs的形成使G3BP1对USP10的抑制活性失活,USP10随后被ATM诱导的磷酸化或ATM磷酸化蛋白激活,减少ROS产生和ROS依赖性的细胞凋亡,以此达到保护细胞的目的[12]。
哺乳动物细胞中应激颗粒相关的研究层出不穷,但鱼类细胞中有关应激颗粒的研究却极少。仅在研究斑马鱼FUS(融合肉瘤)的细胞质定位和早期胚胎发育时,对经典应激颗粒标志物如TIAL-1 (T细胞内抗原like-1)[13-14]进行过鉴定。鱼类细胞在低温胁迫下,应激颗粒的形成和解聚的研究还未见报道。因此本实验旨在探究在不同低温胁迫条件下,斑马鱼胚胎成纤维细胞(ZF4)应激颗粒的形成与解聚情况,期望可以为低温下ZF4细胞应激颗粒的形成弥补理论上的空缺。
1 材料与方法
1.1 材料和细胞培养方法
ZF4细胞系(购于American Type Culture Collection)培养所用的完全培养基由含有10%的胎牛血清 (Gibco)和1%的Penicillin-Streptomycin Solution(含有青霉素和链霉素),以及89% DMEM/F12(含1%谷氨酰胺,Hyclone)配制而成,在28 ℃,5%CO2,95%湿度下进行培养。2~3 d换1次培养基,当细胞长至80%~90%用0.25% Trypsin(Gibco)消化,传代后继续培养。
1.2 主要试剂和仪器
胎牛血清购自Gibco公司;培养基DMEM,含有青霉素(10 000 IU)和链霉素(10 000 μg /mL)的混合液-双抗、胰蛋白酶购自Hyclone 公司;SYBR Green购自TaKaRa公司;反转录试剂盒购自TaKaRa公司;一抗TIAL1购自NOVUS公司,货号NBP1-79932;二抗(羊抗兔)购自华安生物公司;其他常规试剂均购自生工生物工程 (上海) 股份有限公司。
倒置荧光显微镜购自Carl Zeiss Jena 公司; 细胞常温培养箱(Galaxy 170R)购自Eppendorf公司; 细胞低温培养箱(Galaxy 170S)购自Eppendorf公司。
1.3 低温胁迫及胁迫后恢复策略
低温胁迫实验用梯度降温来观察应激颗粒的形成。分别选取18 ℃、13 ℃以及10 ℃进行低温胁迫。实验组ZF4细胞在18 ℃低温下分别进行处理5、12和24 h; 13 ℃低温下分别进行处理2、3、4和5 h; 10 ℃低温下分别进行处理40 min、1、2、3和4 h;对照组ZF4细胞在28 ℃常温培养箱中培养。
低温恢复实验也分为实验组ZF4细胞及对照组ZF4细胞,实验组ZF4细胞先在13 ℃低温下处理4 h,然后放回28 ℃分别培养5、10、15和20 min。对照组ZF4细胞在常温培养箱(28 ℃)培养。
1.4 细胞免疫荧光实验观察TIAL1在细胞中的定位
将实验组ZF4细胞及对照组ZF4细胞分别从培养箱中取出,移除培养基,用DPBS洗涤2次,然后用 4% 的多聚甲醛在低温下固定20 min;用PBS洗涤2 次,加triton X-100穿孔10 min;再用PBS洗涤3次,然后用2% 的BSA (PBS 配)封闭细胞 1 h;用1∶3000稀释的TIAL1兔一抗室温孵育2 h;再用PBS 洗涤3次,每次5 min;用1∶500稀释的二抗避光孵育1 h;用PBS洗涤3次,每次5 min;最后用含有DAPI的抗猝灭剂避光封片,放置于湿盒中,荧光显微镜下观察并拍照。
1.5 RT-qPCR检测g3bp1和tial1的转录水平
实验组和对照组细胞进行总RNA提取和反转录后,进行qPCR实验。RT-qPCR按照每个样品3次生物学重复进行实验。内参为β-actin。本实验所用的20 μL反应体系为:SYBR Green 10 μL,cDNA 2 μL,上下游引物各1 μL,去离子水6 μL。程序为95 ℃预变性10 min;95 ℃变性20 s,60 ℃退火10 s,72 ℃延伸30 s,共40个循环;最后72 ℃再延伸10 min。本实验RT-qPCR所用引物均由生工生物工程 (上海) 股份有限公司合成(表1)。
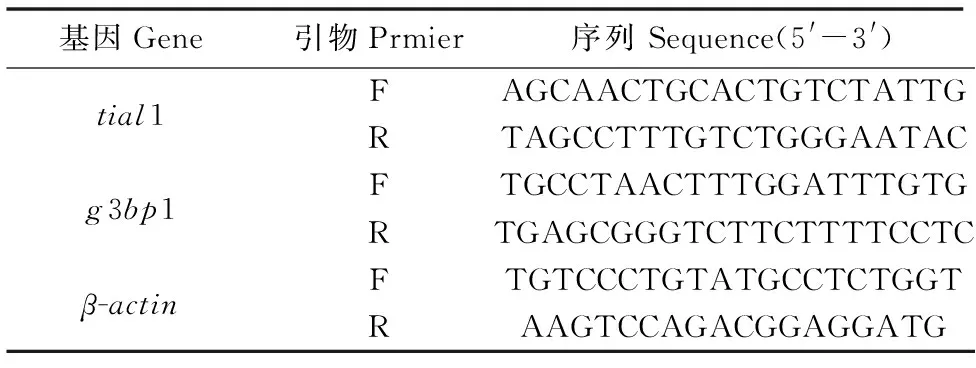
表1 本研究所使用的引物
1.6 数据统计分析
所有实验结果均来自至少3次独立实验,图中所示结果均为平均值±标准差(x±s)。T-test 法用于检测低温处理的显著性,两两之间的显著差异(P< 0.05)利用 two-tailed 法多重比较。
2 结果与分析
2.1 低温胁迫下ZF4细胞应激颗粒形成的探究
为了探究低温胁迫对斑马鱼胚胎成纤维细胞(ZF4)应激颗粒形成的影响。将ZF4细胞在不同低温环境下处理不同时间,利用细胞免疫荧光实验和RT-qPCR实验,探究ZF4细胞应激颗粒的形成情况。
2.1.1 探究18 ℃低温胁迫对ZF4细胞应激颗粒形成的影响
对照组细胞在28 ℃正常培养,实验组细胞在18 ℃低温下分别处理5、12和24 h,然后用TIAL1对实验组和对照组细胞分别进行细胞免疫荧光实验,同时用RT-qPCR实验检测低温胁迫下应激颗粒形成过程中g3bp1和tial1的mRNA 表达情况。结果表明:正常温度(28 ℃)培养的ZF4细胞,几乎没有应激颗粒形成。而与对照组细胞相比,在 18 ℃低温处理下,随着处理时间的增加,ZF4细胞应激颗粒逐渐形成。在18 ℃处理24 h时,应激颗粒的形成最明显(图1-A),表现为应激颗粒的数量增多和直径最大。与细胞免疫荧光实验一致,18 ℃处理24 h时g3bp1和tial1的mRNA水平均显著升高(图1-B、C)。

A中DAPI表示对细胞核的染色(蓝色);TIAL1表示对应激颗粒的标记(红色);Merge表示两次染色的合并;图中右下角方框代表箭头所指细胞的局部放大。B中、C中“*”: P<0.05; “**”: P <0.01; “***”: P <0.001;下同。28 ℃为control
2.1.2 探究13 ℃低温胁迫对ZF4细胞应激颗粒形成的影响
对照组细胞在28 ℃正常培养,实验组细胞在13 ℃低温下分别处理3、4和5 h,然后用TIAL1分别进行细胞免疫荧光实验,同时用RT-qPCR实验检测低温胁迫下应激颗粒形成过程中g3bp1和tial1的mRNA 表达情况。结果表明:与对照组细胞相比,随着13℃低温处理时间的增加,应激颗粒逐渐形成。在13 ℃低温处理4 h时,应激颗粒的形成最明显(图2-A),表现为应激颗粒数量增多和直径最大。与细胞免疫荧光实验一致,13 ℃处理4 h时g3bp1和tial1的 mRNA水平均显著升高(图2-B、C)。
2.1.3 探究10 ℃低温胁迫对ZF4细胞应激颗粒形成的影响
对照组细胞在28 ℃正常培养,实验组细胞分别在10 ℃低温下分别处理40 min、1 h和2 h,然后用TIAL1分别进行细胞免疫荧光实验,同时用RT-qPCR实验检测低温胁迫下应激颗粒形成过程中g3bp1和tial1的mRNA 表达情况。结果表明:与对照组细胞相比,实验组在 10 ℃低温处理下,随着处理时间的增加,ZF4细胞应激颗粒逐渐形成。在10 ℃处理1 h时,应激颗粒的形成最明显(图3-A),表现为应激颗粒的数量增多和直径最大。与细胞免疫荧光实验一致,10 ℃处理1 h时g3bp1和tial1的mRNA水平均显著升高(图3-B、C)。
经过3次梯度降温的低温胁迫实验,我们发现18 ℃低温处理24 h,13 ℃低温处理4 h和10 ℃低温处理1 h时ZF4细胞应激颗粒形成最明显。也就是说,随着胁迫温度的降低,应激颗粒的形成速度也在加快。
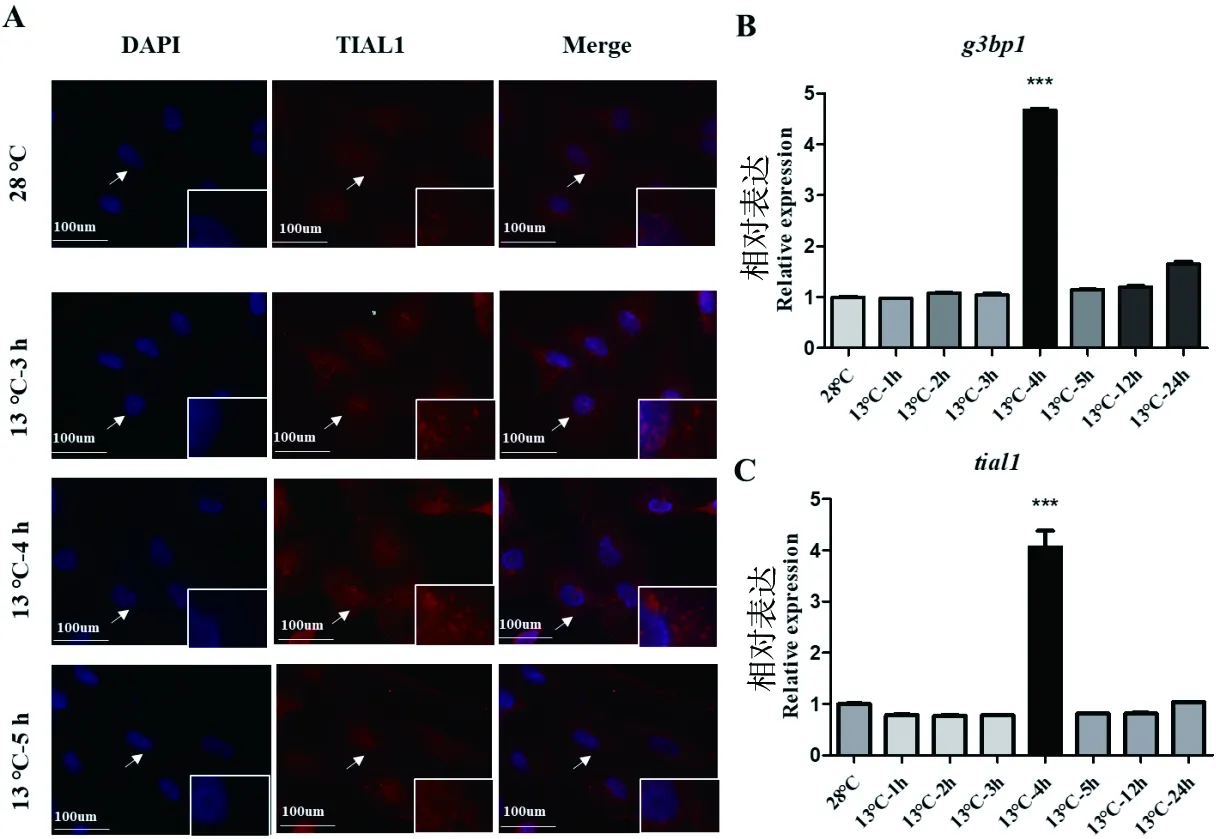
图2 13 ℃低温胁迫下,通过细胞免疫荧光实验(A)和RT-qPCR实验(B、C)探究应激颗粒的形成
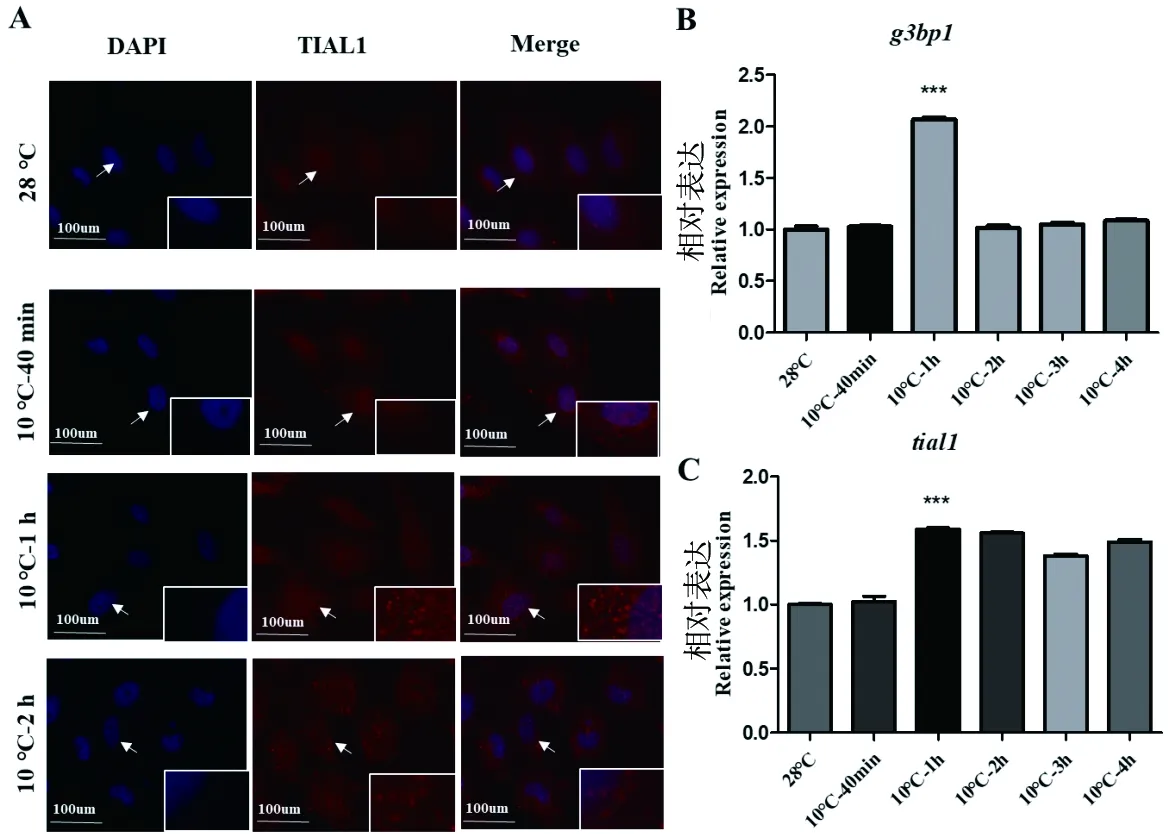
图3 10 ℃低温胁迫下,通过细胞免疫荧光实验(A)和RT-qPCR实验(B、C)探究应激颗粒的形成
2.2 低温胁迫消失后ZF4细胞应激颗粒解聚的探究
探究ZF4细胞应激颗粒的解聚是通过选取13 ℃低温处理4 h作为应激颗粒恢复实验的起点,此时应激颗粒形成明显。对照组为28 ℃培养的细胞,实验组细胞为13 ℃低温下处理4 h后放回28 ℃分别处理5、10、15和20 min的ZF4细胞。用TIAL1分别进行细胞免疫荧光实验。同时用RT-qPCR实验检测低温胁迫下应激颗粒解聚过程中g3bp1和tial1的mRNA 表达情况。结果表明:细胞免疫荧光实验(图4-A)和RT-qPCR实验(图4-B、C)结果一致,当低温胁迫消失后,ZF4细胞中的应激颗粒会在十几分钟快速解聚,应激颗粒的解聚表现为应激颗粒的快速溶解消散。
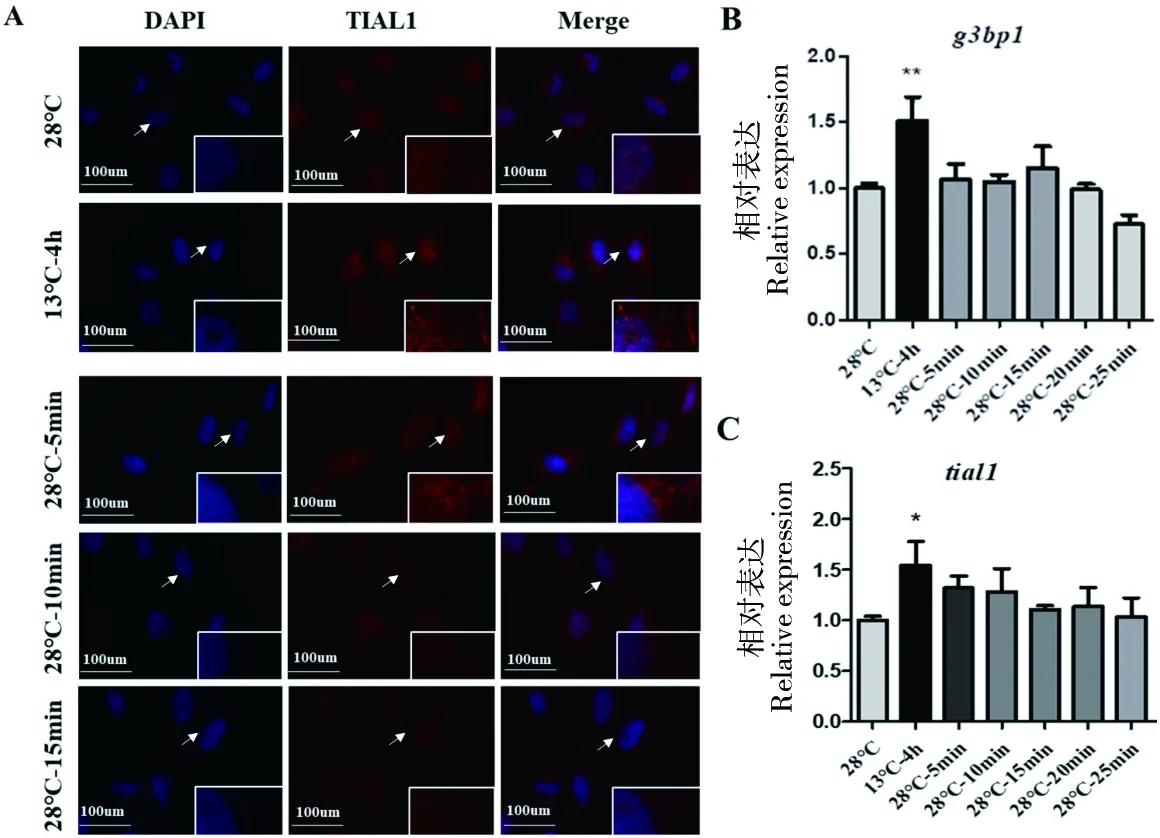
图4 胁迫消失后,随恢复时间变化,细胞免疫荧光实验(A)和RT-qPCR实验(B、C)探究应激颗粒的解聚
3 讨论与结论
应激颗粒的形成是生物体受到外界不良环境压力时,体内细胞翻译抑制而形成的细胞质RNA颗粒。这种颗粒已经在酵母、植物、哺乳动物细胞中得到证实,并且可以通过细胞免疫荧光实验和电子显微镜进行观察[15-18]。当外界胁迫消失,细胞恢复到适宜生长环境后,应激颗粒可以迅速解聚直至消失[19]。在低温刺激下,哺乳动物细胞在数小时内产生应激颗粒,但当细胞恢复到最适宜的生长温度时,应激颗粒在数分钟内就迅速解聚。在热激或亚砷酸盐诱导的氧化性应激时,哺乳动物细胞中SGs在15~30 min后出现,而解聚需要几十分钟。例如,Hofmann等[20]的研究就发现cos7(非洲绿猴肾成纤维细胞)细胞,在10 ℃10 h应激颗粒形成明显,而当返回到37 ℃,应激颗粒在5~10 min就迅速解聚消失。在酿酒酵母中,从30 ℃放到10 ℃处理4 h时,应激颗粒才出现明显,而应激颗粒的解聚则在2.5 min左右。在Hela细胞中10 ℃低温处理10 h,应激颗粒出现明显[21]。在ZF4细胞中,低温胁迫下应激颗粒的形成和解聚还未知。以上在哺乳动物细胞中的研究也为本实验的设计提供了思路。
因此,在本研究中我们选取了18 ℃、13 ℃和10 ℃作为ZF4细胞的低温胁迫温度,利用细胞免疫荧光实验观察发现,低温胁迫温度和时间的不同,应激颗粒的形成速度也不同。并且细胞免疫荧光和RT-qPCR实验在18 ℃低温处理24 h,13 ℃低温处理4 h以及10 ℃低温处理1 h时,ZF4细胞中应激颗粒形成明显。随着胁迫温度的降低,应激颗粒的形成速度也在加快。应激颗粒的形成表现为应激颗粒数量增多和直径变大。当ZF4细胞在13 ℃低温处理4 h后,将细胞恢复到适宜生长温度(28 ℃)时,发现应激颗粒会在十几分钟迅速解聚。应激颗粒的解聚主要表现为应激颗粒的快速溶解消散。
综上所述,本研究发现低温胁迫下斑马鱼胚胎成纤维细胞也能形成应激颗粒,并且胁迫消失应激颗粒也会迅速解聚,这与哺乳动物细胞类似。随着胁迫温度的降低,应激颗粒的形成速度也在加快。鱼类细胞中有关应激颗粒的研究极少,本文首次发现鱼类细胞在低温下形成应激颗粒,主要成分与哺乳动物细胞类似,表明应激颗粒是动物细胞应对低温刺激的普遍反应机制。本实验也期望可以为ZF4细胞低温下应激颗粒的研究提供理论上的支持。近年来,有研究表明,哺乳动物细胞中应激颗粒的形成可以通过减少细胞中ROS的产生来减缓细胞凋亡[12]。那么低温胁迫下,鱼类细胞中应激颗粒的产生是否也是通过减缓细胞通向死亡的进程来有利于细胞存活呢,这也可以作为鱼类细胞中应激颗粒后续研究的一个方向。低温胁迫下,SGs的这种保护是由于其包含部分直接参与凋亡调节的因子来起作用还是通过某些细胞信号通路激活或抑制某些蛋白而改变蛋白间的相互作用来实现其保护细胞的功能,都有待进一步研究探索。
