肾动脉移植骨髓间充质干细胞对阿霉素肾病大鼠肾纤维化的影响
2020-08-19王家平万珊杉李天祎杨素萍
杨 扬, 王家平, 万珊杉, 李天祎, 杨素萍
慢性肾脏病(chronic kidney disease,CKD)患病率逐年增高,调查显示全球总患病率为10.8%,我国就有约1.195亿CKD患者[1]。CKD是由多种原发性或继发性肾脏疾病持续性发展而来,随着病程进展,出现肾小球硬化及肾间质纤维化病理改变,临床上表现为肾小球滤过率进行性下降,尿蛋白显著增加,最终肾衰竭,治疗方式仅为透析或肾脏移植,手段有限。骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)作为再生医学中修复损伤组织和脏器的种子细胞,能够靶向归巢至受损组织及炎症部位,通过直接分化为肾脏固有细胞、旁分泌多种细胞因子促进血管再生,减少足细胞损伤并延缓肾脏纤维化,对受损肾组织发挥积极的修复作用[2-5]。然而不同的BMSC移植途径将直接影响其归巢至受损肾组织的数量,从而影响其对受损肾脏的修复作用。本研究旨在评估经肾动脉移植BMSC对阿霉素肾病大鼠受损肾组织的修复作用及对肾脏纤维化的影响。
1 材料与方法
1.1 实验材料
50只清洁级雄性Sprague-Dawley大鼠由昆明医科大学动物中心提供。2只为4周龄,用于体外分离培养BMSC;48只16周龄,用作实验分组,体质量(356±18)g,其中36只用于构建CKD动物模型,12只为正常对照组。主要试剂:胎牛血清(FBS)和低糖培养基(L-DMEM)(美国Gibco公司),阿霉素(美国Sigma公司),青链霉素双抗和0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化液(北京索莱宝科技公司)。
1.2 阿霉素慢性肾病动物模型构建和实验分组
购进大鼠后适应性喂养1周,期间予以自由饮食。固定大鼠,经尾静脉注射阿霉素,第1次剂量为3 mg/kg,间歇14~20 d予以相同剂量第2次注射,之后每周尾静脉采血测血肌酐、血尿素氮水平,收集24 h尿液检测24 h尿蛋白含量,以血肌酐、血尿素氮和24 h尿蛋白水平升高,肾脏病理切片苏木精-伊红(HE)染色示慢性肾病改变为造模成功标准,平均时间约为7周。将造模成功大鼠随机分为3个组:模型组(CKD组)、经尾静脉移植BMSC组(V-M组)和经肾动脉移植BMSC组(A-M组),每组各12只;剩余12只健康大鼠为正常对照组(N组),经尾静脉输注等量0.9%氯化钠溶液。
1.3 BMSC体外分离培养
采用全骨髓贴壁培养法分离纯化大鼠BMSC。2只4周龄清洁级SD大鼠,体质量80 g,脱颈处死,75%乙醇全身浸泡10 min,0.9%氯化钠溶液冲洗干净;超净工作台下取双侧股骨、胫骨,剔除肌肉等组织,剪去骨骺端,暴露骨髓腔,用5 mL注射器抽取磷酸缓冲液(PBS)冲洗骨髓腔3~5次,直至观察到骨髓腔变白;收集骨髓腔冲洗液于离心管中,充分吹打混匀,100 μm细胞筛过滤后,1 500 r/min离心5 min,轻轻倒去 PBS,用含 10%FBS、1%青链霉素双抗的L-DMEM重悬细胞,再次充分吹打混匀,制成单细胞悬液,接种至T25细胞培养瓶中,置于37℃、5%CO2细胞培养箱中孵育;48 h后首次换液,以后每隔3 d换液1次。待细胞生长融合达90%~100%时,用 0.25%胰蛋白酶-EDTA 消化细胞,按 1∶4比例传代。取P3代细胞进行成骨、成脂诱导分化培养,流式细胞仪行细胞表面抗原鉴定。
1.4 不同途径移植BMSC
将生长状态良好、融合度达100%的BMSC用0.25%胰蛋白酶-EDTA消化,倒置相差显微镜下见细胞呈圆形后加入L-DMEM培养基终止消化,1 500 r/min离心5 min,弃上清液,PBS重悬细胞,充分吹打混匀制成单细胞悬液,细胞计数器计数细胞,调整单细胞悬液成2×106个/mL,冰盒保存备用。A-M 组大鼠:10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,仰卧位固定于手术台,剃除颈部毛发,聚维酮碘消毒,铺无菌手术单;充分暴露颈部,正中做约4 cm垂直切口,钝性分离出左颈总动脉,眼科剪在左颈总动脉作T字型切口,参照文献[6]方法插入PE10导管,DSA下动态观察,直至导管推送至右肾动脉,注射少量对比剂证实后推注500 μL BMSC悬液;术毕结扎左颈总动脉,逐层缝合颈部手术切口,肌内注射抗生素预防感染,将大鼠放置保温箱中,密切观察,待其自然清醒后归笼继续饲养。
V-M组大鼠:经尾静脉注射等量BMSC悬液。CKD组大鼠:经尾静脉注射等量PBS。N组大鼠:经尾静脉注射等量0.9%氯化钠溶液。
1.5 样本收集与检测
分别于移植BMSC后第7、14天,将各组大鼠放入代谢笼内,收集24 h尿液,尾静脉采血分离血清;采用Chemray 240型全自动生化分析仪检测24 h尿蛋白、血肌酐和血尿素氮水平。移植BMSC后第14天处死各组大鼠,快速取肾,固定脱水后制成5 μm石蜡切片,行HE染色和Masson三色染色,观察肾脏结构病理改变及纤维化情况。纤维化评分标准:根据病变由轻至重程度,依次半定量评估,极少量或无病变为“-”记 0,轻度或少量“+”记 1,中度或中等量“++”记 2,重度或多量“+++”记 3,极重度或大量“++++”记 4。
1.6 统计学方法
采用SPSS 23.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较用重复测量资料方差分析,两两比较用最小显著性差异t检验,检验水准 α=0.05。
2 结果
2.1 BMSC 分离、纯化和鉴定
倒置相差显微镜下见大鼠BMSC呈多角形、梭形,“鱼群状”或“旋涡状”贴壁生长。成骨诱导培养28 d后行茜素红染色,可见被染成橘红色的钙结节;成脂诱导培养20 d后行油红O染色,可见被染成红色的脂滴(图 1)。P3代 BMSC表面抗原CD11b、CD45、CD29、CD90 表达率分别为 2.23%、1.94%、99.98%、99.97%。

图1 倒置相差显微镜下大鼠P3代BMSC及诱导分化培养结果
2.2 BMSC移植治疗结果
与N组相比,CKD组、V-M组、A-M组血肌酐、血尿素氮、24 h尿蛋白均显著升高(P<0.01)。 移植BMSC后第7天,与CKD组比较,V-M组、A-M组24 h尿蛋白均降低(P<0.05),且 A-M 组低于 V-M组(P<0.05);V-M 组血肌酐、血尿素氮与 CKD 组相比无明显改善,但A-M组较CKD组改善明显(P<0.01)。 移植 BMSC后第 14天,V-M 组血肌酐、血尿素氮较CKD组有所下降,差异无统计学意义(P>0.05),但 A-M 组与 V-M 组、CKD 组相比下降明显 (P<0.05);V-M 组、A-M 组 24 h尿蛋白水平仍低于 CKD 组,但差异无统计学意义(P>0.05)(表 1)。
2.3 肾组织HE染色和Masson三色染色结果
N组肾组织HE染色未见明显病理改变,肾小球大小和形态均一、正常,基底膜正常,间质无炎性细胞浸润,肾小管无萎缩;Masson三色染色未见胶原纤维沉积,评分0分。CKD组HE染色见大量肾小管间质炎性细胞浸润伴结缔组织增生,肾小管萎缩,管腔变小,基底膜增厚,肾小囊腔扩张,大量肾小球损伤,毛细血管扩张并出现空泡、系膜增厚、细胞减少,呈局灶节段性硬化改变;Masson三色染色见大面积肾小管间质及肾小球囊周围胶原增生,纤维化评分为3分。V-M组HE染色见较多肾小管间质炎性细胞浸润伴结缔组织增生,肾小管扩张,上皮细胞扁平化,腔内充满蛋白液,形成肾小管管型,部分肾小管萎缩,基底膜增厚,个别肾小球坏死;Masson三色染色见肾小管间质纤维增生,评分为2分。A-M组HE染色见少量肾小管间质炎性细胞浸润伴少量结缔组织增生,部分肾小球出现囊腔扩张,空泡变性及毛细血管扩张程度下降,肾小管萎缩数量减少,基底膜存在不同程度增生,少量肾小管内充满嗜酸性蛋白液形成管型;Masson三色染色可见少量蓝色着染胶原纤维,评分为1分,见图2。

表1 移植BMSC后各组大鼠血肌酐、血尿素氮、24 h尿蛋白值比较 n=12
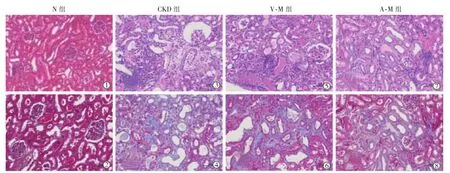
图2 各组大鼠肾脏HE染色和Masson三色染色病理图片(×200)
3 讨论
阿霉素经注射后主要累积在肾脏,氧化后产生大量氧自由基,在多种活化因子作用下能诱导肾小球上皮细胞损伤,破坏滤过膜,从而造成肾脏损伤。这是经典的肾病模型构建方法。根据造模时间和给药次数不同,可分为急性肾病模型和慢性肾病模型[7]。急性肾病模型造模时间较短,单次大量注射阿霉素后4周左右即可成模型,病理类型为微小病变型肾病,类似人类肾病综合征;慢性肾病模型造模时间相对较长(>5周),且需多次给药,病理类型为局灶节段性肾小球硬化型肾病,类似人类慢性肾小球肾炎。值得注意的是,阿霉素亦对其他脏器有强烈的毒性作用和不良反应,实验过程中引起造模大鼠死亡的原因主要有胃肠出血、肠胀气、腹水、心肌损伤及肺肿瘤等[8],这与给药剂量和给药间歇时间密切相关。本研究中采用尾静脉注射阿霉素造模,首次剂量为3 mg/kg,间歇14~20 d以相同剂量再次给药,约7周成功建立CKD模型。与大剂量(>4 mg)、间歇1周再次给药的造模方法相比,在造模时间相近前提下,显著降低了大鼠死亡率,有效保证了实验动物数量,而与单侧肾切除联合阿霉素注射法相比,该法操作简单,效率较高。
目前,BMSC已被证实对慢性肾病确有一定的治疗作用,但具体机制尚不清楚。研究表明,注射BMSC能显著改善CKD大鼠肾功能,肾脏损伤程度较小的2/3肾切除组治疗效果优于损伤程度重的5/6肾切除组,经BMSC处理后巨噬细胞(ED-1阳性细胞)数、α-平滑肌肌动蛋白(SMA)及增殖细胞核抗原(PCNA)表达显著降低(P<0.01),Masson 染色示肾间质纤维化和肾小球硬化程度下降,提示早期进行 BMSC干预 CKD大鼠治疗效果更优[9]。Villanueva等[10]等研究结果与上述研究一致,不同的是其采用尾静脉单次移植BMSC,结果表明BMSC可增强肾脏修复过程,显著改善肾功能,并发现血管生成标志物血管内皮细胞生长因子(VEGF)和血管生成素家族受体Tie-2表达增加,推测BMSC对CKD受损肾组织的修复作用可能与诱导肾血管生成途径有关。白彝华等[11]通过颈动脉肾动脉插管输注BMSC至阿霉素CKD大鼠受损肾组织,发现血肌酐、尿素氮明显下降,血红蛋白显著升高,肾脏HE染色示BMSC处理组大鼠肾组织中炎性细胞浸润程度下降、范围减小,提示经肾动脉移植BMSC有助于CKD肾组织修复。上述研究均表明BMSC对CKD具有治疗作用,观察指标主要是肾功能测定,如血肌酐、尿素氮、24 h尿蛋白、血清白蛋白等变化,而与CKD疾病后期发展至肾脏纤维化有关的文献报道并不多。本研究通过对比尾静脉和肾动脉两种途径移植BMSC治疗阿霉素CKD大鼠发现,两种途径均对受损肾组织发挥修复治疗作用,移植后第7天V-M组、A-M组24 h尿蛋白与CKD组比较均降低(P<0.05),且A-M组低于V-M组(P<0.01),一直至第14天 A-M组、V-M组24 h尿蛋白水平仍低于CKD组;A-M组血肌酐、尿素氮水平较CKD组、V-M组下降,说明在移植BMSC后一段时间内,经肾动脉移植BMSC对CKD大鼠治疗效果优于经尾静脉移植;各组大鼠肾脏HE染色和Masson三色染色分析发现,BMSC干预可减少CKD大鼠肾组织炎性细胞浸润,萎缩肾小管数量减少,扩张肾小管趋于正常,基底膜虽然仍存在不同程度增生,但与CKD组相比,BMSC干预后情况有所改善;随着病程延长,大鼠肾纤维化程度加深,主要表现为肾间质纤维化和肾小球硬化,Masson染色见CKD组肾组织出现大面积蓝染物质沉积于肾间质和肾小球囊周围,而移植BMSC后发现肾组织中蓝染面积缩小,着色程度减轻,说明BMSC移植治疗能减轻或延缓CKD大鼠肾脏纤维化,修复肾组织。
综上所述,BMSC移植疗法可修复CKD大鼠受损肾组织,且在一定时间内,肾动脉途径移植治疗效果要优于尾静脉途径,可能与干细胞归巢至肾组织数量有关[6]。此外,BMSC可抑制或延缓肾脏纤维化,并发挥积极的治疗作用,但具体作用机制尚不清楚。有研究提出细胞外基质(extracellular matrix,ECM)过度沉积,可能是导致肾间质纤维化和肾小球硬化的原因,肾间质纤维化由ECM在基底膜和管周毛细血管之间沉积导致,肾小球硬化则可能是内皮细胞或足细胞代谢,机械或免疫损伤引起ECM在肾小球系膜细胞中增加所致[12]。但本研究未涉及信号通路、分子机制研究,有待于进一步研究证实。
