微粒-TACE联合伊马替尼治疗进展期胃肠道间质瘤肝转移临床疗效观察
2020-08-19杨孔武穆茂媛石明涛杨明镇石荣书
敖 劲, 杨孔武, 穆茂媛, 石明涛, 利 峰, 蔡 争, 杨明镇, 石荣书
肝脏是胃肠道间质瘤(GIST)最常见的转移部位,20%~60%GIST 转移发生在肝脏[1]。 因此,肝转移控制的程度是决定患者长期生存的主要因素之一[2]。目前针对转移性 GIST(MGIST)的标准治疗推荐伊马替尼作为一线治疗[3]。中国胃肠间质瘤诊断治疗共识(2013年版)推荐对于部分无法实施外科手术的GIST肝转移患者。肝动脉栓塞(HAE)可以考虑作为姑息治疗方式[4]。
既往研究证实TACE治疗GIST肝转移瘤取得良好的疗效[5-7]。复习国内外文献TACE/TAE治疗GIST肝转移所运用的栓塞剂有:碘化油[7]、PVA 颗粒[2]、Embosphere®[8]以及 Bead Block。
1 材料与方法
1.1 一般资料
回顾性分析2013年1月至2019年1月于遵义医科大学附属医院接受GSMs-TACE治疗的50例GIST患者。选入标准:①根据《中国胃肠间质瘤诊断治疗共识(2013 年版)》[4]明确 GIST 肝转移;②原发性病灶切除术后规律口服伊马替尼大于6个月以上,且影像学检查评估肝内肿瘤进展;③无法外科手术或消融手术治疗;④肝功能Child-Pugh分级为 A、B级;⑤无严重心、肺、肾等脏器功能异常及出凝血正常;⑥预计生存期在3个月以上。剔除标准:肝外转移;肿瘤占整个肝脏比例≥70%;肝功能Child-Pugh分级为C级;ECOG体力评分>2分;过敏体质或者有肝外重要脏器器质性病变;依从性差,无法规律随访或治疗。符合入组标准的9例患者(见表1)。其中男6例,女3例,年龄为39~72岁,平均(55.0±11.6)岁。 GIST 原发肿瘤位于小肠 4 例,直肠1例,十二指肠1例,腹膜后3例。所有患者GSM-TACE术前均接受临床体格检查、实验室检查和增强CT或MRI。
1.2 方法
1.2.1 治疗方法 采用Seldinger法穿刺右侧股动脉,5 F RH导管常规行腹腔动脉、肝总动脉造影,根据肿瘤部位、大小及肿瘤染色是否完整等情况,辅助行膈动脉、肠系膜上动脉、胃左动脉、右肾动脉等造影,以明确肿瘤所有供血动脉,然后以2.7 F微导管超选择插管至供血动脉,不能超选择插管则行肝段栓塞。根据肿瘤大小选择顺铂(60~100 mg)或洛铂(20~40 mg)以注射用水稀释至 60~90 mL,选择直径 150~350 μm 或 350~560 μm GSM(杭州艾力康医药科技有限公司,规格:100 mg,产品批号:080722)混合成微粒悬浮液,于肿瘤区域供血动脉内,透视下经导管缓慢推注微粒悬浮液,栓塞停止标准是肿瘤染色完全消失,区域动脉内血流停滞。术后常规予以4~7 d保肝、补液对症治疗。
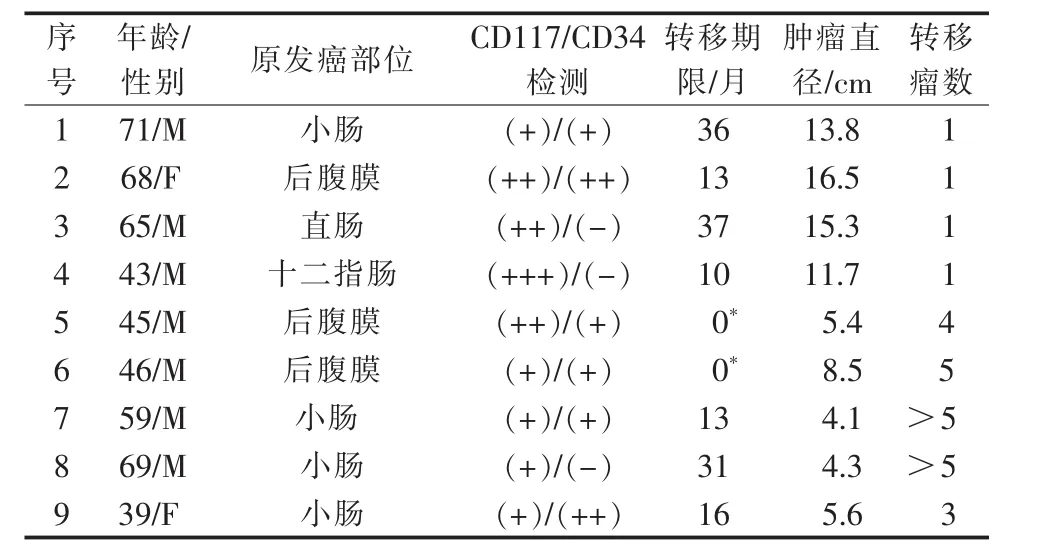
表1 患者一般临床资料及伊马替尼治疗情况
1.2.2 伊马替尼治疗方案 所有患者TACE术后第4天开始服用伊马替尼,初始剂量为每天300 mg或400 mg,建议饭后服用,直至患者病情出现进展,或因不能耐受药物不良反应而停药。
1.2.3 疗效及不良反应的评定 ①术后1周行肝脏CT平扫,术后1、3、6和12个月行增强CT检查以观察病灶坏死程度,大小变化,以及是否存在残余病灶或新发病灶,以后每半年行增强CT检查1次,用于评估治疗效果及确定是否需要再次接受介入治疗。随访截止至2019年1月。无进展生存期(progression-free survival,PFS)为首次接受 TACE 治疗到肿瘤发生进展或(因任何原因)死亡之间的时间。总生存期(overall survival,OS)为首次接受 TACE开始至死亡的时间。②肿瘤反应的评价参照改良实体肿瘤评价标准(mRECIST):完全缓解(CR):所有目标病灶动脉增强显影全部消失;部分缓解(PR):目标病灶动脉增强长径总和缩小≥30%;病变进展(PD):基线病灶长径总和增加≥20%或出现新病灶;病变稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。
1.3 统计学方法
采用SPSS19统计软件进行统计分析:计数资料采用χ2检验,P<0.05为差异有统计学意义,生存率采用Kaplan-Meier统计方法。
2 结果
2.1 生存时间和生存率
随访时间(6~48 个月),中位生存时间(24±4.4)月。截止至2019年1月本组患者全部存活,无失访。
2.2 疗效评估
截止发稿,根据mRECIST 1.1标准评价肿瘤反应(表2)。完全缓解4例,部分缓解5例,无新发展病灶及肝外转移病例。
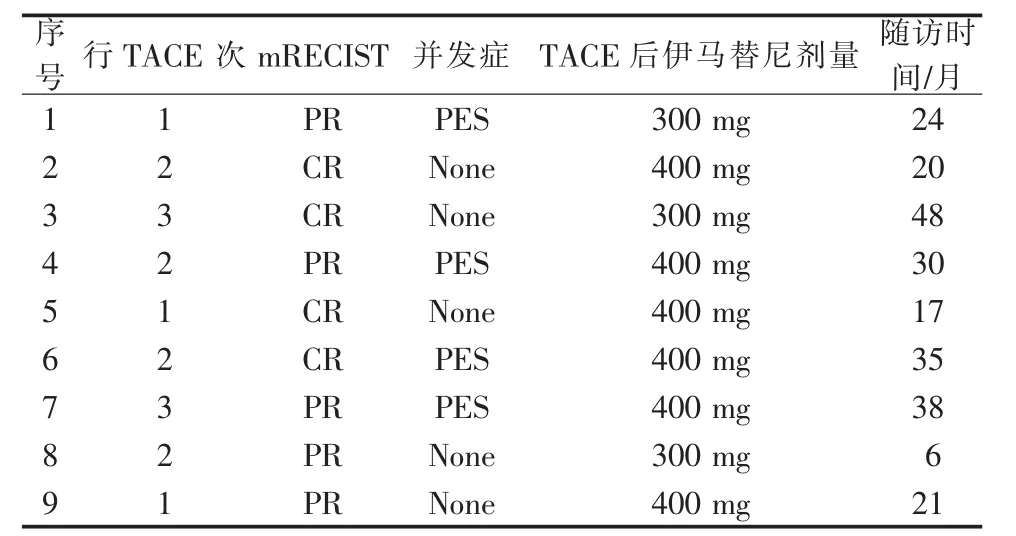
表2 GSMs-TACE联合伊马替尼治疗的临床疗效评估
2.3 栓塞后并发症
9例患者共行17次TACE手术。术后均有不同程度胃区不适,恶心呕吐,无发热,剧烈腹痛症状;上述症状在24 h内缓解。所有病例均未见胃肠道出血、肝脓肿、胆管损伤及胆囊坏死等严重并发症。
3 讨论
本研究结果表明,采用GSMs-TACE联合伊马替尼治疗GIST肝转移瘤,为一线治疗失败,且不能外科手术的进展期GIST肝转移患者提供了可选择的治疗方案。肝脏是GIST常见的转移部位,一旦发生肝转移,外科手术联合伊马替尼是比较有效的治疗手段[2]。但是对于肿瘤较大,分布在不同肝段不能外科手术的肝转移瘤,伊马替尼被认为是一线治疗方案。然而,长期使用伊马替尼治疗有80%患者会出现继发性耐药。即使二线或三线治疗的苏尼替尼及瑞戈非尼也分别仅能延长PFS约4.8及3.9个月[9-10]。中国胃肠间质瘤诊断治疗共识(2013年版)推荐对于部分无法实施外科手术的GIST肝转移患者,动脉栓塞(TAE)可以考虑为姑息性治疗方式[4]。
前期关于TACE/TAE在GIST肝转移治疗中的价值得到认可,但是行TACE/TAE如何选择栓塞剂目前国内外没有统一标准。林均华等[11]国内学者首次报道4例GIST肝转移患者,选择碘化油联合明胶海绵动脉栓塞,结果显示未见明显疗效。Cao等[7]回顾分析了60例对伊马替尼耐药的GIST伴肝转移的患者,其中22例TACE联合TKI或支持治疗,中位生存时间68.5周,明显优于单纯伊马替尼及支持治疗对照组25.7周。但是,Cao等[8]回顾分析了45例伊马替尼耐药GIST肝转移患者,其中19例选用Embosphere®-TAE与常规碘化油联合明胶海绵栓塞比较,结果显示Embosphere微球栓塞的反应率及延期肿瘤进展均优于传统的碘化油栓塞。国外学者报道110例GIST肝转移的患者接受PVA颗粒-TACE联合TKI治疗,其中85例进行确切影像学评估,中位生存时间为 17.2 个月[5];Kobayashi等[6]研究报道14例GIST肝转移患者,选用PVA颗粒行TACE治疗,其中13例进行确切影像学评估,1例PR,12例SD,中位生存时间为9.7个月。本研究采用GSM-TACE联合伊马替尼治疗中位生存时间达24.4个月,优于既往选择TACE的文献治疗报道,分析原因与本研究病例较少,可能有偏差,但同时也说明GSMs-TACE方法具有良好的初步临床疗效。
肝脓肿是肝内恶性肿瘤行TACE治疗严重的并发症之一。GIST肝转移瘤TACE治疗术后同样有并发肝脓肿的报道;有学者报道14例GIST肝转移患者选择Embosphere®Microspheres、Bead Block®及 Embozene®Microspheresl作为栓塞剂,在24次TACE 过程中并发肝脓肿 1 例[6];Maluccio 等[12]报道的24例患者,采用PVA微球栓塞,45次TACE并发肝脓肿2例;Cao等[8]报道的19次TACE中并发2 例肝脓肿;Stampfl等[13]在动物模型实验中,选用不同直径的Embozene微球栓塞肝动脉证实,肿瘤及正常肝组织坏死程度与栓塞微球大小及密度有密切观察。本研究采用直径为150~350 μm、350~560 μm可吸收性GSM作为栓塞剂,在17次的TACE中,不仅肿瘤坏死比较彻底,而且均无肝脓肿形成,表明GSM在GIST肝转移瘤动脉栓塞是比较安全的。
本研究不足,首先是小样本单中心回顾性研究报道,以后将进行多中心、大样本、长期随机对照研究,以进一步证实GSM-TACE治疗GIST肝转移瘤的有效性和安全性。
总之,尽管目前研究病例数较少,初步的临床观察结果表明GMS-TACE联合伊马替尼治疗胃肠道间质瘤肝转移是安全的、有效的。
