PD-1抑制剂致免疫相关性肺炎1例
2020-08-19吴镜强周静文何明基陈德基朱康顺
吴镜强, 周静文, 练 辉, 何明基, 陈德基, 朱康顺
T细胞中表达的PD-1受体与其配体PD-L1和PD-L2结合,可以抑制T细胞增殖和细胞因子生成。部分肿瘤细胞的PD-1配体上调,通过这个通路信号传导可抑制激活的T细胞对肿瘤的免疫监视[1]。纳武单抗(nivolumab)是一种作用于程序性死亡分子受体1(programmed death-1,PD-1)的人类免疫球蛋白G4(IgG4)单克隆抗体,纳武单抗通过阻断PD-1与PD-L1,PD-L2的结合,重新激活并促进机体T细胞的抗肿瘤效应,现已广泛应用在各种实体肿瘤中,在肝癌的治疗中具有良好的应用前景,但同时也带来了药物导致的免疫相关性不良反应。免疫相关性肺炎(immune-mediated pneumonitis,IMP)是其严重的免疫相关性不良反应(immune-related adverse events,irAEs)。本文报道1例使用纳武单抗后出现的免疫相关性肺炎。
1 病例资料
患者,男,62岁。因“免疫治疗后4周,气促5 d”入院。患者于2018年7月因“腰部肿物”行CT检查发现巨块型肝癌并右侧腰大肌转移,2018年8月至12月期间共行3次TACE及2次腰大肌转移瘤微波消融术,并于2018年12月开始服用索拉非尼靶向药物治疗。患者于2019年1月14日和1月28日各行一次PD1抑制剂纳武单抗180 mg治疗。2次免疫治疗均无特殊不适并出院。同年2月10日开始无明显诱因出现气促,无发热、寒战,无明显咳嗽、咯痰等。入院后查体:体温37.2℃,心率 95次/min,呼吸 20次/min,血压122/97 mmHg(1 mmHg=0.133 kPa),血氧饱和度 98%,体重 59 kg。神志清,全身皮肤及巩膜黄染,口唇无紫绀,颈静脉无怒张,双肺呼吸音低,右肺明显,双肺未闻及明显干湿性啰音,心律齐,无病理性杂音。腹平软,无压痛及反跳痛,肝脾肋下未闻及,右侧腰可触及一巨大肿块,双下肢轻度浮肿。
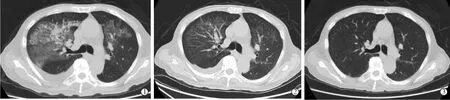
图1 病程中肺CT图像
入院后完善实验室检查:白细胞计数13.6×109/L,脑钠肽(BNP)3 198 ng/L。胸部CT提示双肺炎症(图1①)。予甲泼尼松琥珀酸钠针(甲强龙)80 mg 2次/d治疗,5 d后复查:白细胞10.82×109/L,BNP 3 045 ng/L;CT提示炎症较前吸收(图1②)。遂减量至甲强龙80 mg/d治疗,5 d后再次检查:白细胞9.02×109/L,BNP761 ng/L,再次复查 CT提示双肺炎症基本吸收(图1③)。遂予甲强龙逐步减量,患者恢复良好出院并改口服甲泼尼龙片40 mg/d继续维持治疗。
2 讨论
本例为肝癌晚期患者,该患者采用了多方法的综合治疗,包括介入治疗(TACE、消融等)、系统治疗(靶向治疗、抗病毒治疗、免疫治疗)等[2]。查阅患者治疗史及用药史,既往无肺部放射治疗史,查阅该患者使用的其他药物相关文献,无记载相关肺部不良反应。患者使用两次纳武单抗治疗4周后出现明显的肺部症状,CT提示明显的间质性肺炎。查阅纳武单抗说明书,在接受纳武单抗单药治疗的患者中,包括间质性肺病和肺浸润在内的肺炎发生率为3.4%。大多数病例的严重程度为1级或2级,分别有0.8%和1.7%患者,3级和4级分别有0.7和<0.1%患者。至发生的中位时间为3.6个月(0.2~19.6 个月)。
本例患者依据常见不良反应事件评价标准中关于肺炎的分级中,该患者评价为3级(重度症状、影响个人日常生活活动、需要吸氧)。对于3级或4级肺炎,必须永久停用纳武单抗治疗,应按照2~4 mg/kg甲泼尼龙当量开始皮质类固醇治疗,并监测患者肺炎症状及体征,包括放射性改变(例如毛玻璃样改变、斑片状浸润)。
目前,纳武单抗致IMP的机制仍不明确。Weber等[3]研究提示,在经PD-1抑制剂治疗发生免疫相关性不良反应的患者的正常组织中,通常都可以观察到T淋巴细胞的浸润和激活,而这种现象可能在IMP的发生、发展过程中起作用。纳武单抗致IMP的临床表现主要为呼吸困难、咳嗽和发热等肺炎常见症状,影像学检查最主要的特征为肺磨玻璃样影改变,也可表现为网格状阴影、实变影、小叶结节和胸腔积液[4]。该患者在使用纳武单抗治疗两次后出现气促等症状,CT提示磨玻璃样改变,给予甲泼尼龙治疗后症状及影像学均有缓解,考虑为纳武单抗治疗后所致的免疫相关性肺炎。
