一株降解PHB菌株的分离、鉴定及特性
2020-08-19王振乾李骏鸣邓元告隋丽英
王振乾,李骏鸣,邓元告,隋丽英
(天津科技大学亚洲区域卤虫参考中心,天津科技大学海洋与环境学院,天津 300457)
塑料制品在方便了人类生活的同时,也给地球带来了“白色污染”,日益严重的污染引发了社会各界持续的关注.
聚-3-羟基丁酸酯(poly-3-hydroxyobutyrate,PHB)是细菌在营养限制条件下积累的胞内产物,以颗粒状态存在于细胞中,具有贮藏能量和降低细胞内渗透压等作用[1].PHB除了具有热塑性、生物相容性、光学活性和压电性[2],还具有生物可降解性,是可替代石化合成塑料的原料物质[3].作为 PHB单体的3-羟基丁酸,是抗生素、维生素、芳香素和信息素等化学合成必不可少的手性单体[4].3-羟基丁酸也是生物体内一种常见的物质,在动物的新陈代谢中起重要作用[5],越来越受到人们的关注.
PHB 的相对分子质量为 3.0×107~8.0×107.某些微生物在碳源限制的条件下,利用胞外降解酶将PHB降解为 3-羟基丁酸单体.该有机酸可渗透进入细胞膜,在胞内进一步通过脂肪酸 β-氧化过程和三羧酸循环(TCA),在有氧条件下产生 CO2和水,在厌氧条件下产生甲烷[6].从环境中分离得到的 PHB降解菌大多为细菌和真菌.细菌主要有产碱菌(Alcaligenes)、丛毛单胞菌(Comamonas)、假单胞菌(Pseudomonas)和土壤杆菌(Agrobacterium);真菌包括曲霉(Aspergillus)、拟青霉菌(Paecilomyces)和青霉(Penicillium)等[5,7].
PHB生物降解也有其自身的独特性,作为微生物合成的碳源和能量储存材料,在细胞内很容易被降解;但是,当外界环境与细胞内差异较大,导致 PHB很难被降解.PHB在细胞内是以非晶态存在的[8],但是商品化的PHB大多是具有很高结晶度的半晶态粉末,性质的改变同样导致生物降解难度加大.这就使得研究 PHB高效生物降解与合成同等重要.国际上从20世纪60年代开始陆续开展了这方面的工作,并已分离出了数十种可降解 PHB的菌种.在我国,PHB相关研究起步相对较晚,研究热点是利用微生物高效合成 PHB,只有东北师范大学陈珊教授团队做了部分这方面的研究,分离到几株具有降解 PHB性能的真菌[9-10].
草酸青霉广泛存在于土壤和活性污泥等环境中.草酸青霉细胞分泌多种酶类,可用于生物降解石油烃、果胶、木质纤维素和含磷农药等[11-14],而关于草酸青霉降解 PHB报道较少[7].本文从活性污泥中分离得到一株高效降解PHB的草酸青霉菌PHBd-1,并对其 PHB降解特性进行了初步研究,旨在为该菌株在PHB降解中的应用提供数据支撑.
1 材料与方法
1.1 富集与筛选
活性污泥于 2014年 10月采自天津市东郊污水处理厂.取 1.0g活性污泥,置于 200mL LB富集培养基中培养 72h.取 2mL培养液接种于 200mL PHB-broth中继续培养 72h(28℃,150r/min).将培养液在 LB平板上划线,挑取单菌落接种于 100mL LB富集培养基中培养72h.在PHB平板上挑取产生明显透明圈的菌落.反复纯化 3次,菌株命名为PHBd-1.
LB 富集培养基(g/L):胰蛋白胨 10.0,酵母提取物 5.0,NaCl 5.0.
PHB-broth(g/L):人工海盐 10.0,NH4Cl 0.2和PHB 1.5(纯度 98.0%,Goodfellow 公司)[15].
察氏培养基(g/L):NaNO33.0,K2HPO41.0,MgSO4·7H2O 0.5,KCl 0.5,FeSO40.01 和蔗糖 30.0.
以上培养基 pH=7.2.固体培养基在上述配方中添加 1.5%琼脂.一定盐度的培养基以浓缩卤水稀释为相应盐度配制.
1.2 菌株形态及分子生物学鉴定
采用点植法在普通察氏培养基与盐度 3.0%的察氏培养基上接种PHBd-1,在28℃下分别培养6d和9d,观察菌落形态.从平板上轻轻地刮下成熟孢子,制成水封片,置于显微镜下观察孢子形态[16].
取普通察氏培养基培养 3d的新鲜菌落,加液氮研磨成粉末.提取菌株基因组 DNA(天根生化科技(北京)有限公司),采用真菌通用引物 ITS1∶5′-TCCGTAGGTGAACCTGCGG-3′,ITS4∶ 5′-TCCTC CGCTTATTGATATGC-3′进行 rDNA 内转录间隔区(ITS)序列扩增.PCR 反应体系(50.0μL):Mix 25.0μL,ddH2O 17.5μL,引物各 2.5μL,DNA 模板2.5μL.PCR 反应条件:95℃预变性 10.0min;95℃变性 30s,56℃退火 30s,72℃延伸 2min,30 个循环;72℃延伸10min.PCR产物送北京六合华大基因科技有限公司测序.将测得的ITS序列在CBS数据库中进行比对,采用 Neighbor Joining法构建系统发育树.采用 Mega v5.0 软件 Clustal W 算法进行看家基因序列比对,使用最大似然估计(maximum likelihood estimation,MLE)算法构建了系统发育树,自展重复抽样次数为1000 次.
1.3 菌株降解PHB颗粒的特性分析
1.3.1 孢子悬浮液制备
菌株于斜面察氏培养基 28℃下培养 72h,加入无菌生理盐水,将孢子洗下并转移至 50mL离心管中,重复3次.在离心管中加入小玻璃球,充分振荡,用灭菌脱脂棉过滤除去菌丝,并用无菌生理盐水冲洗滤渣 3次,将滤液定容至 500mL,得孢子悬浮液.用血球计数板在显微镜下测定孢子数目为 2.0×104mL-1.
1.3.2 菌株培养及pH测定
孢子悬浮液以体积比 1∶20比例分别接种到 24个盛有 100.0mL PHB-broth的三角瓶中,28℃、150r/min 振荡培养.分别在 0.5、1.0、1.5、2.0、4.0、6.0、8.0、10.0d各取出 3个三角瓶,于 4℃、12000g离心50min除去菌丝,上清液用定性滤纸抽滤,进一步除去菌丝.用Mettler FE20型pH计测定pH.将滤液置于4℃冰箱保存,用于解聚酶活力的测定.
1.3.3 PHB颗粒降解率测定
PHB降解率采用差减法测定[17].培养方法及条件同 1.3.2节.根据菌丝生长情况,对培养液进行不同处理,以减少 PHB颗粒在菌丝上的附着.当存在少量菌丝时,离心后将沉淀置于 80%丙酮水溶液中浸泡 2h后,于-20℃冷冻;解冻后去除浮在培养液表面的菌丝,重复 3次;用定性滤纸过滤剩余 PHB,蒸馏水洗涤 3次,80℃下干燥 24h后称量.当几乎不存在菌丝时,用定性滤纸过滤沉淀,蒸馏水洗涤 3次,80℃下干燥 24h后称量.当 PHB几乎全部被降解时,用定性滤纸过滤沉淀,蒸馏水洗涤 3次,80℃下干燥24h后称量.
1.3.4 3-羟基丁酸含量测定
3-羟基丁酸标准品(百灵威科技有限公司,纯度95%)用 5.0mmol/L稀硫酸溶液制作标准曲线,3-羟基丁酸质量浓度分别为 0、0.5、1.0、1.5、2.0mg/mL.滤液用 2mol/L H2SO4溶液调至 pH=2.0.色谱条件参考乳酸的检测方法:Welch Xtimate Sugar-H色谱柱,5.0mmol/L稀硫酸溶液为流动相,柱温40℃,流量0.6mL/min,采用示差折光检测器进行检测[18].
1.3.5 解聚酶活力测定
采用福林酚法测定滤液中可溶性蛋白含量[19],以牛血清蛋白作标准曲线.用比浊法测定 PHB解聚酶活力[10].酶活力单位定义:每分钟引起 650nm 波长的吸光度(A650)降低0.1单位所需酶量为1个酶活力单位.PHB悬浮液的制备:精确称取0.3g PHB粉末,溶解于15.0mL氯仿中,加入0.05g SDS及缓冲液 100mL,超声振荡 30min.去除氯仿后,用蒸馏水定容至 100mL,制备 PHB乳浊液,现配现用.不同pH的 PHB乳化液分别用磷酸盐缓冲液(pH 6.0,50mmol/L;pH 7.2~7.4,10mmol/L;pH 8.0,50mmol/L)和醋酸盐缓冲液(pH 4.5,50mmol/L)制备.
测定pH 6.0条件下,温度分别为30、40、50℃时酶活力.取3.0mL PHB乳化液置于恒温水浴中预热10min,加入 3.0mL PHBd-1菌培养液滤液,40min后,于 650nm波长下测定反应前后吸光度的变化.在 30℃下,分别测定 pH 为 4.5、6.0、7.2、8.0条件下的酶活力,方法同上.
2 结果与分析
2.1 菌株形态
在普通察氏培养基上培养到第6天,菌落直径为50~60mm,初期为淡粉色,成熟后菌落中心为深绿色(图 1).在盐度 3.0%察氏培养基上菌落生长相对较慢,为深棕色,培养第 9天菌落直径为 70~75mm.
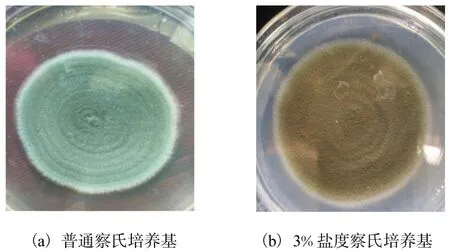
图1 不同培养基培养的PHBd-1菌落形态Fig. 1 Morphology of PHBd-1 colonies in different medium
显微镜下观察,分生孢子梗发生于基质菌丝,孢梗茎帚状枝双轮生,偶尔三轮生或单轮生,较紧密,分生孢子椭圆形(图2).
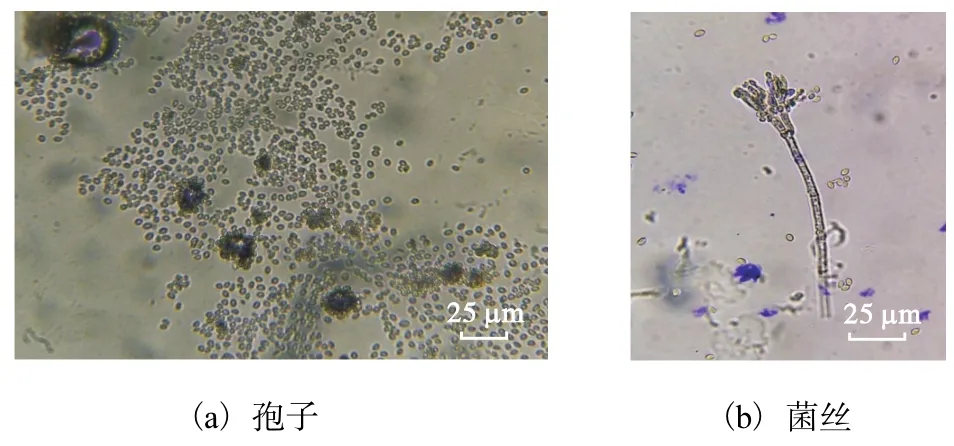
图2 菌株PHBd-1孢子和菌丝形态Fig. 2 Morphology of spore and mycelium PHBd-1
采用点植法在PHB琼脂板上培养PHBd-1单菌落.培养 4d,菌落中心呈浅绿色,边缘呈微粉色,菌落周围出现明显透明圈(图 3).由于菌落的生长,只在边缘才能显示出清晰的透明圈,透明圈可达2.1cm.
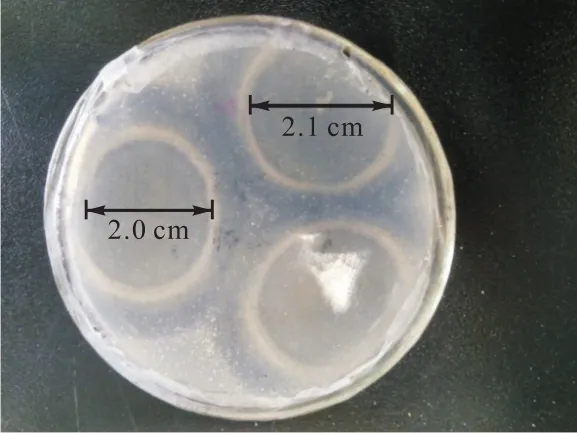
图3 PHBd-1菌株在PHB琼脂上生长呈现的透明圈Fig. 3 Transparent circle around PHBd-1colony on PHB agar
2.2 菌株ITS序列分析
用真菌通用引物ITS1/ITS4对PHBd-1菌株进行PCR扩增,获得目的片段长度为 600~800bp.从CBS上进行数据进比对,构建系统进化树(图 4),实验菌株和草酸青霉菌(Penicillium oxalicum)聚类在一起,结合形态特征分析,将该菌株命名 Penicillium oxalicum strain PHBd-1.

图4 基于菌株PHBd-1的ITS序列建立的系统发育树Fig. 4 Phylogenetic tree based on ITS sequence of PHBd-1
2.3 PHB颗粒降解率、培养液pH和3-羟基丁酸含量
在 10d的培养过程中,PHB颗粒降解率迅速增加,4d后接近100%(图5).与此同时,培养液pH则显著下降,从初始的 pH 7.2逐渐降至第 4天的 pH 3.1,并稳定于pH 2.8左右.
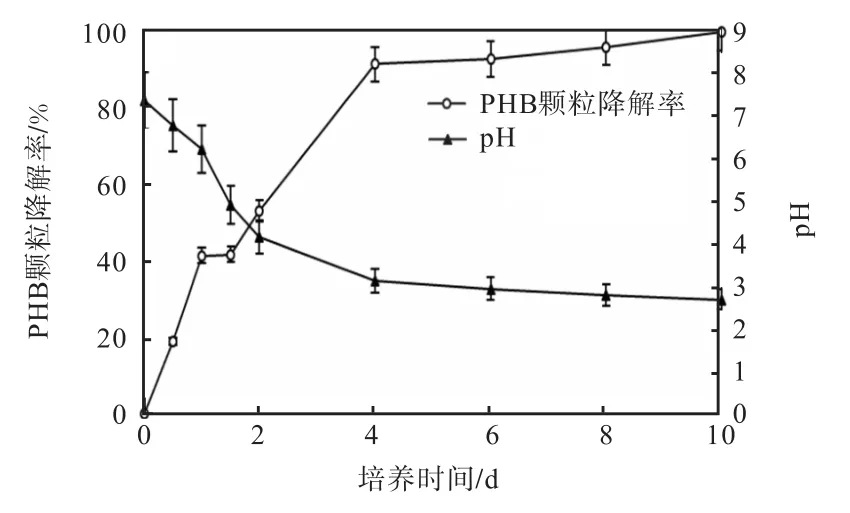
图5 PHB颗粒降解率和培养液pH变化Fig. 5 Degrading rate of PHB particles and pH variations of the medium
培养前 2d时,培养液中的 3-羟基丁酸含量较低(<0.2mg/mL),4~6d时达到最高(1.2mg/mL),8~10d时 3-羟基丁酸含量下降并趋于稳定(0.7mg/mL)(图 6).
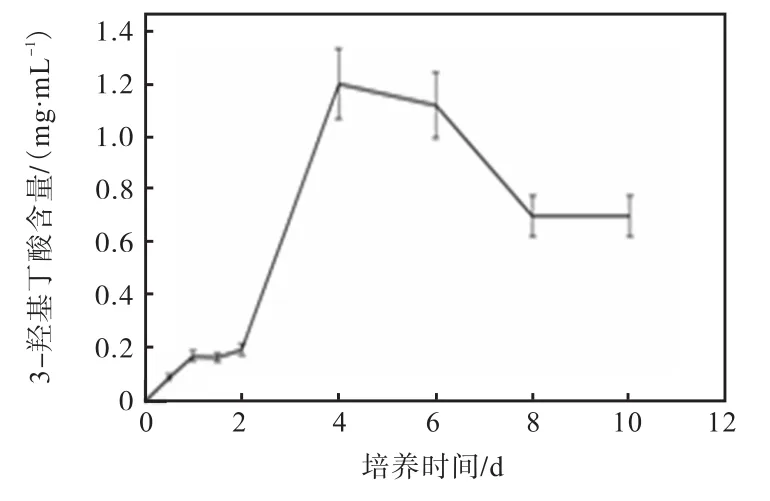
图6 培养液中3-羟基丁酸含量Fig. 6 Content of 3-hydroxybutyrate in the medium
2.4 pH和温度对PHB解聚酶活力的影响
培养过程中,培养液中胞外可溶性蛋白含量逐渐增加,第8天出现峰值(363.0 μg/mL),之后有所降低(图 7).
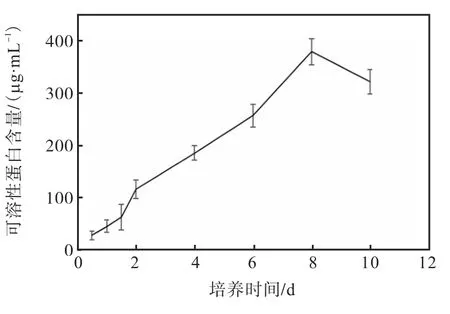
图7 培养液中胞外可溶性蛋白含量Fig. 7 Extracellular soluble protein content in the medium
培养过程中,在 30、40、50℃下培养 1.5d时酶活力达到最高峰(图 8).温度较低时酶活力较高,SPSS 软件统计分析,1.5、2d 时,在 30、40、50℃下酶活力有显著差异(P<0.05),2d后无显著差异(P>0.05).
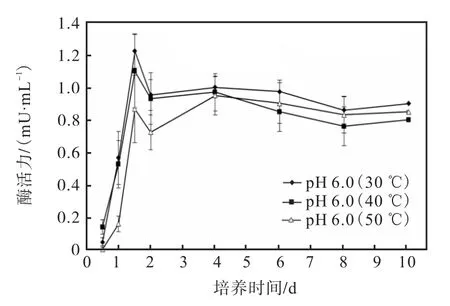
图8 温度对PHB解聚酶活力的影响Fig. 8 Effect of temperature on the degrading enzymatic activity of PHB
在 30℃时,不同 pH下酶活力均在初期有较大提高,pH 4.5时酶活力显著高于pH 6.0、pH 7.2和pH 8.0(图9).pH 4.5条件下,酶活力于培养4d时达到峰值,其余 pH条件下均在培养 1.5d(36h)时达到峰值,之后逐渐下降并趋于平稳.
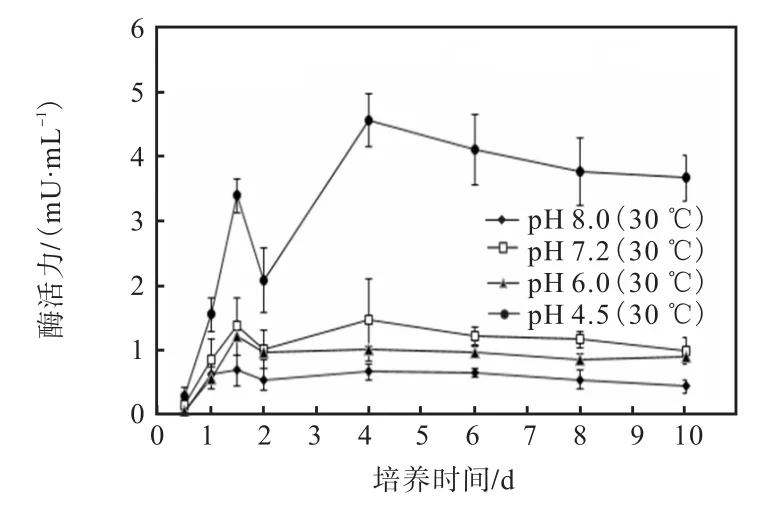
图9 pH对PHB解聚酶活力的影响Fig. 9 Effect of pH on the degrading enzymatic activityof PHB
3 讨 论
王战勇等[20]通过紫外诱变的方法诱变出一株高效降解 PHB的青霉菌(Penicillium sp.),日均降解率由野生株的12.5%提高到20.0%.张敏等[21]将不同比例的聚丁二酸丁二醇酯/聚羟基丁酸酯(PBS/PHB)共混物分别放入土壤培养液和熟化过的堆肥培养液中,通过微生物兹化反应研究降解性;结果表明,共混物在堆肥培养液中降解 60d后的质量损失率达到62%.陈珊等[9]在活性污泥中分离出的可降解 PHB的菌株,并对其最适降级条件进行优化,PHB最大失重率达到 60%.而本研究中,从污水处理厂活性污泥中分离得到一株草酸青霉 PHBd-1.在 4d培养时间内,PHBd-1对 PHB颗粒降解率达到 90.0%,是一株高效降解PHB的菌株.
微生物通过分泌到细胞外的 PHB解聚酶降解PHB,不同微生物所产生的解聚酶类型和作用机理不尽相同.PHB颗粒在解聚酶作用下降解,形成单体和二聚体混合物,二聚体随之在二聚体水解酶作用下形成单体,进入细胞参与代谢[22].本研究中 PHB降解率的提升伴随着培养液 pH的显著下降,推测是由于PHB被菌株所产生的解聚酶降解成可溶性小分子有机酸,主要是3-羟基丁酸及其二聚体或三聚体等.培养前 2d的 PHB降解较快,但此时 3-羟基丁酸含量较低,推测此时菌株大量利用 3-羟基丁酸进行生长.2d后菌株开始大量合成与积累 PHB解聚酶,PHB降解速率加快,3-羟基丁酸含量升高.这也能解释第 2天酶活力突然下降后回升的现象.后期培养液中 3-羟基丁酸的含量出现下降,可能是因为聚-3-羟基丁酸酯基本被降解完,没有新的单体产生,而培养液中 3-羟基丁酸单体的参与到菌体细胞代谢被消耗导致.培养液 pH前期下降主要是大量的 3-羟基丁酸单体产生导致,培养后期由于 pH迅速下降,菌种利用 3-羟基丁酸作为碳源参与代谢,不再产生解聚酶或产生的酶减少,导致剩余聚-3-羟基丁酸酯不能再被降解[23].
不同微生物所产生的PHB解聚酶的最适pH不同.大多数解聚酶的最适 pH为碱性范围(pH 7.5~9.8),但皮氏假单胞菌(Pseudomonas pickettii)和绳状青霉(Penicillium funiculosum)胞外解聚酶的最适 pH分别为5.5和6.0[24].本研究中培养基中粗酶液在pH 4.5时酶活力最高,为酸性酶.pH 4.5条件下,酶活力在培养4d时达到峰值,其余pH条件下在培养1.5d时达到峰值,之后逐渐下降并趋于平稳.推测该酶的合成类型为滞后合成型,待菌株利用部分降解产物生长后再大量分解 PHB胞外解聚酶.温度对酶活力的影响并不显著,因此推测温度可能是通过控制菌株的生长速率来提高PHB的降解率.
致谢:感谢天津科技大学食品科学与工程学院王玉荣老师对本研究提出的建议、化工与材料学院张爱群老师提供的活性污泥样品.
