玉米轴色突变体698-3R的遗传鉴定
2020-08-17余学杰李开兵柯永培石海春
余学杰,李开兵,,张 玉,,柯永培,蔡 林,石海春
(1.四川农业大学 农学院,成都 611130;2.四川农大正红生物技术有限责任公司,成都 610213;3.贵州毕节市农业农村局,贵州毕节 551700;4.山东鑫丰种业有限公司,山东聊城 252400)
种质资源是玉米育种的物质基础,玉米种质资源的研究工作一直被高度重视[1-4]。广泛应用辐射诱变创制新的玉米种质资源,直至选育新品种,是突破玉米育种实践中资源遗传基础狭窄瓶颈的可能技术之一[5-7]。玉米自交系698-3自身综合性状优良,已组配出10多个杂交种,在生产应用上取得了显著的社会经济效益[8],用它作为基础材料进行改良,创制新的优良玉米种质资源的可能性较大。本试验以用60Co-γ射线辐射诱变处理玉米自交系698-3获得的一份红轴突变体698-3R为材料,研究其轴色遗传规律,定位控制该轴色基因,并对其候选基因进行克隆和表达分析,为该突变体的进一步应用研究提供参考。
1 材料与方法
1.1 供试材料
玉米自交系698-3(P1),以及用60Co-γ射线辐射该自交系而获得的一份遗传稳定的红轴突变体,暂命名为698-3R(P2),正、反交F1、B1、B2和F2群体,均由四川正红生物技术有限责任公司提供。其中,经多年田间种植鉴定,亲本698-3和698-3R除轴色有明显差异外,其余主要农艺经济性状无显著差异。
1.2 试验方法
1.2.1 田间试验 在四川和海南构建正交F1(P1×P2)、反交F1(P2×P1)、B1正交[(P1×P2)×P1]、B1反交[(P2×P1)×P1]、B2正交[(P1×P2) ×P2]、B2反交[(P2×P1) ×P2]和F2群体。在公司双流育种基地种植亲本P1、P2,F1正反交群体,B1、B2正反交群体和F2群体。其中亲本和正反交F1代,6行区,每行7穴,每穴2株定苗,种植密度50 000株/hm2,每个分离群体种植1个果穗的全部种子,每穴播种3粒,不间苗。田间考察所有群体果穗的轴色。
1.2.2 红轴基因定位 定位群体为F2代正反交群体,在5~6片叶时,田间取亲本P1、P210株幼嫩叶片混合,F2正反交群体同时单株取样,DNA提取采用2×CTAB法,15 μL PCR反应体系,用6%变性聚丙烯酰胺凝胶电泳扩增产物,银染法检测[9]。根据F2群体穗轴颜色,参照Michelmore等[10]提出的分离群体分组分析法(Bulked segregant analysis,BSA),在F2群体中随机选取红轴和白轴各10个单株,分别取等量DNA混合,建成红轴基因池和白轴基因池。根据在红、白池间筛选的SSR引物情况,对在两池间多态性表现稳定的SSR标记,用F2代正反交群体中全部白轴单株进行PCR扩增,统计白轴单株对应的SSR多态性结果,用红轴单株做验证。将具有白轴698-3带型的单株记为A,具有红轴698-3R带型的单株记为B,具有双亲本杂合带型的单株记为H,用MAPMARKER 3.0软件对F2分离群体的轴色性状和分子标记的分离数据进行连锁分析,利用Kosambi函数将重组率转化为遗传距离(cM)[11]。
1.2.3 候选基因克隆 根据遗传分析与基因定位结果,在MaizeGDB上搜索定位区段附近轴色相关基因,根据结果基因模型为模版使用Oligo 7设计引物,Trizol 法提取穗轴颖片总RNA,PCR扩增目的基因片段,将目的片段连入T5载体(pEASY○R-T5 Zero Cloning Kit,购自TRANS),挑单克隆重复测序,使用DNAMAN对测序结果比对,IBS 1.0序列图绘制软件比对结果作图。
1.2.4 表达分析 取698-3R和698-3自然授粉后5、10、15、20和25 d(DAP)的穗轴颖片;Trizol 法提取总RNA,TaKaRa试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)去除基因组DNA与反转录,SYBR荧光染料法(UltraSYBR Mixture 试剂盒,康为世纪生物科技有限公司),基因相对表达量计算采用Livak等[12]方法,利用Excel 2007进行相对表达量作图;PCR反应在C1000TMThermal Cycler PCR仪上进行,CFX96 Real-Time System进行荧光收集;内参为β-Actin;每个时期各材料均取3株样,做3次技术重复。
2 结果与分析
2.1 突变体698-3R轴色的遗传规律
对各群体果穗轴色分离情况进行统计分析(表1)表明:所有698-3果穗均为白轴,698-3R、正反交F1果穗和以698-3R为轮回亲本的2个回交B2群体的果穗均表现为红轴,说明698-3R红轴性状受细胞核显性基因控制;2个正反交F2群体的果穗出现分离,经χ2检验,红轴与白轴符合 3∶1分离比例,2个回交B1群体则符合1∶1分离比例,所有正反交组合轴色分离比例一致,不受细胞质效应影响,表明该突变体穗轴颜色是受1对核基因控制,将该基因暂定名为C(t)。
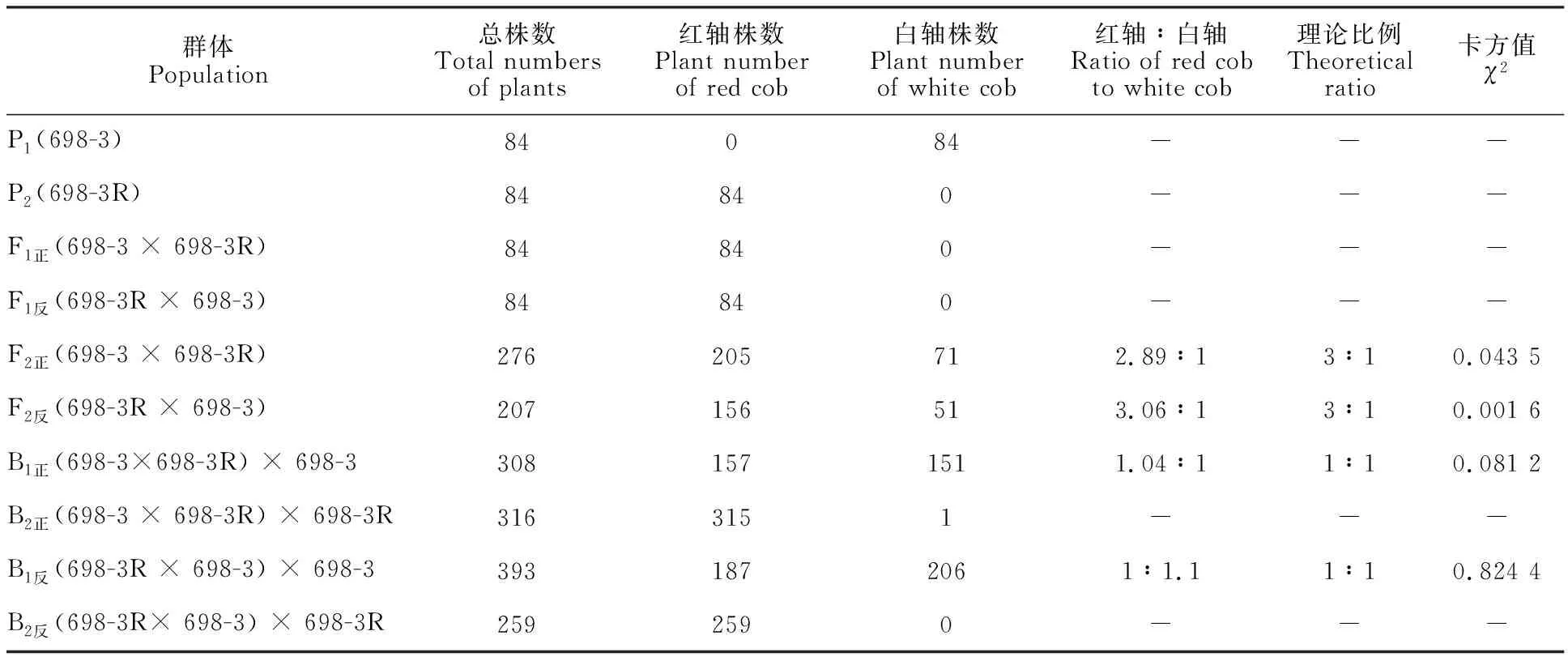
表1 各群体轴色表现Table 1 Segregation of cob color in each population
2.2 突变体698-3R轴色基因的分子标记定位
2.2.1 多态性引物筛选 首先选用均匀分布于玉米10条染色体上的475对SSR引物,检测698-3R与698-3的基因组DNA扩增差异,共筛选出18对在亲本间表现多态性稳定且重复性好的SSR引物(表2),用它们在红、白轴基因池间进行多态性筛选,结果显示,只有引物umc2225在两基因池间表现多态性。
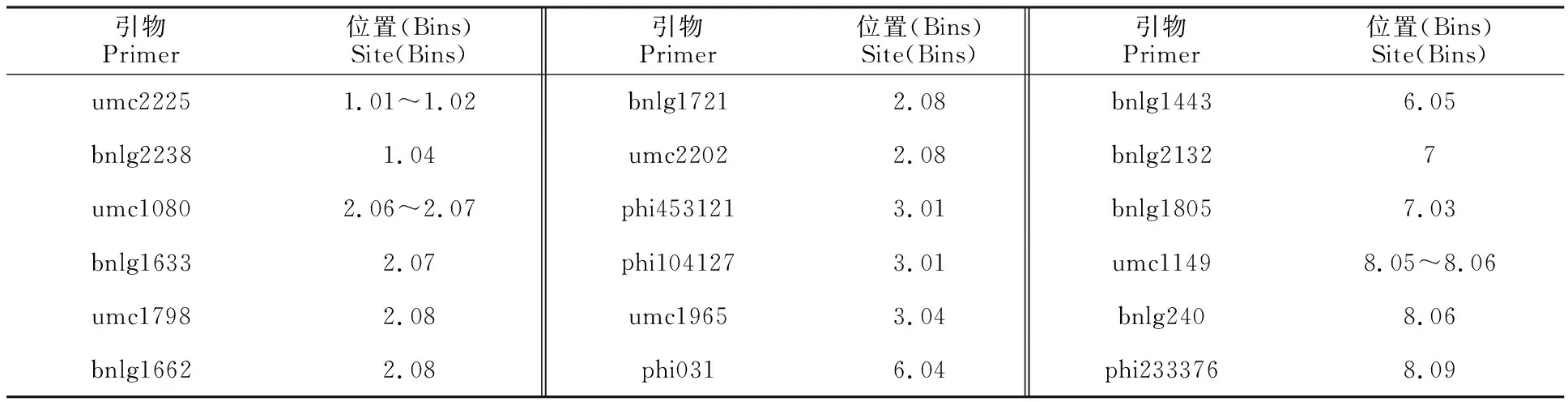
表2 两亲本间表现多态性 SSR 引物Table 2 Polymorphism of SSR primers in two parents
2.2.2C(t)基因的分子标记初步定位 用位于引物umc2225附近的29对SSR引物,以及与控制玉米轴色基因P1相连锁的10对引物,进行亲本和两池间的多态性筛选,结果进一步筛选出3对SSR引物具有多态性,它们是umc2224、umc1452和phi095(图1,表3)。然后用这4对候选标记对F2正反交群体中共计122个白轴单株进行PCR扩增,其检测结果为,phi095表现为116个698-3带型,5个698-3R带型,1个双亲本杂合带型;umc1452表现为95个698-3带型,0个698-3R带型,17个双亲本杂合带型,10个空白;umc2225表现为57个698-3带型,13个698-3R带型,49个双亲本杂合带型,3个空白;umc2224在122个白轴DNA中扩增条带表现为83个698-3带型,5个698-3R带型,22个双亲本杂合带型,12个空白。用引物phi095对其随机选取的20个F2红轴单株DNA进行验证,其扩增条带均表现为698-3R带型。利用MAPMAKER 3.0作图软件对筛选出的在双亲和两池间表现多态性的SSR引物进行连锁分析,利用Kosambi函数将重组率转化为遗传距离(cM)。根据F2定位群体的轴色和微卫星标记的分离数据构建局部分子连锁图(图2),结果表明轴色突变基因C(t)位于第一染色体短臂上phi095与umc1452之间,与phi095相距3.9 cM,与umc1452相距7.1 cM,与umc2225相距23.5 cM,与umc2224相距70.1 cM。
2.3 红轴基因C(t)的候选基因克隆
2.3.1C(t)候选基因的选择 根据定位结果,在数据库MaizeGDB上搜索关于穗轴颜色相关基因,仅有Pericarpcolor1(P1),ID:GRMZM2G084799。P1基因控制玉米种皮和穗轴的着色,由两个后缀字母表示其在种皮和穗轴颖上的表达,例如P1-rw和P1-wr分别表示红色种皮白色穗轴和白色种皮红色穗轴。标记phi095与P1基因紧密连锁,本研究定位结果显示C(t)与该标记也存在连锁关系,且在染色体上与P1基因位于该标记同侧,遗传模式分析显示C(t) 为红轴对白轴为显性遗传,与P1基因一致,因此以P1作为候选基因开展研究(NCBI登录号:NM_001291678)。
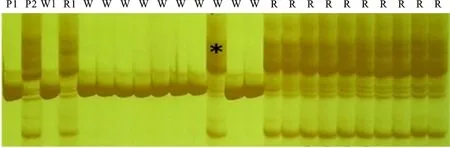
P1、P2、W1、R1分别为698-3、698-3R、白池、红池;W、R分别为F2群体白轴单株、红轴单株;*为交换单株
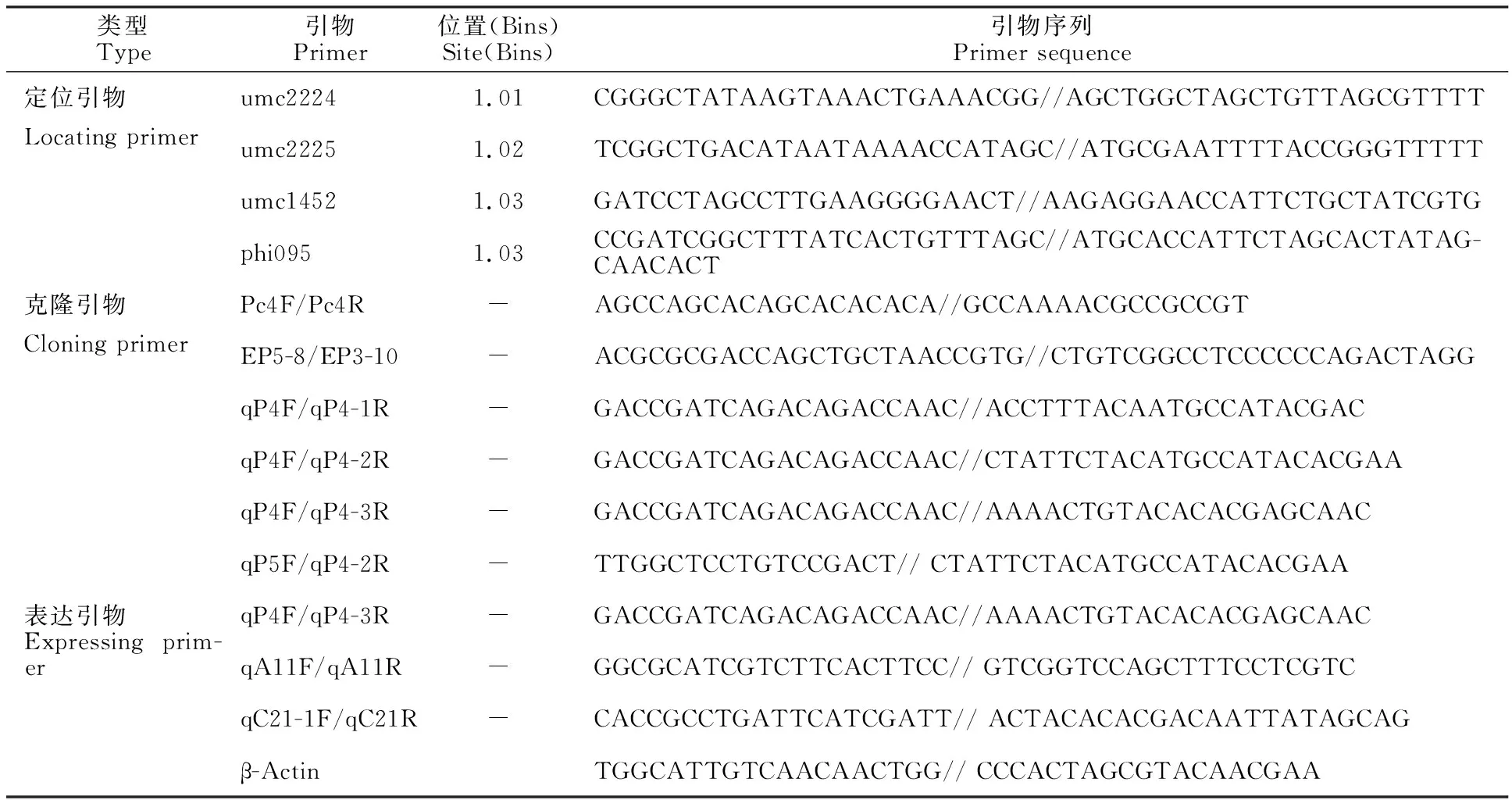
表3 引物名称和序列Table 3 Name and sequence of primers
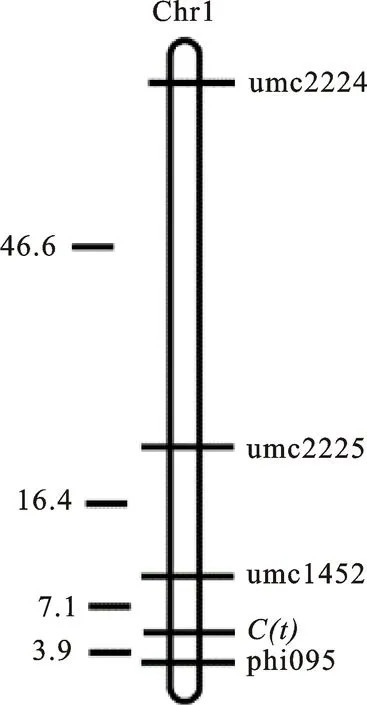
图2 基因C(t)的定位结果Fig.2 Genetic mapping of gene C(t)
2.3.2C(t)基因的cDNA克隆 从698-3R的15DAP时期的穗轴颖片转录物中,引物 Pc4F/Pc4R(序列见表3)扩增并克隆测序后获得3个转录本,分别是698-3R-cDNA1、698-3R-cDNA2和698-3R-cDNA3,序列比对见图3。从图3可知,3个cDNA在不同位置上有差异,但均具有完整的起始密码子和终止密码子。从698-3的15DAP时期的穗轴颖片转录物中,引物Pc4F/Pc4R无法获得产物,而引物EP5-8/EP3-10(序列见表3)扩增并克隆测序获得1个382 bp的片段698-3-cDNA1(图3),与698-3R-cDNA1相比,698-3-cDNA1在第415个碱基开始有一个521 bp片段的缺失,这直接导致移码突变(如图4中的698-3-P-1)。而引物qP4F/qP4-3R(序列见表3)对698-3的15DAP时期的穗轴转录物扩增并克隆测序,结果如图3,698-3中至少存在2个c(t)转录本,698-3-cDNA2和698-3-cDNA3,且仅在1403碱基处有不同,与698-3R的3个转录本在此处碱基差异一致。从698-3中克隆出来的c(t)转录本均不完整,除了698-3-cDNA1包含翻译起始密码子外,698-3-cDNA2和698-3-cDNA3均位于第三外显子上,位于模板的1 341~1 420的位置,且3个转录本均不包含终止密码子。
2.3.3c(t) 基因缺失位点鉴定 使用4对引物(qP5F/qP4-2R、qP4F/qP4-3R、qP4F/qP4-2R和qP4F/qP4-1R,位置如图4所示,序列见表3)对698-3R和698-3穗轴颖片的转录物进行扩增,这4对引物在698-3R中均能扩增,而698-3中则只有qP4F/qP4-3R能扩增,根据这些引物位置,推测c(t)的转录本在引物qP4-1R到qP4-2R所对应的位置可能有突变,位于模板1 461-1 513处(图4中虚线区段所示)。对qP4F/qP4-3R扩增片段连入克隆载体进行测序,序列差异结果如上述中的698-3-cDNA2和698-3-cDNA3。
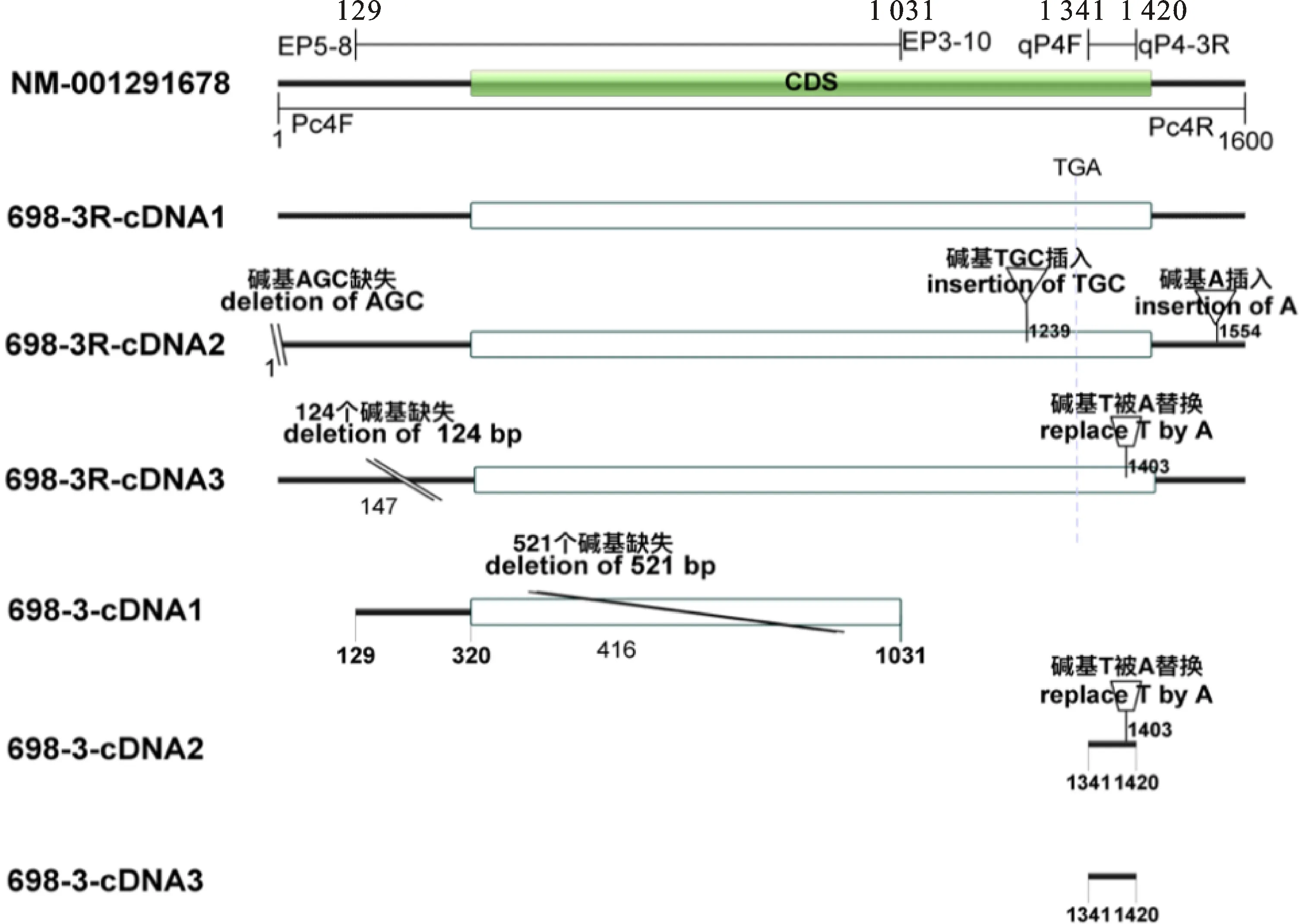
NM-001291678是NCBI上 P1-rr等位的cDNA;698-3R-cDNA1、698-3R-cDNA2和698-3R-cDNA3是C(t)在698-3R中的3个转录本;698-3-cDNA1、698-3-cDNA2和698-3-cDNA3是c(t)在698-3中的3个转录本
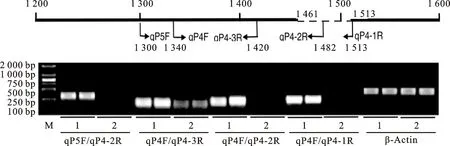
M.DL 2000 DNA marker;1和2分别表示红轴突变体698-3R和白轴自交系698-3;引物qP5F/qP4-2R、qP4F/qP4-3R、qP4F/qP4-2R、qP4F/qP4-1R和β-Actin扩增的产物的目的长度分别为182、80、142、173和217 bp。
2.3.4 C(t)蛋白氨基酸序列分析 使用DNAMAN预测698-3R-cDNA1、698-3R-cDNA2、698-3R-cDNA3和698-3-cDNA1编码蛋白的氨基酸序列并比对,结果如图5所示。在698-3R中,仅有698-3R-cDNA3编码的蛋白698-3R-P-3在C末端有1个丙氨酸(A)插入,另外2个转录本预测的氨基酸序列与已知的 P1-wr蛋白的氨基酸序列完全一致,且预测的3个蛋白均具有完整的MYB结构域(第12~115个残基,如图5虚线所示)和酸性激活域(第201~244个残基,如图5实线所示)的氨基酸序列。而698-3的转录本698-3-cDNA1预测的698-3-P-1蛋白由于缺失导致移码突变,该突变区域刚好位于上述2个功能结构区段(如图5的698-3-P-1所示)。说明,698-3R的3个转录本预测的蛋白可能与P1-wr蛋白功能一致,而与698-3的转录本预测的蛋白的功能不一样。

NP-001278607、AAU09456和ACS44752分别是NCBI上P1-rr、P1-rw和P1-wr蛋白氨基酸序列;698-3R-P-1、698-3R-P-2、698-3R-P-3和698-3-P-1分别由698-3R-cDNA-1、698-3R-cDNA-2、698-3R-cDNA-3和698-3-cDNA1通过DNAMAN软件预测的氨基酸序列;虚线所指示区域为MYB结构域,实线所指示区域为酸性激活域
2.3.5C(t)的qRT-PCR结果分析 根据C(t)基因克隆结果,4对引物中只有qP4F/qP4-3R在698-3R和698-3的转录物中均能进行扩增(图4),因此选择这对引物进行C(t)基因的相对表达量分析。结果如图6,各时期C(t)基因在698-3R中的表达量均高于698-3,除25DAP外,其余4个时期表达水平均呈现显著或极显著差异(P= 0.004、0.001、0.001和0.036)。P1基因是一个MYB转录调控因子,根据其在糅红色素合成过程中调控对A1和C2基因具有激活调控表达的功能,本研究选A1和C2基因进行表达验证,引物分别为qA11F/qA11R和qC21-1F/qC21R(序列见表3),结果如图6所示。A1和C2基因的表达模式与C(t) 基因一致,说明C(t)可能具有P1激活调控A1和C2基因的功能。
3 讨论与结论
3.1 突变体698-3R轴色的遗传规律
育种实践中多认为玉米轴色为质量性状,即由一对基因控制,如曹冰等[13]研究表明玉米轴色受一对基因控制, 其中红轴对白轴为显性;而丰光等[14]研究认为,玉米轴色性状遗传为少数主基因控制,符合加性-显性-上位性两对主基因遗传模型。本研究表明,突变体698-3R的轴色性状受一对核基因控制,且红轴对白轴为显性遗传,其结果与曹冰等[13]研究一致,将该基因暂定名为C(t)。
3.2 突变体698-3R轴色基因C(t)的初步定位结果
Frascaroli 等[15]研究表明玉米穗轴颜色是由位于染色体1.03位置的P1基因所控制,到现在已发现的玉米轴色突变基因有P1-vv[16]、c1[17]、P1-wrb[18]、P1-www[19]、P1-ovov[20-21]、P1-mm[22]、P1-pr[23-24]、ufo1[25]、r1等。本研究将突变体698-3R轴色突变基因C(t),初步定位于玉米第一染色体上phi095与umc1452之间,与phi095相距3.9 cM,与umc1452相距7.1 cM。Veldboom等[26]研究表明,phi095与P1基因紧密连锁,而红轴突变基因C(t)与phi095相距较近,推测该基因与控制种皮色和轴色的主要基因P1之间存在紧密连锁。

*表示在0.05水平差异显著,**表示在0.01水平差异显著
3.3 突变体698-3R轴色基因C(t)的克隆结果
P1编码一个MYB转录调控因子,调控玉米的种皮、穗轴及其他花器官的着色。P1不同等位间的转录本数量有较大差异,P1-rr被认为只有一个转录本,而P1-wr存在多个拷贝[27-28],这些拷贝并非可变剪切所致,而是由P1基因的复制形成了串联重复[18]。本试验结果显示,在698-3R转录物中检测到了3个C(t)转录本,而白轴的698-3至少2个,这与P1基因存在多转录本的结果一致。698-3R的3个转录本虽然在5′UTR和 3′UTR存在差异,但预测编码氨基酸序列基本一致;698-3的转录本中,一个521 bp片段的缺失以及在1 461~1 513可能的缺失,直接影响预测编码蛋白的氨基酸序列以及蛋白功能。Zhang等[28]和Chopra等[29]认为P1等位的表达模式不同,与编码蛋白质的C末端结构差异有关。预测C(t)蛋白氨基酸序列与已知 P1-rr与P1-wr蛋白比对也发现,C(t)蛋白与P1-rr蛋白在C末端存在较大差异,与P1-wr蛋白一致。因此推测C(t)可能为一个P1-wr基因,根据P1基因控制种皮、穗轴颜色命名规则,C(t) 则为一个P1-ww基因。P1基因研究中未提及过P1-ww的cDNA克隆,多为对基因组中的基因结构分析,本研究在698-3转录物中未能成功获得C(t)转录本全长,可能与其结构和表达有关[28, 30]。
3.4 突变体698-3R轴色基因C(t)的表达功能
只要存在适当的调节剂,几乎在每个植物器官中都可以发现3-羟基黄酮及其衍生色素花青素[31],相比之下,玉米中的3-脱氧类黄酮仅在种皮、穗轴及雄穗颖片等部分花器官中发现,在成熟的种皮和穗轴中,3-脱氧黄酮聚合形成红色糅红色素[32]。玉米P1基因是生物合成3-脱氧黄酮和糅红色素所必需,但不能用于3-羟基类黄酮和花青素的合成[33]。糅红色素的生物合成开始于三个丙二酰辅酶A与一个对香豆酰辅酶A经Colorless2(C2)[34]基因编码的查尔酮合酶(CHS)缩合形成柚皮素查耳酮,随后由Chalcone flavanone isomerase1(Chi1)[35]基因编码的查耳酮异构酶(CHI)将柚皮素查耳酮转化为柚皮素,在此产生关键的分支步骤。玉米中的糅红色素是由柚皮素或圣草酚通过由玉米Anthocyaninless1 (A1)[36]基因编码的二氢黄酮醇还原酶(DFR)产生的4-黄烷醇或黄酮醇的聚合物,在此过程中,C2和A1受P1基因激活与表达量的调控[37],本研究结果显示,A1和C2基因的表达模式与C(t)基因一致,这与Grotewold等[37-38]的研究结果相符,表明C(t)具有MYB调控功能,这也更说明了C(t)蛋白具有激活调控的功能。不同的P1等位基因有着不同的着色模式,P1等位间的糅红色素的发生和表达强度存在着很大差异,其转录本的积累时间与可见色素的形成相关[30],P1-rr转录物的积累始于雌穗发育的早期阶段,6DAP、9DAP和15DAP表达强烈[39],C(t)的转录水平规律与之基本相符,但P1-rr在穗轴6DAP表达量最高,而C(t)则在10DAP时表达量最高,Zhang等[30]也有相同结果,可能是由于P1等位间表达模式存在差异导致。
