内生真菌印度梨形孢对乙草胺残留动态的影响
2020-08-17赵炽娜李俊凯
韩 飞,朱 祥,张 敏,赵炽娜,李俊凯
(长江大学 农学院/湖北省农林病虫害预警与调控工程技术研究中心,湖北 荆州 434025)
印度梨形孢(Piriformosporaindica)是VERMA等[1]1998年在印度西北部塔尔沙漠的灌木根际土壤中分离得到的一种能进行纯培养的类菌根真菌,其在生理学、形态学、功能及血清学上与丛枝菌根真菌(Arbuscular mycorrhizal fungus)中的Glomus和Gigaspora相似[2],但寄主更加广泛,还可以在多种合成和半合成培养基上进行营养生长、繁殖[3],P.indica不仅可以促进植株生长和种子萌发、增加植物生物量及侧根数[4-5],还能提高植物对N、P、K的吸收[6-7],增强植物抗逆性[8],但其在土壤中对农药残留的影响未曾有相关报道[9]。
乙草胺(Acetochlor)是美国孟山都公司开发的一种芽前选择性除草剂,主要用于防除一年生禾本科杂草及部分阔叶杂草。然而,其在用药量过大或者施药后遇低温高湿天气时,易对作物产生药害[10];同时还会对农田土壤及地下水造成污染,严重影响了农田土壤的生物区系结构及酶活性[11-12]。面对日趋严峻的土壤恶化形势,减轻农药对土壤的污染、寻求新的增产措施逐渐成为研究热点。
DICTOR等[13]研究表明,乙草胺在土壤中的降解速度取决于土壤类型、温度、施用量,而微生物降解是乙草胺在土壤中的主要降解方式。目前,国内外对乙草胺降解菌的研究大多以乙草胺为着手点,集中在对降解菌的筛选、降解特性研究及降解途径分析上,而关于对植物生长具有促进作用的降解菌研究却鲜见报道[14]。前期研究发现,P.indica对乙草胺药害具有一定的缓解效果[15],但未探明其对土壤及油菜中乙草胺残留的影响。鉴于此,以P.indica为供试材料,进一步探索P.indica对油菜乙草胺药害的缓解机制,旨在寻找既可以促进作物生长,提高作物产量,又可以加速土壤及植物中乙草胺降解的微生物,为土壤环境的修复与农业增收增产提供理论依据和借鉴措施。
1 材料和方法
1.1 供试生物及试验材料
P.indica由德国耶拿大学RALF Oelmüller教授惠赠。50%乙草胺乳油,由山东胜邦绿野化学有限公司生产; 乙草胺标准品购自国家标准样品中心;93%乙草胺原药,由山东乔昌化学有限公司生产;甲醇(HPLC),由美国TEDIA公司生产;其他试验药品材料均为市售。
1.2 试验仪器
主要仪器:7890A-5975C气相色谱质谱联用仪(美国Agilent公司)、DLSB-5/25 ℃低温冷却循环泵(郑州世纪双科实验仪器有限公司)、RE-52-AA旋转蒸发仪(上海亚荣生化仪器厂)、QXSX超声波洗净仪(天津市帕尔电子制冷科技有限公司)、FA2004电子天平(上海舜宇恒平科学仪器有限公司)、Florisil固相萃取柱(美国Agilent公司)。
1.3 试验方法
1.3.1 菌丝生长速率法测定乙草胺对P.indica生长的影响 参照文献[16],将P.indica分别接种在含0、5、10、20、40、80、100、200 mg/L乙草胺的PDA培养基上,(28±1)℃培养1周后,测定菌落直径大小。
菌落增长直径=菌落直径-菌碟直径
(1)
生长速率抑制率=(对照菌落直径-处理菌落增长直径)/对照菌落增长直径×100%
(2)
1.3.2 悬浮培养法测定乙草胺对P.indica鲜质量与干质量的影响 将正常培养于PDA培养基中的印度梨形孢用打孔器打成7 mm的菌饼,分别接种在含0、5、10、20、40、80、100、200 mg/L乙草胺的PDB培养基中,(28±1)℃培养1周后,测定菌丝的鲜质量与干质量。
鲜质量抑制率=(对照菌丝鲜质量-处理菌丝鲜质量)/对照菌丝鲜质量×100%
(3)
干质量抑制率=(对照菌丝干质量-处理菌丝干质量)/对照菌丝干质量×100%
(4)
1.3.3 GS-MS法测定P.indica菌液中乙草胺残留动态 将不同数量(0、1、3个)的印度梨形孢菌饼接种在PDB培养基中,(28±1)℃培养3 d后,再分别加入不同质量浓度的乙草胺药液,使培养液中乙草胺的质量浓度分别为20、50、100 mg/L,以未加入菌饼的PDB培养基作为空白对照(CK1)。无菌条件下取样后,参照文献[17]方法进行处理。
色谱条件:参考文献[10]的方法,采用DB-5 MS石英毛细管柱(30 m×0.25 mm×0.25 μm),柱温: 90 ℃保持1 min;以10 ℃/min升至150 ℃,保持 4 min;以5 ℃/min升至200 ℃,保持 3 min;再以10 ℃/min升至 250 ℃,保持2 min。
1.3.4 GS-MS法测定施有P.indica菌丝的土壤中乙草胺残留动态 将分别为0、1、2、4 g(鲜质量)P.indica菌丝研磨均匀后定容到100 mL,均匀加入到700 g风干过筛未受乙草胺污染的土壤中。再喷施不同质量浓度的乙草胺,使土壤中乙草胺含量分别为50、100、200 mg/kg,保持水土湿润,(20±1)℃下培养。于施药后1、2、3、5、7、9、11、15 d,分别称取5 g土壤进行试验,参照文献[18]的方法进行处理。色谱条件同1.3.3。
1.3.5 GS-MS法测定P.indica拌种处理油菜幼苗中乙草胺残留动态 在塑料盆(长80 cm、宽25 cm、高15 cm)中加入定量过筛的风干土,并用一定量水将其浸湿,每1 kg油菜籽分别用0、5、10、20 g的P.indica菌丝进行拌种,并播种于已装土的塑料盆中,播后1 d,用有效成分含量为600、1 200、1 800 g/hm2的乙草胺进行土壤封闭,油菜播后4、6、8、10、15、21 d,取5 g油菜幼苗的地上部分,参照文献[19]的方法进行处理。色谱条件同1.3.3。
2 结果与分析
2.1 乙草胺对P.indica生长的影响
如表1所示,当乙草胺质量浓度为5 mg/L时,通过菌丝生长速率法测得乙草胺对P.indica生长速率的相对抑制率为6.19%,通过菌丝悬浮培养法测得乙草胺对P.indica鲜质量的相对抑制率为9.38%,对干质量的相对抑制率为17.40%;当乙草胺质量浓度为200 mg/L时,乙草胺对P.indica生长速率、鲜质量、干质量的相对抑制率分别为98.12%、95.11%、96.40%。可见,乙草胺对P.indica的生长有一定影响,且随着乙草胺质量浓度升高,对P.indica生长的抑制作用越大。
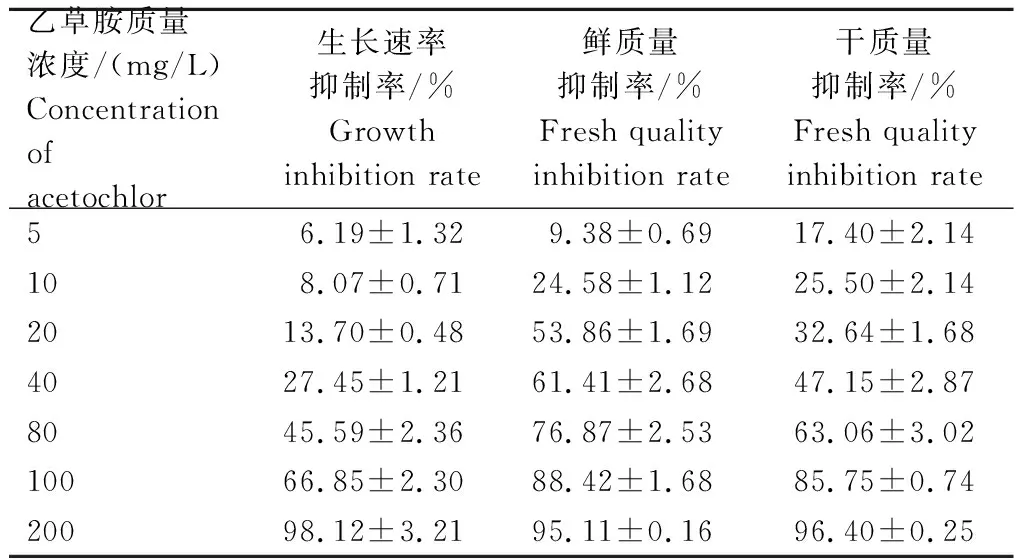
表1 乙草胺对P.indica生长的影响Tab.1 Effect of acetochlor on the growth of P.indica
2.2 乙草胺标准曲线及乙草胺含量测定方法的回收率
将乙草胺标准溶液在1.3.3色谱条件下进行测定,保留时间为17.415 min,以峰面积(Y)对乙草胺质量浓度(X)进行线性回归,结果显示,乙草胺质量浓度为0.01~25 mg/L时与峰面积呈现良好的线性相关性,线性方程为Y=41 042X-3 960.1(R2=0.999 8)。可见,该色谱条件满足乙草胺定量分析的需要。
在不含乙草胺的P.indica菌液样品和土壤样品中准确加入(0.01~25 mg/kg) 乙草胺标准品,按1.3.3、1.3.4、1.3.5中的方法分别进行提取纯化并测定菌液、土壤以及油菜幼苗中的乙草胺含量,计算回收率。结果(表2)表明,P.indica菌液中乙草胺的平均回收率为92.38%~94.68%,RSD均小于等于4.25%;土壤中乙草胺的平均回收率为83.54%~87.78%,RSD均小于等于4.57%;油菜中乙草胺的平均回收率为88.35%~91.53%,RSD均小于等于6.12%,符合农药残留分析要求。
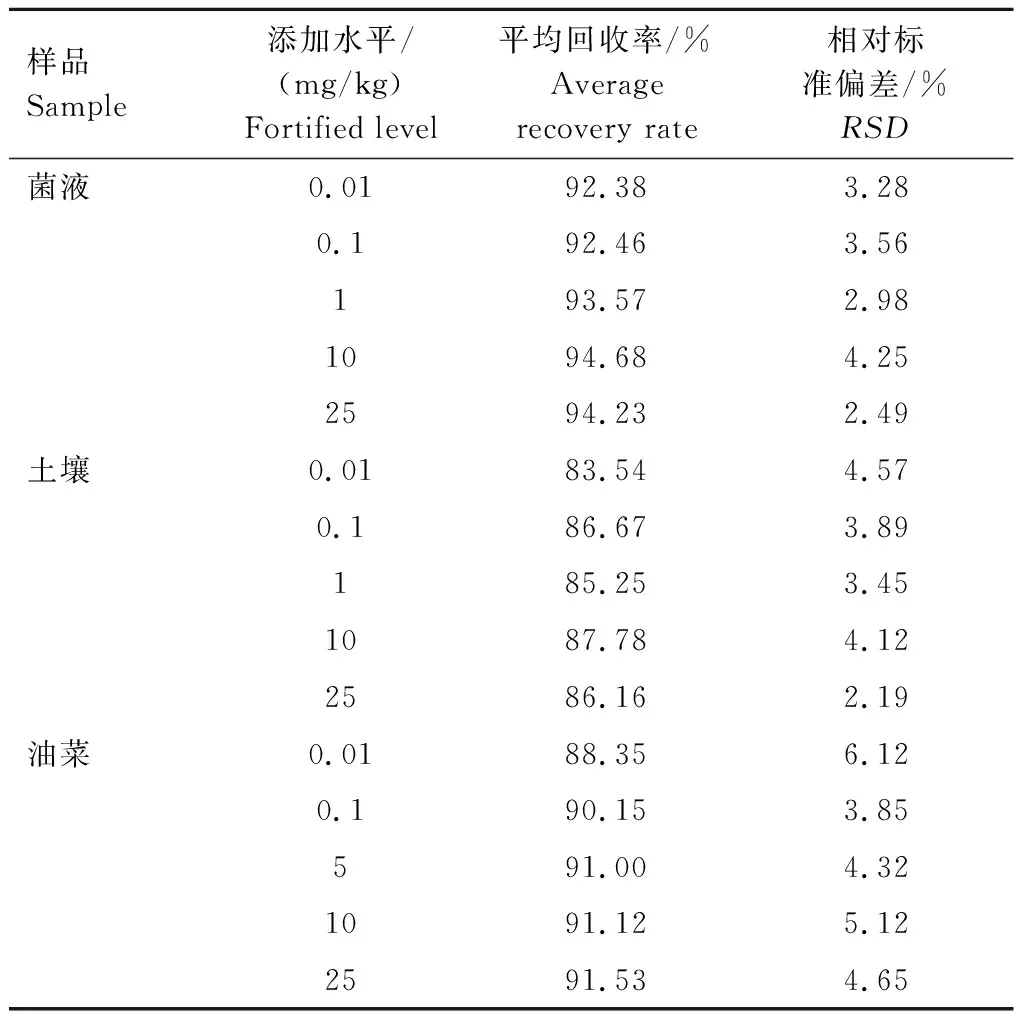
表2 乙草胺的添加回收率Tab.2 Addition recovery rate of acetochlor
2.3 乙草胺的降解动态
2.3.1 乙草胺在P.indica菌液中的降解动态 由表3可见,当未添加P.indica菌饼,乙草胺质量浓度分别为20、50、100 mg/L时,乙草胺的半衰期均为115.52 d;添加菌饼后,乙草胺半衰期明显缩短,且均在9 d以下。

表3 乙草胺在P.indica菌液中的降解动态Tab.3 Degradation dynamics of acetochlor in P.indica
2.3.2 乙草胺在土壤中的降解动态 对乙草胺在土壤中的残留量进行回归分析,其结果见表4。从表4可以看出,乙草胺在土壤中前期降解较快、后期降解较慢,符合一级反应动力学方程ct=c0ekt。结果(表4)表明,未添加P.indica菌丝时,土壤中50、100、200 mg/kg乙草胺的半衰期分别为11.18、11.95、12.84 d。1 kg土壤中分别添加1、2、4 gP.indica菌丝后,土壤中50 mg/kg乙草胺的半衰期分别11.36、10.35、10.19 d,100 mg/kg乙草胺的半衰期分别11.36、11.18、11.36 d,200 mg/kg乙草胺的半衰期分别11.95、11.55、11.55 d,总体上表现为短于未添加菌丝时的半衰期。
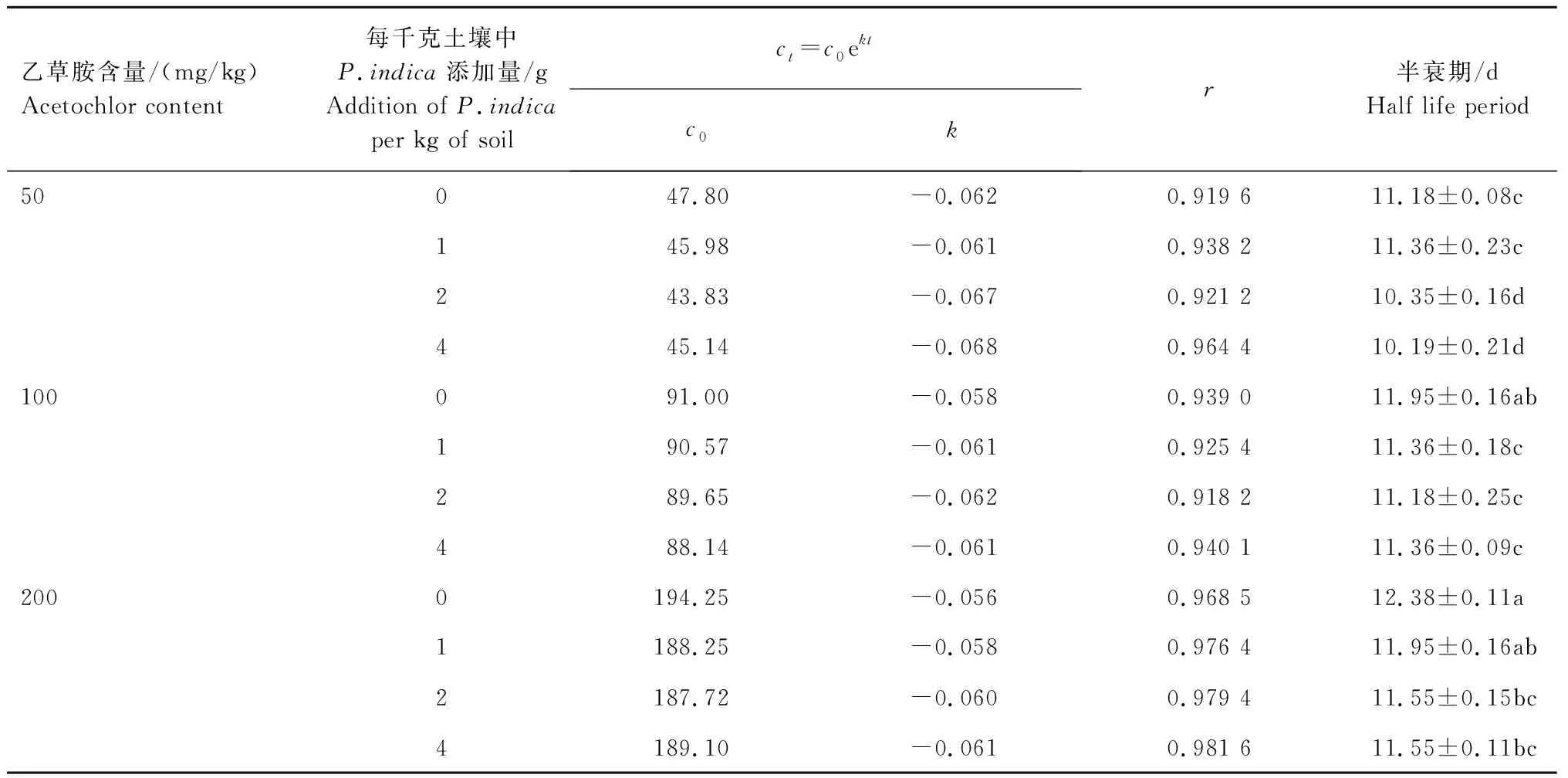
表4 乙草胺在土壤中的降解动态Tab.4 Degradation dynamics of acetochlor in soil
2.3.3 乙草胺在油菜幼苗中的降解动态 试验结果(表5)表明,未添加P.indica菌丝时,施用量为600、1 200、1 800 g/hm2的乙草胺在油菜幼苗中的半衰期分别为3.83、3.65、3.07 d。每千克油菜籽分别采用5、10、20 gP.indica菌丝进行拌种的处理,施用量为600 g/hm2的乙草胺在油菜幼苗中的半衰期分别为3.47、3.38、3.59 d,施用量为1 200 g/hm2的乙草胺在油菜幼苗中的半衰期分别为3.40、3.22、3.45 d,施用量为1 800 g/hm2的乙草胺在油菜幼苗中的半衰期分别为2.82、2.92、2.84 d。可见,通过P.indica拌种处理的油菜幼苗中,乙草胺的半衰期均有一定程度缩短。
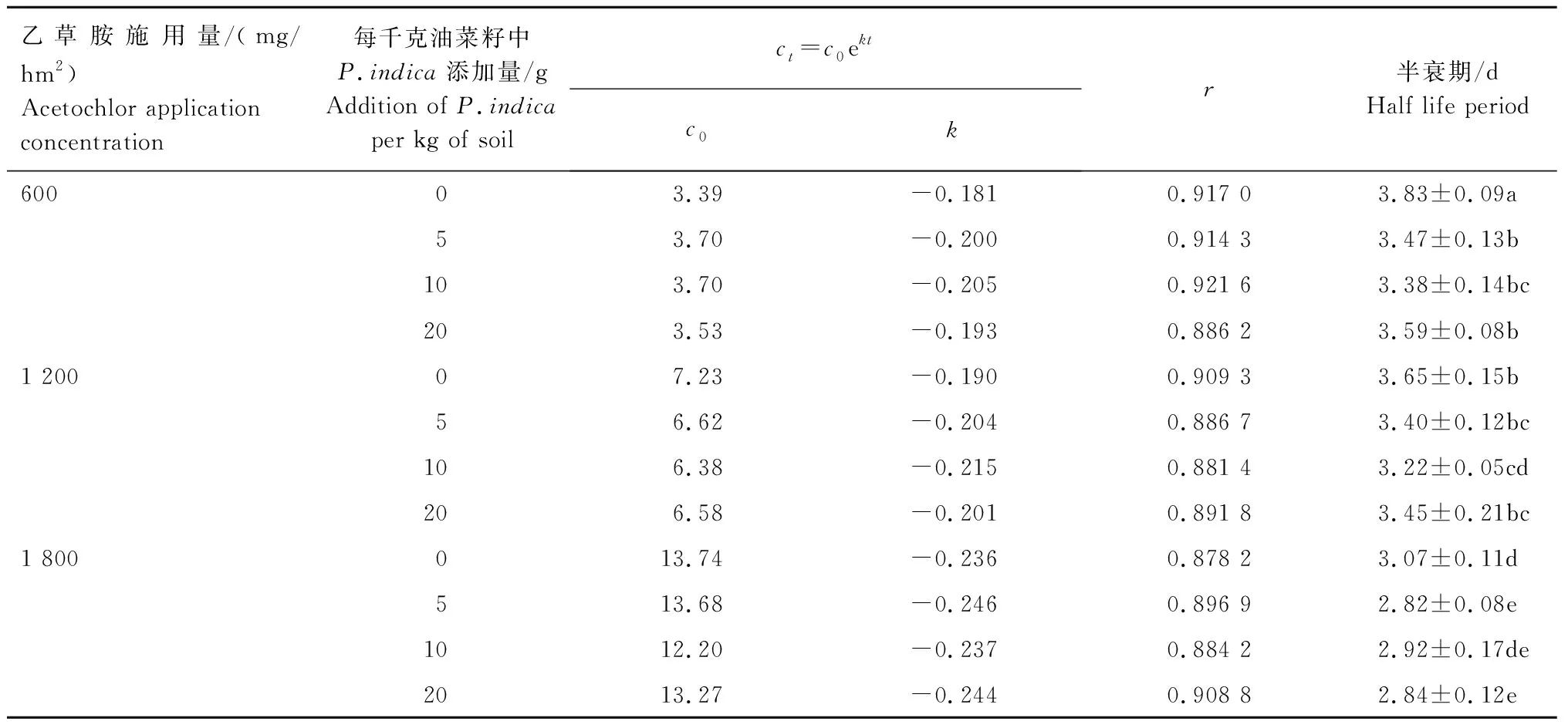
表5 乙草胺在油菜植株中的降解动态Tab.5 Degradation dynamics of acetochlor in rape
3 结论与讨论
根部内生真菌P.indica比丛枝菌根真菌拥有更加广泛的寄主范围以及更广谱的生物学效应,具有广阔的产业化应用和商业开发前景,是目前农用有益微生物的研究热点。
本试验结果表明,当培养基中乙草胺质量浓度为200 mg/L时,对固体培养基中P.indica生长速率的相对抑制率为98.12%,对悬浮培养液中P.indica的鲜质量和干质量相对抑制率分别为95.11%和96.40%,说明乙草胺对P.indica的生长具有较大的不利影响;在不添加P.indica的悬浮培养液中,当乙草胺质量浓度分别为20、50、100 mg/L时,其半衰期均为115.52 d;添加P.indica菌饼后,乙草胺的半衰期缩短至9 d以下。每千克土壤添加2 gP.indica后,土壤中50、100、200 mg/kg乙草胺的半衰期分别为10.35、11.18、11.55 d,均低于未添加P.indica的半衰期(11.18、11.95、12.38 d);说明P.indica对乙草胺的降解具有明显的促进作用;另外,P.indica菌液的质量浓度对乙草胺的降解速率有一定影响,但影响较小;同时还发现,随着土壤中乙草胺含量的升高,乙草胺的半衰期也有一定延长,推测是由于乙草胺影响土壤中微生物的生长代谢,使其降解变缓。除此之外,P.indica对油菜植株中乙草胺的降解具有促进作用,这可能与其促进油菜抗逆性、提高油菜中乙草胺的相关解毒酶活性有关;同时乙草胺高施用量(1 800 mg/hm2)处理中,乙草胺半衰期较短,推测与油菜自身对乙草胺的代谢有关,即在此质量浓度下,油菜合成更多的解毒酶类物质,促进乙草胺加速代谢至自身可接受的较低浓度。
微生物是降解土壤中乙草胺的主要因素[20],而目前国内外乙草胺降解菌主要是通过富集筛选土壤中的微生物得到的,很可能在筛选过程中忽视了微生物对作物生长的影响。P.indica已被证明对多种作物具有促进生长、提高产量、增强抗逆性等作用。本试验结果表明,P.indica对土壤及油菜植株中的乙草胺降解具有促进作用,这或许能为P.indica菌肥的开发应用提供新的思路,同时也为土壤环境的修复提供了参考。
