基于网络药理学的畲药“十二时辰”治疗类风湿性关节炎的机制研究
2020-08-15曾熙颖左春兰
曾熙颖 张 云 左春兰 林 凡*
1.福建中医药大学中西医结合学院,福建 福州 350122;2.福建教育学院理科研修部,福建 福州 350001;3.福建中医药大学中西医结合研究院,福建 福州 350122
类风湿性关节炎(Rheumatoid Arthritis,RA)是一种常见慢性炎症性关节疾病,可引起骨损伤以及残疾。该疾病的发病率为0.03%,高发年龄段为35岁至50岁之间[1]。目前,RA的病因尚未完全清楚[2],其病程迁延,呈慢性、侵袭性发展,复发率与致残率高,易引发心血管疾病和其它并发症,从而损害患者的生活质量[3]。RA的主要治疗药物为以甲氨蝶呤为代表的抗风湿药物和肿瘤坏死因子α(TNF-α)抑制剂为代表的生物制剂,单独或联合用药可减轻关节肿胀和疼痛、改善多种临床症状,但目前尚无治愈性治疗方案[4]。另一方面,胃肠和心脏毒性、注射部位感染、结核病和淋巴瘤患病风险的增加等毒副作用限制了抗RA药物的使用[5]。同时,有许多患者对现有治疗方法没有反应[6]。因此,迫切需要开发新的有效疗法。
畲药“十二时辰”是毛茛科铁线莲属重瓣铁线莲(ClematisfloridaThunb.var. plena D. Don)的干燥根[7],其味辛,性温,具有通关窍、通经活络、活血止痛、祛风除湿等功效[8],是一味颇具地方特色的闽东畲药。RA在中医属“痹症”范畴,《素问·痹论》中提及“风、寒、湿三气杂至,合而为痹”,治疗的基本原则为“风者疏之,寒者温之,湿者驱之”,常用散风、驱寒、祛湿等性质的中药治疗[9],而祛风除湿正是“十二时辰”的常用功效之一。另外,类风湿性关节炎急性期常呈现滑膜血管水肿、渗出性和细胞浸润性病变,继而导致肿胀疼痛,这些症状与“十二时辰”的主治相符。因此“十二时辰”对于RA可能具有疗效。
本研究采用网络药理学的方法对“十二时辰”抗RA的有效成分及作用机制进行全面探讨,阐释其治疗RA的可能机制,为后续研究提供理论支撑,拓展该药的应用范围。另一方面,该研究成果将有利于弘扬和继承畲医药文化,推动畲医药产业发展。
1 材料与方法
1.1 获取“十二时辰”化学成分 通过中药系统药理学分析平台(TCMSP数据库)(http://lsp.nwu.edu.cn/tcmsp.php)以及中药综合数据库(TCMID数据库)[10](http://www.megabionet.org/tcmid/search/)收集“十二时辰”的主要化学成分,结合文献挖掘[11-13]并利用Pub Chem(https://pubchem.ncbi.nlm.nih.gov/)和TCMSP数据库对每个化学成分的分子结构进行验证,确定“十二时辰”的已知化学成分。
1.2“十二时辰”靶点预测与RA疾病靶点查询 利用TCMSP和TCMID数据库获取上述化学成分的靶点。将筛选得到的靶点导入UniProt数据库(http://www.uniprot.org/)中进行检索和转换操作,得到与相关的靶蛋白或靶基因信息。
1.3“十二时辰”靶点与抗RA作用的相关性分析 将查询得到的“十二时辰”预测靶点信息与DrugBank数据库中美国食品药品监督管理局(Food and Drug Administration,FDA)批准的抗RA药物靶点进行映射分析,分析“十二时辰”预测靶点与抗RA作用相关性。
1.4“十二时辰化学成分-靶点”相互作用网络的构建与分析 利用Cytoscape 3.7.1软件,将检索到的“十二时辰”化学成分与其在数据库中获取的潜在靶点生成“十二时辰化学成分-靶点”相互作用网络,并进行网络拓扑结构分析。
1.5 蛋白质—蛋白质互作(protein-protein interaction, PPI)网络的构建与分析 从HPRD数据库(http://www.hprd.org/)中获取人体蛋白互作数据作为背景网络[14]。利用1.3分析得到的“十二时辰”抗RA相关靶点与人体蛋白互作数据生成“十二时辰抗RA靶点-人体蛋白”PPI网络,并进行网络拓扑结构分析。
1.6“十二时辰”抗RA靶点的GO功能富集和KEGG通路注释分析 采用David 6.8数据库(https://david.ncifcrf.gov/)对所预测的“十二时辰”抗RA靶点进行GO(Gene Ontology)功能富集和KEGG(kyoto encyclopedia of genes and genomes)通路注释分析。
2 结果
2.1“十二时辰”化学成分的获取 通过文献检索、TCMSP数据库和TCMID数据库共收集到“十二时辰”的化学成分共9种,各化学成分的基本信息见表1。从表中可见,在9种化学成分中,除齐墩果酸为皂苷类化合物外,其余8种均为挥发油成分。

表1 “十二时辰”化学成分的基本信息
2.2 “十二时辰”化学成分的潜在靶点信息及其治疗RA的可行性分析 “十二时辰”的9种化合物共检索到60个潜在作用靶点。将“十二时辰”的潜在作用靶点与DrugBank数据库中检索得到的1848个抗RA药物靶点进行映射,结果得到21个重复靶点。这21个靶点占“十二时辰”总靶点数目的35%,提示“十二时辰”可能具有治疗RA的功效,其基本信息(包括靶蛋白、靶基因、Uniprot号和频次)见表2。其中凋亡调节因子Bcl-2(Apoptosis regulator Bcl-2)和前列腺素G/H合成酶1(Prostaglandin G/H synthase 1)在9个化合物中出现频次均为5,前列腺素G/H合成酶2(Prostaglandin G/H synthase 2)的频次为4,提示它们可能具有重要作用。

表2 “十二时辰”抗RA靶点信息表
2.3“十二时辰化学成分-靶点”相互作用网络 将9个化合物及其潜在的靶点相连以构建“十二时辰化学成分-靶点”相互作用网络,如图1所示。该网络包括68个节点(8个化合物和60个潜在靶点)和83条边,而正二十一烷在数据处理过程中未发现相关靶点,故在构建的分子-靶点网络中没有显示。在网络中,连接化合物和靶点较多的节点可能起到重要的作用,是潜在的关键化合物和靶点。表3列举了“药物分子-靶点”网络中的关键节点及其拓扑结构信息,即分子1308(油酸)有最多的潜在靶点(21个),其次是分子0069(棕榈酸)、分子1396(十五烷酸)、分子0263(齐墩果酸)分别有17、16、12个潜在靶点,提示它们可能是起关键作用的药物分子。另外,度值(网络中和节点相连的路线条数)较高的靶点为凋亡调节因子Bcl-2(P10415)、前列腺素 G/H合成酶1(P23219)、前列腺素G/H合成酶2(P35354),分别有5、5、4个相互作用配体,并且通过与表1比对可发现这三个靶点均存在于映射得到的21个“十二时辰”与RA共同靶点中,提示Bcl-2、PTGS1、PTGS2等是“十二时辰”活性成分治疗RA的主要靶点群。此外,在分子1308(油酸)作用靶点中包含关键靶点前列腺素 G/H合成酶1(P23219)和前列腺素G/H合成酶2(P35354);在分子0069(棕榈酸)和分子1396(十五烷酸)作用靶点中则均包含以上3个关键靶点。

表3 “十二时辰化学成分-靶点”相互作用网络中关键节点信息表

表3 “十二时辰化学成分-靶点”相互作用网络中关键节点信息表
另外,网络的拓扑结构分析结果表明:网络集中度为0.299,网络密度为0.038,网络异质性为1.594,最短路径为2808(67%),节点平均中介中心度为0.044,大于平均中介中心度的节点有10个。这说明“十二时辰”中含有的化合物可能作用于整个生物网络系统,而非单一作用于某一个蛋白靶点,从而提示了“十二时辰”作用的整体性和复杂性。
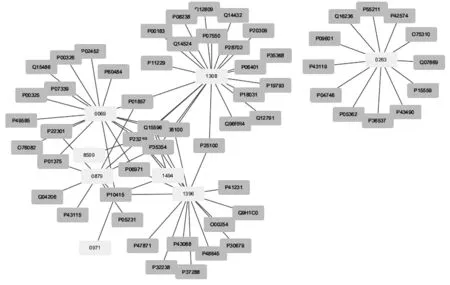
注:浅色节点代表化学成分,深色节点代表靶点图1 “十二时辰化学成分-靶点”相互作用网络图
2.4“十二时辰抗RA靶点-人体蛋白”PPI网络构建与分析 以HPRD数据库中获取的人体蛋白互作数据作为背景网络,与21个“十二时辰”抗RA靶点,构建“十二时辰抗RA靶点-人体蛋白”PPI网络,如图2所示。各靶点相应的度值见表4,根据表格可发现靶点Bcl-2、前列腺素 G/H合成酶1和前列腺素G/H合成酶2的度值排名均较靠前,结合2.3进一步证实了这3个靶点在“十二时辰”治疗RA中具有重要作用。

注:深色节点代表“十二时辰”抗RA靶点,浅色节点代表人体蛋白图2 “十二时辰抗RA靶点-人体蛋白”PPI网络

表4 “十二时辰”抗RA靶点在“十二时辰抗RA靶点-人体蛋白”PPI网络中的度值
2.5 “十二时辰”抗RA靶点的GO功能富集和KEGG通路注释分析 利用DAVID平台的GO和PATHWAY模块对所预测的“十二时辰”抗RA靶点进行研究。在GO富集分析中,确定了38个GO条目(错误发现率,FDR<0.05),如图3所示。其中生物过程相关条目有22个,涉及炎症反应、凋亡过程负调节、NF-κB转录因子活性正调节、一氧化氮生物合成正调节、细胞对肿瘤坏死因子的反应等方面;分子功能相关条目9个,涉及蛋白质同源二聚化活性、细胞因子活性、转录因子活性、序列特异性DNA结合等方面;细胞组成相关条目7个,涉及细胞质、核质、内质网等方面。
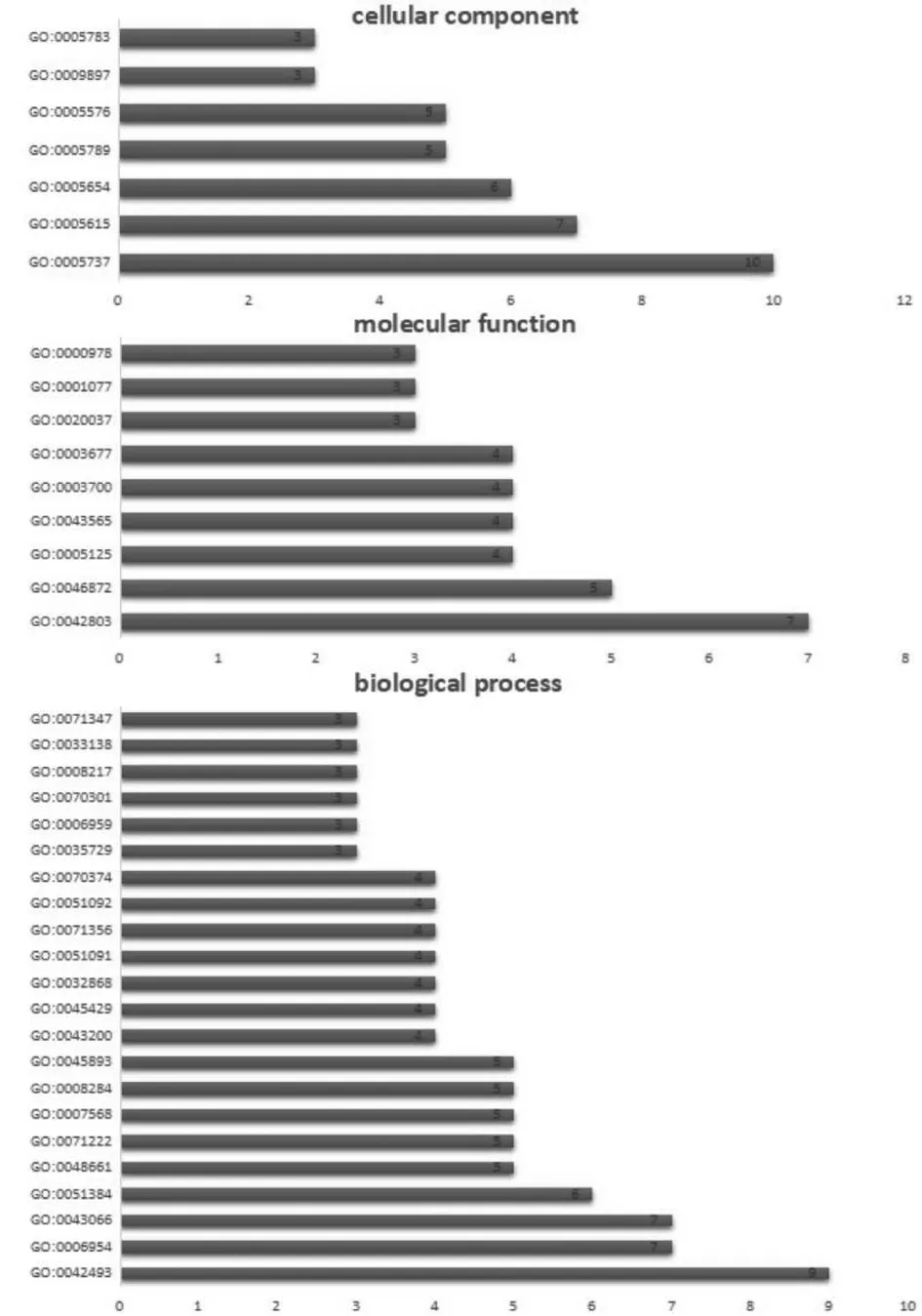
图3 “十二时辰”化学成分抗RA相关靶点GO富集分析
在KEGG通路注释分析中,筛选出显著的前20条通路(P<0.05),其中与RA关系密切的通路有5条(见表5)。在PI3K-Akt、Rheumatoid arthritis和Toll-like receptor这三条信号途径的作用位点中均包含凋亡调节因子Bcl-2(P10415);TNF 信号途径的作用位点包含前列腺素G/H合成酶2(P35354);MAPK信号途径的作用位点包含前列腺素 G/H合成酶1(P23219)。提示“十二时辰”可能通过作用于这5条通路中的关键靶点而发挥抗RA的作用。

表5 “十二时辰”化学成分抗RA相关靶点的KEGG基因富集条目(Top 20)

表5 “十二时辰”化学成分抗RA相关靶点的KEGG基因富集条目(Top 20)
3 讨论
RA是一种以关节中炎性细胞的积累导致持续性滑膜炎及骨质破坏为特征的自身免疫性疾病[2],这与畲药“十二时辰”在治疗关节肿痛中所表现的炎症充血和渗出反应有相似之处。中医治疗RA时常用具有驱寒、散风、祛湿等性质的中药[9],而祛风除湿、通络止痛恰是“十二时辰”及其同属植物的常用功效之一,如:黄花铁线莲(ClematisintricataBunge)可被用于治疗RA[14],威灵仙(ClematischinensisOsbeck.)总皂苷对大鼠佐剂性关节炎有较好疗效[15],单叶铁线莲(ClematishenryiOliv.)对II型胶原诱导型关节炎大鼠能缓解症状和改善病变,对RA有防治作用等[16]。本研究利用网络药理学方法分析得出“十二时辰”的9种化学成分和60个潜在作用靶点,其中35%潜在靶点与现有抗RA药物靶点重合,提示“十二时辰”可能具有治疗RA的功效。
对“十二时辰化学成分-靶点”相互作用网络的拓扑学分析表明,“十二时辰”的关键化合物有油酸、棕榈酸、齐墩果酸和十五烷酸。不饱和脂肪酸具有降低血栓形成、降低血小板黏附及抗脂质过氧化等作用[17]。油酸和棕榈酸作为不饱和脂肪酸,可能在抗炎过程中起到减少血栓形成和抗氧化的作用。裴克等利用小鼠实验证明油酸和棕榈酸具有一定的抗炎、镇痛作用[17];其中棕榈酸可能通过降低Bcl-2表达水平[18-20],激活MAPK信号通路,活化p38、JNK、ERK,引起前列腺素G/H合成酶的表达升高[21]来发挥作用。齐墩果酸为五环三萜类化合物,具有多种药理活性,体内外研究表明齐墩果酸具有显著的抗炎活性[22-24],它对IL-6、IL-8和MMP1等炎症因子的表达有明显的抑制作用,能明显地抑制细胞外信号调节激酶、p38、c-jun N末端激酶和Akt蛋白的磷酸化,抑制IκB-α蛋白的降解[25]。
对“十二时辰化学成分-靶点”相互作用网络的拓扑学分析还表明,“十二时辰”潜在抗RA关键性靶点为前列腺素G/H合成酶1、前列腺素G/H合成酶2和凋亡调节因子Bcl-2等。炎症反应和成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)的异常活化增殖是RA发病的关键因素[26]。前列腺素G/H合成酶1、2又分别称为COX-1和COX-2,其中COX-1与炎症的发生有密切的关系,COX-2参与加剧炎症进程[27]。有研究表明,通过抑制COX-2 表达和PGE2的合成,可减少炎性细胞因子的产生,抑制FLS细胞增殖,从而治疗RA[28-29]。另外,凋亡调节因子Bcl-2的异常表达也可影响FLS的增殖/凋亡进而影响RA的病理过程。如体外研究结果发现RA模型细胞中Bcl-2水平明显升高[30]。甲氨蝶呤等抗RA药物的作用机制亦与降低Bcl-2表达水平相关[31-32]。这些报道的结果均与本研究结果相符。
进一步利用David数据库对21个“十二时辰”潜在抗RA靶点进行GO功能富集和KEGG通路注释分析。GO结果提示“十二时辰”治疗RA相关基因功能主要体现在炎症反应、凋亡过程负调节、NF-κB转录因子活性正调节、蛋白质同源二聚化活性等方面;KEGG结果表明“十二时辰”可能通过TNF信号、PI3K-Akt信号、Toll样受体信号和MAPK信号等通路发挥治疗RA的作用。其中,TNF信号通路(hsa04668)的TNF-α通过结合受体TNFR1和TNFR2而激活,激活的TNF信号通路可导致NF-κB核异位和JNK、p38、AP-1活化,活化白细胞、破骨细胞、内皮细胞、滑膜成纤维细胞等,诱导多种炎必性因子和基质酶的生成,导致滑膜炎症反应,引起关节破坏[33];PI3K-Akt信号通路(hsa04151)参与滑膜细胞的增殖与凋亡调节,在RA滑膜细胞中处于异常激活状态[34];Toll样受体(Toll-like receptors,TLRS)信号通路(hsa04620)通过介导细胞因子的合成与释放,促进相关免疫分子的表达,活化免疫细胞,参与自身免疫性疾病过程[35],其中TLR2和TLR4与RA的发病密切相关[36];丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路(hsa04010)亦属于典型RA相关信号通路,其中的ERK1/2、JNK和p38 MAPK等信号分子的上调可促进滑膜细胞增殖和分化,导致RA慢性滑膜炎[37]。此外,在直接相关的类风湿性关节炎(Rheumatoid arthrit)信号通路(hsa05323)上,“十二时辰”的作用靶点有Bcl-2(P10415)、IL-6(P05231)、ICAM-1(P05362)等RA相关因子,这再次提示Bcl-2在“十二时辰”潜在治疗RA机制中的重要作用。
中医药抗RA的实验研究亦证实了上述信号通路在抗RA中的重要性。如桂枝芍药知母汤可下调胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠外周血TNF-α水平,诱导RA滑膜细胞凋亡[38];青藤碱可抑制RA患者外周血树突状细胞(dendritic cells,DC)中TLR4和TLR2表达,抑制DC成熟和细胞因子分泌,阻断T细胞异常活化,从而发挥治疗RA的作用[39]。这些结果与本次研究的结果相一致,提示“十二时辰”可能通过上述信号通路发挥治疗RA的作用。
由此可见,应用网络药理学方法分析得知“十二时辰”的化学成分油酸、棕榈酸、齐墩果酸、十五烷酸可能通过Bcl-2、COX-1、COX-2等靶点调节TNF、PI3K-Akt、Rheumatoid arthritis、Toll-like receptor和MAPK 等多条信号通路,抑制成纤维样滑膜细胞的异常增殖,减轻炎症反应,达到治疗RA的作用。
