肝癌细胞HepG2外泌体对其自身甲基化的影响及其机制探究
2020-08-14王一涵王奕丹黄钰雯刘丽梅
阴 迪,王一涵,王奕丹,黄钰雯,刘丽梅
0 引 言
肝癌的发生和转移都与肿瘤微环境密切相关。已有研究发现肿瘤细胞可以通过核酸的细微改变来影响肿瘤微环境,从而促进肿瘤形成与发展[1-2]。已有研究发现肿瘤的发生发展与组蛋白乙酰化修饰,各种DNA的甲基化情况都有相关性。外泌体是细胞分泌的30~100 nm的微小囊泡状结构,内含蛋白成分与核酸成分,已有研究表明,外泌体会参与细胞通讯,是细胞间沟通的重要媒介[3-5]。结合两者对肿瘤影响的相关性,我们推测肿瘤自身外泌体会影响于肿瘤细胞自身的甲基化程度从面调控细胞的生长,为进一步验证推测,我们从细胞实验和核酸分析等多角度,检测了肝癌细胞HepG2外泌体对其自身生长情况和DNA甲基化程度及相关的基因转录的影响。
1 材料与方法
1.1 主要材料与仪器HepG2肝癌细胞(上海中科院细胞库),DMEM(Gibco),胎牛血清(Hyclone),CD63抗体(abcam,ab193349),CD9抗体(abcam,ab92726),超敏ECL化学发光即用型底物(Boster),DiI红色荧光探针(Beyotime),荧光一抗5MC-CD FITC(abcam,ab179898),RNA提取与反转录试剂盒(Takara),SYBR(Takara),荧光定量PCR仪(Thermo),透射电子显微镜(Hitachi),纳米粒度分析仪(Microtrac),垂直板电泳系统(BIO-RAD),超速离心机(Thermo),荧光倒置显微镜(Nicon)。
1.2方法
1.2.1 细胞培养将肝癌HepG2细胞用DMEM培养,加入10%的胎牛血清和1%的青霉素链霉素混合双抗,培养环境为5% CO2,37 ℃,湿度饱和的细胞培养箱,隔天胰酶消化后传代。
1.2.2外泌体的提取外泌体提取之前,将生长至50%~60%的细胞培养液换成无血清的DMEM处理48h,收集上清,用0.22 μm滤器(Millipore)过滤后进行差速离心提取[6],所有离心均在4 ℃进行,过程如下:将收集好的细胞上清液3000 r/min离心30 min,弃沉淀,将上清液转移至PC管中,35 000 r/min离心90 min,弃上清,加1 mL PBS冲洗内壁沉淀,转移至1.5 mL Ep管中,涡旋振荡15 min分散后,10 000 r/min离心30 min,弃沉淀,将上清液转移至超离管,35 000 r/min离心2 h,弃上清,加90 μL PBS混匀。
1.2.3外泌体的鉴定透射电镜拍照,将样品置于铜网上,3%磷钨酸溶液20 μL负染5 min后滤纸吸干,置于透射电镜样品室内观察形态并拍照。粒径检测,先用高压过的PBS将参数调零,擦干后加200 μL的外泌体悬液到样品室内,设置90 s,3次平行检测液体中粒径大小。Western blot检测CD63和CD9两种蛋白,选择10%的分离胶和4%的浓缩胶制备SDS-PAGE;RIPA裂解外泌体蛋白,另裂解一盘细胞总蛋白做阳性对照。将两组样品与4×loading buffer混合,95 ℃煮样15 min,冷却后上样30 μg,在浓缩胶中80 V电泳,进入分离胶后调整为100 V,跑到底部即可停止。半干转的方法转膜,阳极到阴极的放置顺序为:厚滤纸、PVDF膜、胶、厚滤纸,25 V转膜15 min;转膜后把膜放在5%脱脂奶中室温摇床封闭3 h,取出后置于1∶1000的一抗4 ℃摇床过夜,5%脱脂奶摇床洗30 min,3次;上1∶4000的二抗室温摇床1 h,5%脱脂奶摇床洗1次5 min,PBS-T摇床洗2次,每次5 min,PBS摇床洗2次,每次5 min。按说明书配制发光底物,加入作用底物后用成像系统成像显影。
1.2.4肿瘤细胞对自身外泌体的摄取制备细胞爬片备用,将无菌清洁的小玻片(1 cm×1 cm)放于24孔板中,计数3×104个细胞种进24孔板培养至贴壁。用DiI染料按说明书标记外泌体用PBS洗2遍后[6],超高速离心浓缩外泌体。用DMEM将沉淀重悬备用。对照组加入100 μL PBS处理,实验组加入100 μL混有标记好外泌体的DMEM(0.5 mg/mL)处理。为排除非特异性染色,将最后一遍清洗的PBS上清取100 μL加入第3孔,培养箱孵育12 h后将24孔板取出,用荧光染核剂Hoechst33258标记细胞核,用多聚甲醛避光固定细胞20 min,PBS洗2遍。DABCO封固,倒置荧光显微镜观察。红色荧光即为DiI标记在膜结构上的信号,蓝色荧光即为Hoechst33258标记的细胞核,合成图片如果红色荧光的外泌体进入了细胞内,即表明DiI进入了细胞膜或细胞质内。在最后洗涤的PBS平行实验中,若没有发现红色荧光信号,说明没有非特异性荧光染色。
1.2.5划痕实验在24孔板中每孔接种1×104个HepG2细胞,待长满后,弃上清,用普通标准黄枪头进行划痕,保持枪头垂直,保证各孔划痕基本一致;用PBS清洗去脱落的细胞和漂浮在孔内的细胞碎片;向各孔中加入无血清的饥饿培养基。对照组加入100 μLPBS处理,实验组加入100 μL的外泌体悬液(0.5 mg/mL)处理,放回培养箱培养;取时间点6 h,12 h观察细胞分布状态并进行镜下拍照;计算划痕面积占图片面积的比例来计算细胞的增殖率,实验独立重复3次。
1.2.6免疫荧光染色将无菌盖玻片裁成1 cm×1 cm方块放进24孔板中,每孔接种5×104细胞,完全培养基培养24 h后观察,覆盖率在50%时,对照组加入100 μLPBS处理,实验组加入100 μLPBS溶好的Exos悬液(0.5 mg/mL)处理,继续培养24 h。加入4%多聚甲醛对细胞避光固定20 min,将玻片取出放进小皿中,用PBS洗2遍,每次5 min。加入0.2%的TritonX-100透化40 min,吸出液体,加入4N盐酸酸化30 min,再用pH8.0的Tris-HCL中和20 min。用PBS洗3次,每次5 min。加入1%的BSA溶液4 ℃封固过夜。PBS洗净后,用100 μL的1∶50的荧光抗体5MC-CD(FITC)滴加在玻片上,4 ℃避光过夜。次日将抗体吸出,PBS摇床洗3次,每次30 min。用Hoechst33258染色液(5 mg/L)避光染核10 min。PBS洗净,DABCO封固,倒置荧光显微镜下观察并拍照,实验独立重复3次。拍照结果中绿色荧光更强的组别甲基化程度更强。
1.2.7引物设计、合成与荧光定量分析选定3个与甲基化相关的基因DNMT3A、DNMT3B、DNMT1和凋亡相关基因Bax、BcI-2进行检测。待传的细胞贴壁后,实验组细胞使用100 μL的0.5 μg/mL外泌体处理,对照组细胞使用100 μL的PBS处理,培养24 h至长满。提取两组细胞的RNA进行逆转录,再进行RT-PCR扩增,体系为20 μL,其中上下游引物各0.4 μL,cDNA模板0.4 μL,去离子水8.8 μL,SYBR Premix ExTaqⅡ10 μL。华大公司合成引物。反应程序为95 ℃,15 s;60 ℃,30 s;72 ℃,30 s;共40个循环。60 ℃-95 ℃绘制熔解曲线。内参为β-actin,用2-△△CT法对各基因的相对表达量进行计算,实验独立重复3次。其中β-actin基因的上下游引物分别为3′-GATGAGATTGGCATGGCTTT,5′-CACCTTCACCGTTCCAGTTT;DNMT3B基因上下游引物分别为3′-CCCATTCGAGTCCTGTCATT,5′-GGTTCCAACAGCAATGGACT; DNMT1基因上下游引物分别为3′-ATGCTTACAACCGGGAAGTG,5′-TGAACGCTTAGCCTCTCCA;Bcl-2基因的上下游引物分别为3′-TCCTCTTTACACTGGCCAGG,5′-GAGTATTTGTGCAGCGAGGG;Bax基因的上下游引物分别为3′-CATCATGGGCTGGACATTGG,5′-CCTCAGCCCATCTTCTTCCA.
1.3统计学分析采用SPSS19.0软件进行统计分析,组间比较采用t检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1外泌体鉴定结果透射电镜观察外泌体可见圆形中间凹陷的膜状结构,粒径大小30~100 nm,见图1。Western blot成像后显示CD63和CD9均有条带出现,见图2。

图 1 透射电镜观外泌体

1:外泌体蛋白; 2:细胞总蛋白
2.2HepG2细胞对荧光标记自身外泌体的摄取倒置荧光显微镜下可见红色荧光的外泌体进入了细胞内,围绕于蓝色荧光的细胞核周围或细胞核上,表明DiI进入了细胞膜或细胞质内。见图3。
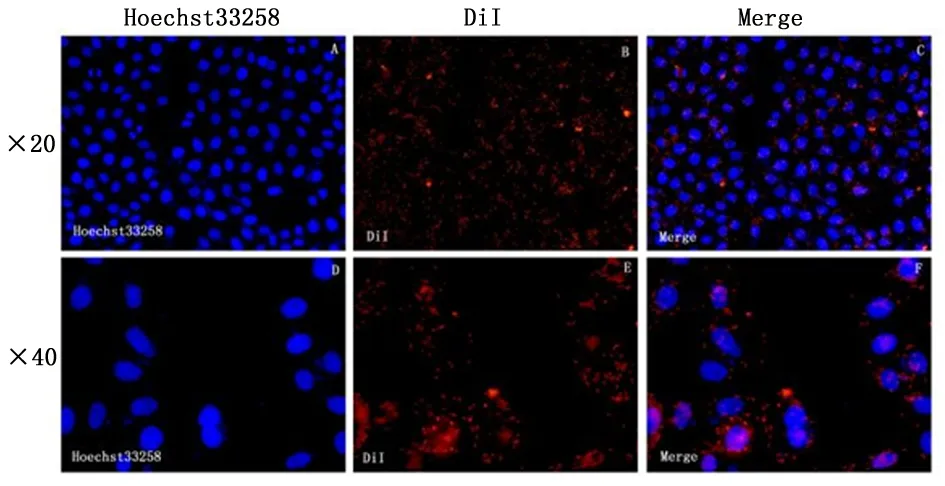
图 3 肝癌细胞对自身外泌体摄取情况
2.3划痕实验实验组6 h及12 h面积占比均明显高于对照组(P<0.05)。见表1。

表 1 划痕实验结果迁移率计算
2.4甲基转移酶荧光抗体染色倒置荧光显微镜下拍照显示,实验组的细胞核内绿色荧光要明显强于对照组,见图4。
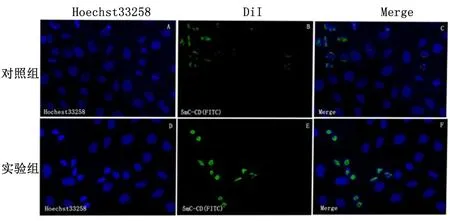
图 4 甲基化程度染色结果( ×40)
2.5肿瘤自身外泌体对肿瘤细胞甲基化相关基因转录的影响实验组Bax、DNMT3A、DNMT3B基因表达高于对照组(P<0.05);而BcI-2表达低于对照组(P<0.05)。见图5。

与对照组相比,*P<0.05
3 讨 论
外泌体是细胞生长代谢过程中分泌出来的一类包含蛋白成分、核酸成分的有膜囊泡状结构。研究表明外泌体能够作用于靶细胞,通过其内容物来调控靶细胞的生理状态。本实验对肝癌HepG2细胞的外泌体进行了提取鉴定,检测了肿瘤细胞对自身外泌体的摄取和吸收,还有其摄取外泌体后的细胞增殖能力,发现肿瘤细胞自身外泌体促进肿瘤细胞增殖。我们对实验组和对照组进行了甲基化染色,荧光显微镜下结果清晰地显示,实验组的甲基化程度明显升高。我们尝试从分子生物学角度对这一现象进行分析,通过对Bax、BcI-2两组凋亡基因和DNMT3A、DNMT3B、DNMT1这几个甲基化基因进行定量分析,我们发现Bax基因表达量升高,Bcl-2的表达量降低,有研究表明,Bcl-2/Bax的比例是细胞凋亡启动过程中开关一样的存在,二者是通过形成二聚体的方式来调节细胞凋亡的: 当Bax与Bax之间形成同源二聚体时会诱导细胞凋亡; 而当Bax与Bcl-2之间形成异源二聚体时就会抑制细胞凋亡[7]。结合我们的检测结果可以看出,实验组的Bax增多伴随Bcl-2锐减,说明大量的Bcl-2已经与Bax生成了异源二聚体,而过量的Bax之间并没有形成大量同源二聚体。结合二者的比例,我们可以推断出肿瘤细胞的外泌体是通过抑制细胞凋亡的方式,来增强肿瘤细胞的增殖迁移能力,所以实验组的凋亡会减低。
我们发现外泌体对DNMT1这类持续性甲基转移酶基因的转录量的影响较小,外泌体更有可能是通过提高DNMT3A、DNMT3B这类从头甲基转移酶基因转录量的方式来调高肿瘤细胞的甲基化水平,从而调低细胞凋亡促进肿瘤细胞的增殖[8-10]。大量研究表明,肿瘤的病程进展与miRNA密切相关。其中与肝癌相关的miRNA-23,miRNA-139,miRNA-34a等,都会影响肿瘤细胞的周期和凋亡情况[11]。其中miRNA-23和miRNA-139作为肝癌细胞特有的小RNA极有可能被外泌体包裹,来完成细胞间的信息传递,而且已经被证实参与调控细胞凋亡[12]。在许多肿瘤外泌体中已经检测到miRNA-34a的存在,并且影响细胞的增殖能力[13]。这些小RNA极有可能以外泌体为载体靶向运输至细胞内,来达到调控凋亡基因转录的作用。结合本实验数据,更可能是这类小RNA改变了从头甲基转移酶基因表达量进而引起了凋亡基因表达量的改变。这种多基因的调控通常互相影响,十分复杂,需要进一步确定这些基因对于肿瘤细胞DNA甲基化的生物学作用,从而为肿瘤的控制提供更多的指导。
综上所述,肿瘤自身外泌体可以在体外通过提升DNMT3A、DNMT3B基因的转录水平来调控肿瘤细胞甲基转移酶的表达量,甲基化程度影响Bax基因转录量从而抑制BcI-2的表达量,进而抑制细胞凋亡并促进增殖能力。总体来看,0.5μg/mL的肿瘤自身外泌体对肿瘤细胞的DNA甲基化有促进作用。尽管肿瘤自身外泌体在体外可以影响其表观遗传修饰状态,在以后的实验中我们也还需要进一步明确其所含的成分及浓度对细胞DNA甲基化的影响,从而为肝癌的临床靶向治疗提供参考。
