透明质酸及其合成酶在炎症牙髓组织中的表达
2020-08-14陈蔚婷蒋备战
陈蔚婷,蒋备战
透明质酸(hyaluronic acid, HA)作为糖胺聚糖家族成员,是细胞外基质的主要成分。它是由D-葡萄糖醛酸及N-乙酰葡糖胺的双糖单位重复数千次组成的大分子酸性粘多糖,分子量可达到5×106ku。透明质酸由细胞膜上一组高度专一性的透明质酸合成酶(hyaluronic acid synthase, HAS)合成,并分泌到细胞外基质中。HAS有3种保守的同工酶,在哺乳动物中,分别为HAS1、HAS2、HAS3。HAS1和HAS2能够合成高分子量透明质酸(2 000 ku),而HAS3合成低分子量透明质酸(100~1 000 ku)[1]。透明质酸具有许多不同的生物学功能,能够维持组织结构稳定、重塑组织、调节细胞形态变化、调节细胞信号传导,细胞粘附及细胞的增殖分化等。研究证明透明质酸在多种生理和病理过程中作为一种重要的调节剂,特别在炎症反应中具有重要的作用[2-3]。近年来,透明质酸在口腔疾病治疗中的应用日益受到关注,特别是其在颞下颌关节炎[4]、牙周炎[5]、种植体周围炎[6]等感染性炎症疾病的治疗中取得了较好的疗效[7]。透明质酸还可以作为支架材料应用于组织工程以实现组织的再生[8-9]。Ferroni等运用外源性透明质酸支架复合人牙髓干细胞,在体外成功获得牙髓样组织[10]。然而机体内源性透明质酸及其合成酶与牙髓组织炎症状态的相关研究至今鲜有报道。因此,本研究旨在通过系统检测炎症牙髓组织中内源性透明质酸及其合成酶的表达,为研究其在牙髓组织炎症调控过程中的作用提供理论依据。
1 材料与方法
1.1 样本的收集
本研究经同济大学附属口腔医院伦理委员会批准,事先向患者告知,知情同意后进行。临床收集患者因埋伏阻生而预防性拔除的健康下颌第三磨牙(n>5),以及萌出后因龋坏导致牙髓炎而拔除的下颌第三磨牙(n>5)。
1.2 组织学处理及苏木素-伊红(HE)染色
在无菌操作台内,使用高速涡轮机纵向磨开正常及炎症状态的第三磨牙,不伤及牙髓组织情况下取出正常及炎症状态的牙髓组织。PBS冲洗后用4%多聚甲醛(PFA)固定在0.1 mol/L磷酸盐缓冲液(pH=7.4)中,室温固定20 h,石蜡包埋。制作5 μm厚的组织学切片,60 ℃烤片过夜,4 ℃下保存备用。切片用于后续HE染色,免疫组织化学染色以及免疫荧光共染。将预备好的切片经脱蜡、二甲苯和乙醇梯度复水,常规HE染色、光镜观察组织学变化,确定牙髓组织正常及炎症状态。
1.3 免疫组织化学染色及免疫荧光染色实验
本次实验所有购买的抗体都有在线验证数据,具体信息如下。一抗:兔多克隆抗-TNFα(1∶100, Immunoway, YT-4689, 美国);羊多克隆抗-HA(1∶100, Abcam, ab-53842, 美国);山羊多克隆抗-HAS1(1∶100, Santa Cruz, sc-23145, 美国);兔多克隆抗-HAS2(1∶100, 博士德, ba3397, 中国)和山羊多克隆抗-HAS3(1∶100, Santa Cruz, sc-34204, 美国)。二抗:Alexa Fluor®488-驴抗兔IgG(1∶200, Life technology, 美国);Alexa Fluor®546-驴抗山羊IgG(1∶200, Life technology, 美国)和donkey anti-goat IgG(1∶1 000, Abcam, ab-6884, 美国)。
免疫组化染色使用免疫组化试剂盒(迈新, KIT9707-兔, 中国)。组织切片常规脱蜡至水;PBS清洗后置于3% H2O2中10 min,灭活内源性过氧化物;37 ℃酶消化法孵育1 h进行抗原修复,PBS漂洗后5% BSA孵育30 min,再在4 ℃和一抗孵育过夜。阴性对照组的组织切片用PBS代替一抗孵育。PBS漂洗后二抗室温孵育20 min,再次PBS漂洗后与链霉亲和素标记的过氧化物酶室温反应20 min,以3,3′-二氨基联苯胺(DAB)为显色剂,苏木素复染,封片剂(YEASEN, 36307ES08, 上海)封片,立体显微镜(Carl Zeiss, Stemi508,德国)及数码显微镜(Nikon Eclipse 80i, 日本)观察。
免疫荧光检测先将组织切片与荧光二抗在室温下孵育1 h。使用DAPI(Sigma, D9542-10MG, 美国)进行细胞核染色,使用甘油封片,镜检拍照,荧光显微镜观察((尼康 DS-Ri1-U3, 日本);(尼康Intersilight C-HGF1, 日本))。
1.4 实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)
用Trizol试剂(Life Technologies, Carlsbad, CA, 美国)裂解牙髓组织,分离总RNA。提取的RNA用互补DNA合成试剂盒(Roche, Schlieren, 瑞士)进行逆转录,用FastStart Essential DNA Green Master(Roche, Schlieren, 瑞士)进行反应,qRT-PCR法反应检测IL-6、IL-8、TNFα、HAS1、HAS2 及 HAS3的mRNA的表达。采用Roche.LC96分析软件分析PCR过程,每个样本设置3个复孔,以CT值代表荧光qRT-PCR的结果,ΔCT = CT目的基因-CT内参基因,ΔΔCT = ΔCT实验组-ΔCT对照组。根据公式2-ΔΔCT计算出实验组中目的基因的相对表达量,根据溶解曲线判断扩增产物的特异性。使用SPSS 20.0单因素ANOVA进行统计学分析,Graphpad 7.0进行绘图。引物序列见表1。

表1 HAS1、HAS2、HAS3、IL-6、IL-8、TNFα引物序列
2 结 果
2.1 HE染色
HE染色结果显示,与正常牙髓组织相比,炎症牙髓组织中出现组织炎症改变,如炎性细胞浸润、胶原纤维增厚、空泡变性、成牙本质细胞层排列紊乱甚至组织坏死(图1a,d)。

正常牙髓(a, b, c, g, h, i);炎症牙髓(d, e, f, j, k, l);HE(a, d);TNFα(b, e);HA(c, f);HAS1(g, j);HAS2(h, k);HAS3(i, l)
2.2 免疫组织化学染色
常规免疫组化染色结果提示,在正常牙髓组织中几乎无法检测到TNFα的表达,而在炎症牙髓组织中TNFα的表达明显强于正常牙髓组织。正常牙髓组织中可检测到HA以及HAS1、HAS2、HAS3的表达。在炎症牙髓组织中的HA、HAS2以及HAS3的表达比正常牙髓组织的表达明显(图1b, c, e, f, h, i, k, l)。HAS1在两种牙髓组织中的表达均较弱,无明显差异(图1g, j)。
免疫荧光染色结果提示,在炎症牙髓组织中TNFα、HA的表达均分别强于它们在正常牙髓组织中的表达,且TNFα和HA之间可见荧光共染色,即在TNFα表达增强的区域,透明质酸表达亦相应增强(图2a~h),而HAS1在健康和炎症牙髓组织中的表达均较弱,其与TNFα在炎性牙髓组织中的表达不一致(图2i~p);在TNFα表达增强的炎症牙髓组织区域,HAS2(图3a~h)和HAS3(图3i~p)表达也很明显,且HAS2的荧光染色信号比HAS3更强。
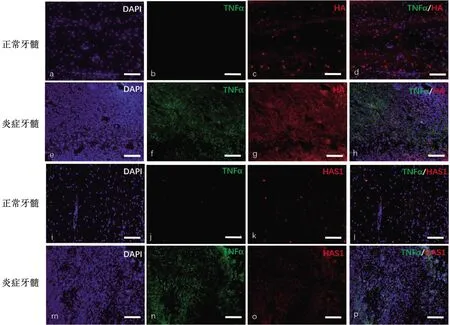
正常牙髓组织(a, b, c, d, i, j, k, l);炎症牙髓组织(e, f, g, h, m, n, o, p);DAPI(a, e, i, m);TNFα(b, f, j, n);HA(c, g);HAS1(k, o);TNFα/HA双标共染(d, h);TNFα/HAS1双标共染(l, p)

正常牙髓组织(a, b, c, d, i, j, k, l);炎症牙髓组织(e, f, g, h, m, n, o, p);DAPI(a, e, i, m);TNFα(b, f, j, n);HAS2(c, g);HAS3(k, o);TNFα/HAS2双标共染(d, h);TNFα/HAS3双标共染(l, p)
2.3 实时定量聚合酶链式反应(qRT-PCR)
qRT-PCR结果和组织学染色结果一致,显示在炎症牙髓组织样本中,IL-6、IL-8、TNFα(PIL-6=0.000 017;PIL-8=0.000 016;PTNFα=0.000 589)的mRNA表达明显较正常牙髓组织有明显的增加(图4A);与此同时,HAS2、HAS3(PHAS2=0.003 373;PHAS3=0.000 123)的mRNA表达量亦较正常牙髓有明显的增加。HAS1的表达量在炎症牙髓组织中较正常牙髓组织中稍有增加(P=0.025 232)(图4B)。P<0.05时认为差异有统计学意义。

A:正常及炎症牙髓组织中IL-6、IL-8、TNFα的mRNA的表达;B:正常及炎症牙髓组织中HAS1、HAS2、HAS3的mRNA表达
3 讨 论
牙髓是来源于外胚间充质的疏松结缔组织,位于由牙本质所形成的髓腔内,借狭窄的根尖孔与根尖周组织相连,由于缺乏足够的血液循环,因而极其脆弱。龋齿、牙外伤等都可引起牙髓组织感染性炎症,最终导致牙髓坏死甚至根尖周病变。牙髓组织在感染状态下引起炎症反应,释放各种炎症因子。炎症反应对感染状态下的牙髓组织而言是一把双刃剑,轻微的炎症可以刺激牙髓组织中的牙髓干细胞迁移到受伤部位,随后分化为成牙本质细胞并参与形成牙髓-牙本质复合体并产生修复性牙本质。严重的炎症引起不可逆的牙髓炎导致牙髓组织坏死[11]。透明质酸是牙髓组织中细胞外基质的重要成分,在维持细胞稳态、血管与细胞间的物质传递中发挥重要的功能,但有关透明质酸在牙髓组织炎症状态的表达以及作用至今仍不清楚。
本次实验通过HE染色观察到炎症牙髓组织样本组织学的改变,通过免疫组织化学实验检测到其中TNFα的免疫染色阳性表达结果、采用qRT-PCR 进一步验证了炎症因子IL-6、IL-8、TNFα在炎症牙髓组织样本中表达升高,以上结果均证明了所取牙髓组织的炎症状态,可用于后续的研究。研究结果同时表明在炎症牙髓组织中,HA、HAS2及HAS3的免疫染色强度较在正常牙髓组织中有明显增强,相关合成酶的mRNA表达亦较正常牙髓组织中明显升高,这些结果都进一步表明透明质酸可能参与牙髓组织炎症状态的调控。
透明质酸分子是一个长的线性聚合物结构,分子量范围4.0×103~5.0×106ku。以往研究表明,透明质酸对组织炎症状态的调控和其分子量大小相关。大分子量透明质酸(HMWHA)由HAS1、HAS2合成,具有抗炎活性,而低分子量的透明质酸(LMWHA)则由HAS3合成,可以促进炎症的进程[12]。研究表明,LMWHA能够启动NF-κB信号传导进而诱导炎症,从而在各种类型的细胞中产生如包括IL-6、IL-8及TNFα在内的促炎细胞因子和趋化因子[13]。在人牙髓细胞中的研究证实,HMWHA有利于损伤后炎症状态下的组织修复[14]。另一方面,炎症介质可以通过调节透明质酸合成酶的表达,调节所合成的透明质酸的分子大小,参与炎症反应[15]。本次实验免疫荧光染色结果提示炎症牙髓组织中TNFα表达增强的区域HAS2、HAS3的表达均明显升高,并且HAS2的荧光染色信号明显比HAS3更强。HAS2和HAS3之间的表达差异提示我们不同分子量大小的透明质酸都可能参与了牙髓组织炎症状态的调节;并且,HAS2及其合成的具有抗炎活性的HMWHA较HAS3及其合成具有促炎活性的LMWHA而言,在牙髓组织的炎症调控中可能更加占据优势。免疫染色结果提示HAS1在炎症牙髓组织中的表达和正常牙髓组织中的表达均较弱,且两者之间的差异并不明显。以往的文献表明HAS1主要在生长发育阶段发挥重要作用[16],这和我们早前的实验结果保持一致[17]。因此推测在发育成熟的恒牙牙髓组织中,HAS1对牙髓炎症状态的调控作用弱于HAS2及HAS3。
综上所述,本次研究采用免疫染色以及qRT-PCR检测的方法,在炎症牙髓组织中检测到了HA、HAS2及HAS3的高表达,结果提示牙髓组织中内源性透明质酸及其合成酶HAS2、HAS3都可能参与了对牙髓组织炎症感染状态的调控。然而透明质酸调控牙髓组织炎症状态的具体作用机制以及HAS2、HAS3在牙髓组织炎症状态的调控中发挥的具体作用仍有待进一步探讨研究。
