阿帕替尼联合调强适形放疗治疗、Ⅳ期非小细胞肺癌的临床疗效
2020-08-13李红艳李龙昱张月琴
李红艳,李龙昱,张月琴
青海省人民医院1药学部,2呼吸科,西宁 810000
非小细胞肺癌(non-small cell lung cancer,NSCLC)是呼吸系统发病率最高的恶性肿瘤,治疗难度大,病死率高达80%,且中国是肺癌的高发国家[1]。NSCLC早期症状不明显或被误认为是其他呼吸系统疾病而未引起足够的重视,多数患者诊断时已属晚期[2]。多数Ⅲ、Ⅳ期NSCLC患者已错失了手术治疗的机会或已出现远处转移,只能选择化疗来延长生命。相关研究显示,以放化疗为主的治疗方法是Ⅲ、Ⅳ期NSCLC的主要治疗方法,其中调强适形放疗通过系统设计、优化放射治疗计划,可提高肿瘤局部控制率,提高临床有效率[3]。此外,化疗药物可提高患者生存率,主要包括吉西他滨、去甲长春花碱、紫衫类药物等,但单独使用容易影响患者心、肝、消化道、免疫功能等,使部分患者难以完成化疗且生存率不高[4]。阿帕替尼是一种新型的小分子血管内皮生长因子受体抑制剂,有明显抗血管生成活性作用,广泛应用于肝癌及胃癌等恶性肿瘤中[5]。本研究旨在探讨阿帕替尼联合调强适形放疗治疗Ⅲ、Ⅳ期NSCLC的临床疗效及肿瘤标志物的影响,现报道如下。
1 对象与方法
1.1 研究对象
选取2016年3月至2018年6月青海省人民医院收治的86例Ⅲ、Ⅳ期NSCLC患者。纳入标准:①病理学检查确诊为NSCLC,临床分期为Ⅲ、Ⅳ期;②年龄≥18岁,卡氏功能状态(Karnofsky performance status,KPS)评分≥60分;③白细胞正常且无其他肿瘤病史;④不能手术或不愿手术的患者。排除标准:①合并明显肝、心、肺、肾功能不全;②既往接受过肺部手术;③合并认知功能障碍或其他精神疾病。随机数字表法将86例Ⅲ、Ⅳ期NSCLC患者分为观察组(n=45)与对照组(n=41),对照组患者接受调强适形放疗,观察组患者在此基础上联合阿帕替尼治疗。观察组患者男26例,女19例;平均年龄为(54.18±6.77)岁;TNM分期:Ⅲ期20例,Ⅳ期25例;吸烟21例,不吸烟24例;病理类型:鳞状细胞癌23例,腺癌22例。对照组患者男23例,女18例;平均年龄为(53.79±6.26)岁;TNM分期:Ⅲ期19例,Ⅳ期22例;吸烟19例,不吸烟22例;病理类型:鳞状细胞癌22例,腺癌19例。两组患者性别、年龄和TNM分期等基线特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有患者及家属均知情同意并签署知情同意书。
1.2 治疗方法
对照组患者接受调强适形放疗治疗,患者仰卧位,采用体部热塑膜进行固定,为避免误差,在患者体表放N型板坐标系,位置尽量靠近肿瘤中心,记录定位及百位坐标数据,在计算机断层扫描(CT)模拟机下行平静呼吸CT扫描,然后将CT图像传输到Monaco放射治疗系统中,在热塑膜于体表的前正中线及左右腋中线用激光各标记相应3个定位点,记录患者体表定位点的X、Y、Z坐标值,由肿瘤放疗科医生根据病理类型在CT与治疗病灶部位对应窗的图像上勾画靶区,通过透视测患者的呼吸运动幅度来计划靶区,根据肿瘤位置手动优化射野入射角度,放射治疗剂量为60~66 Gy,每次2 Gy,计划时处方剂量覆盖95%的计划靶区,考虑照射区组织密度差异给与组织不均匀性校正,重复摆位是X轴及Z轴方向必须与定位值无误差,Y轴方向误差<0.2 cm,共30次,每周5次,共6~7周。
观察组患者在此基础上口服阿帕替尼治疗,每次500 mg,每天1次,每周监测血常规、肝肾功能及尿常规,若患者出现2级以上不良反应后减量为250 mg。3周为1个疗程,至少治疗2个疗程。
1.3 观察指标和评估标准
①比较两组患者的临床疗效:显效,治疗后患者肿瘤完全消失;有效,治疗后患者肿瘤面积缩小>25%,但达不到显效;无效,治疗后患者肿瘤无变化[6]。总有效率=(显效+有效)例数/总例数×100%。②治疗前后,采用酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)检测两组患者血清肿瘤标志物水平,包括癌胚抗原(carcinoembryonic antigen,CEA)、细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶 9(matrix metalloproteinase 9,MMP9),严格按照试剂盒说明操作。③治疗前后,采用癌症治疗功能评价量表(functional assessment of cancer therapy-general,FACT-G)[7]评估两组患者的生活质量,总分100分,评分越高表明身体健康越好。④治疗前后,比较两组患者的体重。⑤依据美国国家癌症研究所-常见毒性分级标准(National Cancer Institute common toxicity criteria,NCI-CTC)[8]比较两组患者的不良反应发生情况,包括血小板减少、贫血、消化道反应、乏力、出血和嗜中性粒细胞减少。
1.4 统计学方法
采用SPSS 19.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
治疗后,观察组患者的临床总有效率95.56%(43/45),明显高于对照组患者的68.29%(28/41),差异有统计学意义(χ2=11.074,P<0.01)。(表1)

表1 两组患者的临床疗效[n(%)]
2.2 肿瘤标志物水平的比较
治疗前,两组患者血清CEA、CYFRA21-1、VEGF和MMP9水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CEA、CYFRA21-1、VEGF和MMP9水平均明显低于治疗前,且观察组血清CEA、CYFRA21-1、VEGF和MMP9水平均明显低于对照组患者,差异均有统计学意义(P<0.01)。(表 2)
表2 治疗前后两组患者肿瘤标志物水平的比较(ng/ml,±s)
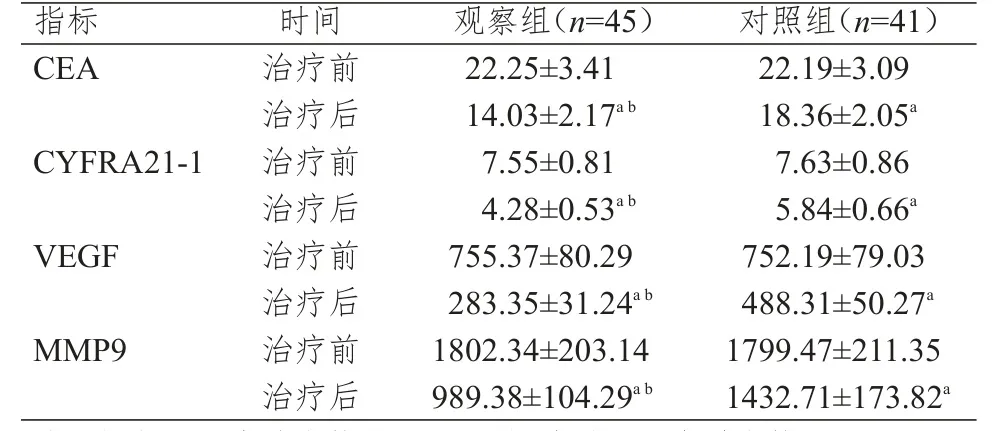
表2 治疗前后两组患者肿瘤标志物水平的比较(ng/ml,±s)
注:a与本组治疗前比较,P<0.01;b与对照组治疗后比较,P<0.01
指标C E A C Y F R A 2 1-1 V E G F M M P 9治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后2 2.2 5±3.4 1 1 4.0 3±2.1 7 a b 7.5 5±0.8 1 4.2 8±0.5 3 a b 7 5 5.3 7±8 0.2 9 2 8 3.3 5±3 1.2 4 a b 1 8 0 2.3 4±2 0 3.1 4 9 8 9.3 8±1 0 4.2 9 a b 2 2.1 9±3.0 9 1 8.3 6±2.0 5 a 7.6 3±0.8 6 5.8 4±0.6 6 a 7 5 2.1 9±7 9.0 3 4 8 8.3 1±5 0.2 7 a 1 7 9 9.4 7±2 1 1.3 5 1 4 3 2.7 1±1 7 3.8 2 a时间观察组(n=4 5)对照组(n=4 1)
2.3 生活质量的比较
治疗前,观察组患者FACT-G评分(66.59±7.28)分,与对照组患者的(67.02±7.53)分比较,差异无统计学意义(t=0.269,P=0.789)。治疗后,观察组患者FACT-G评分为(79.39±8.23)分,明显高于本组治疗前,差异有统计学意义(t=7.815,P=0.000),且观察组患者FACT-G评分明显高于对照组患者的(69.25±7.76)分,差异有统计学意义(t=5.864,P=0.000)。对照组患者治疗前后比较,差异无统计学意义(t=1.321,P=0.190)。
2.4 体重的比较
治疗前,观察组患者的体重为(56.54±6.29)kg,与对照组患者的(57.12±6.37)kg比较,差异无统计学意义(t=0.425,P=0.672)。治疗后,观察组患者的体重为(60.89±7.19)kg,重于对照组患者的(57.18±6.71)kg,差异有统计学意义(t=2.467,P=0.016)。
2.5 不良反应情况的比较
观察组患者不良反应总发生率为6.67%(3/45),明显低于对照组患者的36.59%(15/41),差异有统计学意义(χ2=11.604,P=0.001)。(表3)

表3 两组患者不良反应发生情况[n(%)]
3 讨论
肺癌的发病率和病死率均居中国恶性肿瘤首位,其病理类型多样,绝大部分属于NSCLC,严重影响患者身心健康及生活质量。探索更高效的NSCLC治疗方法,以延长NSCLC患者的生存期及生活质量是医学界的一大难题[9]。相关文献显示,不良的生活习惯是引起NSCLC的主要原因[10],如吸烟、酗酒等,特别是吸烟,对肺造成很大的负担,吸烟是肺癌的重要危险因素,烟草中含有数万种对人体伤害的化学物质,这类化合物有很强的致癌性,过多的吸入体内会导致支气管炎上皮细胞的DNA严重损伤,长期吸烟激活了细胞内的致癌基因和抑制基因,就会导致肺癌的发生[11]。
目前,临床Ⅲ、Ⅳ期NSCLC患者多采用非手术保守治疗,主要以放疗、化疗综合治疗。相关研究证明,常规放疗对NSCLC的效果不理想,患者生存率低,且不良反应多[12]。这可能与正常组织放射耐受性及肺癌放射敏感性相对较差有关。研究显示,消除一个5 cm直径的肺癌病灶,需要80~90 Gy的放疗剂量,常规放疗剂量难以达到治疗目的[13]。调强适形放疗主要通过共面、非共面多野照射,其剂量分布与肿瘤靶区形状一致,尽量避免照射周围正常组织、器官,避免损伤周围正常组织,与常规放疗相比具有明显剂量学优势[14]。但调强适行放疗可很大程度上损害患者体内其他的正常细胞,放射性辐射后正常的细胞发生另一种程度的病变,增加了患者的临床风险系数,使患者出现恶性、乏力、腹痛等不良反应,因此,该放疗也具有一定危险性[15]。
近年来,对于肿瘤控制的研究方向主要集中于阻断VEGF信号通路,阿帕替尼属于VEGF受体抑制剂,具有抗血管生成活性作用[16]。相关文献报道,NSCLC患者多存在VEGF异常增改表达,如促进血管增生在低氧环境下,可提高血浆酶原活化因子的活化、增加血管通透性的物质之一等,且大多学者认为VEGF和肿瘤的发生发展密切相关[17]。VEGF受体较多,其中VEGF2受体在血管生成、细胞有丝分裂中发挥重要作用[18]。国外较多研究证实,阿帕替尼作用机制是通过与VEGF2受体发生特异性结合,竞争性抑制VEGF2受体与VEGF的结合,使VEGF2受体自动磷酸化,从而抑制肿瘤新生血管生成,抑制肿瘤的进展,抗血管生成药物联合放疗可明显提高NSCLC的疗效。由此证明,调强适形放疗与阿帕替尼药物联合治疗NSCLC具有一定协同作用[19]。
本研究结果显示,阿帕替尼联合调强适形放疗治疗Ⅲ、Ⅳ期NSCLC患者的临床总有效率为95.56%,明显高于单独采用调强适形放疗患者的68.29%;治疗后,观察组患者血清肿瘤标志物CEA、CYFRA21-1、VEGF和MMP9水平均明显低于对照组患者;此外,治疗后,观察组患者的体重及FACT-G评分均高于对照组患者,且不良反应总发生率低于对照组患者,表明调强适形放疗联合阿帕替尼治疗时设定较低剂量治疗,可减少相关不良反应的发生。表明,在对NSCLC患者放疗的同时,口服阿帕替尼可有效抑制肿瘤细胞的扩散,明显降低了临床不良反应发生率,效果明显。
综上所述,调强适形放疗联合阿帕替尼可明显提高Ⅲ、Ⅳ期NSCLC患者的临床疗效,有效抑制肿瘤新生血管生成,提高生活质量,减少不良反应发生风险。
