红肉火龙果 TST基因家族的生物信息学分析
2020-08-13郑乾明王小柯马玉华
郑乾明, 王小柯, 马玉华
(贵州省农业科学院 果树科学研究所, 贵州 贵阳 550006)
火龙果是仙人掌科(Cactaceae)量天尺属(Hylocereus)多年生果树,其果实色泽鲜艳、营养丰富,深受消费者欢迎。研究表明,成熟火龙果果实积累的可溶性糖主要是葡萄糖和果糖,蔗糖含量较低[1-2]。可溶性糖含量和构成是决定火龙果果实品质和商品价值的关键因子。研究火龙果果实的可溶性糖积累,对调控和改良果实品质,提高果品价值具有重要意义。当前对火龙果果实可溶性糖积累的分子机制尚无研究,参与可溶性糖积累的功能基因未见分离。
液泡是植物细胞中可溶性糖的主要贮藏场所,液泡膜上的糖转运蛋白参与可溶性糖的跨膜输入或输出,从而影响液泡乃至整个细胞可溶性糖的积累[3-4]。植物TST基因家族是近年逐步证明其糖转运特性和参与可溶性糖积累的糖转运蛋白。TST蛋白定位于液泡膜,通过偶联质子的方式反向转运蔗糖、葡萄糖或果糖,因而是一个负责糖输入的糖转运蛋白[5-7]。目前在苹果、葡萄、甜橙、梨和森林草莓基因组序列中克隆获得TST基因家族,其表达模式与果实可溶性糖积累密切相关[8-12]。西瓜、甜瓜和梨相关TST基因在草莓或番茄果实中过表达,均证明其促进果实可溶性糖积累,是控制果实可溶性糖含量的重要正调控基因[13-15]。
目前尚无火龙果基因组序列发布,前期针对火龙果果实和茎进行多次转录组测序,获得的序列数据可用于目的基因分离[16]。研究对火龙果果实和茎转录组测序获得的Unigene进行分析,分离TST基因家族并进行生物信息学分析,为研究火龙果TST基因的生理功能,探讨果实可溶性糖积累的分子机制,调控和改良果实品质奠定理论基础。
1 材料与方法
1.1 转录组数据来源
研究从以下数据中筛选目的基因:2015年11月采集火龙果成熟果实和成熟茎样品转录组测序,获得Unigene数据量为55.0 Mb,Unigene数量79 658个[16]。2017年9-10月采集5个时期火龙果果实共15份样品转录组测序,获得Unigene数据量为84.7 Mb,Unigene数量为63 958条。2018年9月采集火龙果成熟果实和成熟茎共6份样品转录组测序,获得Unigene数据量为58.8 Mb,Unigene数量为6 6253条。
1.2 火龙果 TST基因分离
从上述转录组测序获得的序列注释结果中检索tonoplast sugar transporters、tonoplast monosaccharide transporters或monosaccharide-sensing protein相关的Unigene序列,使用BioEdit程序进行序列拼接,获得的一致性Contig序列用Blastx程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)再次检索。
1.3 序列分析
开放读码框(Open reading frame,ORF)预测使用ORF Finder程序(https://www.ncbi.nlm.nih.gov/orffinder),相对分子量和理论等电点预测使用在线Protparam程序(https://web.expasy.org/compute_pi/);HMMTOP程序(http://www.enzim.hu/hmmtop/index.php);亚细胞定位预测使用WoLF PSORT程序(网站中的Conserved Domain Database(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)。
1.4 系统发育分析
从GenBank数据库下载拟南芥AtTMT1-3家族(At1g20840、At4g35300和At3g51490)、葡萄VvTMT1-3家族(HQ323282、HQ323283和HQ323284)、西瓜ClTST1-3家族(KY367354、KY367352和KY367355)、甜瓜CmTST1-3(XP_008464819.1、XP_008448165.1和XP_016899284.1)和甜菜TST家族(BvTST1:XP_010686712.1、BvTST2.1:XP_010678631.1、BvTST2.2:XP_010690557.1、BvTST3:XP_010680636.1)等序列。从蔷薇科果树基因组数据库(https://www.rosaceae.org/)下载苹果TST家族序列(MdTMT1-3:MDP0000381084、MDP0000212510和MDP000086
8028),使用Clustal W程序进行氨基酸序列比对,比对结果利用MEGA7.0,采用邻接法构建系统发育树,Bootstrap值进行1 000次重复检验。
2 结果与分析
2.1 TST基因家族分离
根据此前对火龙果果实和茎组织3次转录组测序获得的Unigene注释结果,结合序列比较、拼接和注释,共获得4条火龙果TST相关序列(表1)。根据NCBI网站中序列同源性比对结果,命名为HpTST1、HpTST2.1、HpTST2.2和HpTST3,分别含有长度为2 127 bp、2 235 bp、2 220 bp和2 193 bp的ORF,编码长度分别为708 aa、744 aa、739 aa和730 aa的氨基酸序列。其预测等电点为4.84~5.36,相对分子量为75.7~80.4 kDa。

表1 红肉火龙果 TST基因家族成员信息
2.2 序列同源性
红肉火龙果TST基因家族序列进行两两比较结果表明,HpTST2.1和HpTST2.2间的核苷酸和氨基酸序列相似性较高,分别为80.6%和80.5%;其余两两间核苷酸和氨基酸序列相似性分别为67.3%~68.8%和64.7~67.8%。从表2可知,HpTST1与甜菜TST1、菠菜TST2氨基酸序列相似性分别为78.0%和74.9%;HpTST2.1与甜菜TST2.2、TST2.1氨基酸序列相似性分别为79.5%和76.9%;HpTST2.2与甜菜TST2.2、TST2.1氨基酸序列相似性分别为80.0%和76.0%;HpTST3与甜菜TST3、藜麦TST2氨基酸序列相似性分别为83.4%和82.0%。

表2 红肉火龙果 TST基因氨基酸与其他相关基因的序列相似性
TST氨基酸序列保守结构预测表明,红肉火龙果TST基因的氨基酸序列N端均含有MFS超家族(Major Facilitator Superfamily,主要易化子超家族)结构域(编号:cl28910),在C端含有MFS家族GLUT(Glucose transporters,葡萄糖转运蛋白)结构域(编号:cd17315)。因此,红肉火龙果TST家族属于MFS超家族,具有潜在的葡萄糖转运活性。
2.3 跨膜结构及亚细胞定位预测
从表3看出,HpTST1、HpTST2.1和HpTST3均含有11个跨膜域,N端位于细胞外。HpTST2.2含有12个跨膜域,N端位于细胞内。亚细胞定位预测表明,HpTST1定位于质体、叶绿体或内质网,HpTST2.1和HpTST2.2定位于质体或液泡,HpTST3定位于叶绿体、质体或液泡。
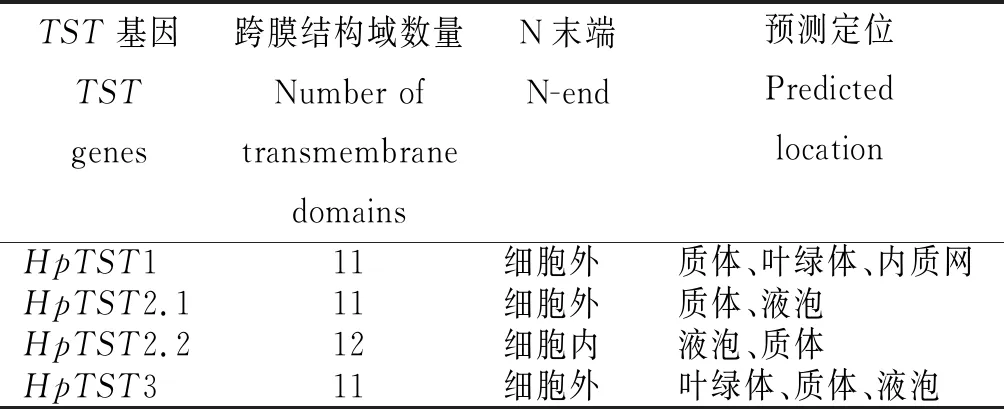
表3 红肉火龙果 TST基因的跨膜结构域和预测定位
2.4 TST基因分类
根据红肉火龙果TST基因的氨基酸序列以及拟南芥、西瓜、甜瓜、甜菜、葡萄和苹果等TST基因家族共同构建的系统发育树(图1),TST基因明显分为3类,其中,HpTST1与拟南芥AtTMT1、葡萄VvTMT1、苹果MdTMT1、甜菜BvTST1、西瓜ClTST1和甜瓜CmTST1均属于TST1类;HpTST2.1和HpTST2.2与拟南芥AtTMT2、葡萄VvTMT2、苹果MdTMT2-3、甜菜BvTST2.1和BvTST2.2、西瓜ClTST2和甜瓜CmTST2属于TST2类;HpTST3与拟南芥AtTMT3、葡萄VvTMT3甜菜BvTST3、西瓜ClTST3和甜瓜CmTST3均属于TST3类。
3 结论与讨论
近年来大量植物基因组序列的发布,为全基因组范围基因家族的分离奠定了有利基础。通过对基因组序列的检索,植物TST家族普遍含有2~5个成员。如甜橙含2个成员[10],拟南芥、葡萄、西瓜和甜瓜均含3个成员[5,9,14-15],甜菜含有4个成员[7],苹果含5个成员[8]。目前尚无火龙果基因组序列的发布,仅能通过其茎和果实等组织的转录组数据分离其TST基因家族。本研究分离的火龙果TST基因家族含有4个成员,与上述物种中TST成员数量基本一致。火龙果与甜菜同属于石竹目(Caryophyllales),亲缘关系较近,其TST基因家族数量相同[7]。这些不同物种的TST基因家族成员可分为三类,TST1类均含有1个成员,TST2和TST3类发生不同程度的基因数量增加。如苹果TST2和TST3类均有2个成员[8],火龙果与甜菜TST2类均含有2个成员[7],梨TST2和TST3类分别有3个和2个成员[11]。因苹果、梨、火龙果和甜菜均积累丰富的可溶性糖,由此推测基因数量的增加可能与其可溶性糖大量积累的性状保持一致。
TST最初被命名为液泡单糖转运蛋白(Tonoplast monosaccharide transporter,TMT),因其具有跨液泡膜输入单糖的特性,参与液泡可溶性糖积累[5]。随后的研究证明拟南芥AtTMT1同时具有蔗糖转运活性,甜菜BvTST2.1具有特异转运蔗糖的活性,因而被统一命名为TST[6-7]。拟南芥AtTMT1基因突变后降低其叶肉细胞液泡葡萄糖吸收活性,进而导致叶片积累的可溶性糖含量降低[5]。过表达AtTMT1基因提高叶片可溶性糖含量,种子产量、蛋白质和脂类含量均明显增加[17]。在园艺作物果实中,苹果MdTST1基因随果实成熟显著上调表达,与果实可溶性糖积累模式的相关系数高达0.837[8]。桃PpTST1基因的表达与果实可溶性糖积累模式保持一致,在果实中瞬时沉默其表达,降低果实可溶性糖含量[18]。由此可见,TST1类参与叶片和果实可溶性糖的跨液泡膜输入,促进组织的可溶性糖积累。火龙果HpTST1与拟南芥AtTMT1同属于TST1类,推测其参与果实的可溶性糖积累。
目前在积累大量可溶性的贮藏根和果实中均已证明TST2类与可溶性糖积累密切相关,是控制可溶性糖含量的重要正调控因子。甜菜BvTST2.1蛋白在根部液泡膜上大量表达,具有特异性跨膜转运蔗糖的活性,高蔗糖品种中的基因表达显著高于低蔗糖品种[7]。西瓜ClTST2和梨PbTMT4均具有蔗糖、葡萄糖和果糖转运活性、基因表达量与可溶性糖含量正相关[14];甜瓜CmTST2基因在高蔗糖品种中的表达明显高于低蔗糖品种,该基因过表达增加草莓和黄瓜果实可溶性糖含量[15]。研究获得的火龙果TST2类含有2个成员,与甜菜TST家族的序列同源性较高,推测具有蔗糖、葡萄糖和果糖等转运活性,参与果实可溶性糖积累。
研究获得火龙果TST基因家族4个成员,均具有典型的TST家族特征,含有1个TST1类成员和2个TST2类成员。结合目前在其他物种中相关研究结果,推测HpTST1、HpTST2.1和HpTST2.2是参与果实可溶性糖积累的重要候选基因。下一步需要分析上述基因的表达模式、亚细胞定位和糖转运活性,从而阐明其在火龙果果实可溶性糖积累中的生理功能,为探讨果实可溶性糖积累的分子机制和调控果实品质奠定基础。
