硫氰化钾鉴别Fe(Ⅲ)和Fe(Ⅱ)实验的改进
2020-08-12徐慧
徐慧

摘要: 针对新人教版高中化学教材中用硫氰化钾鉴别Fe(Ⅲ)和Fe(Ⅱ)实验试剂准备繁琐、实验现象容易出现异常的问题,从理论上分析硫氰化钾鉴别Fe(Ⅲ)和Fe(Ⅱ)的原理,并通过改进实验证明演示实验的可行性。改进实验使用维生素C处理FeSO4溶液,营造溶液的还原性氛围,既确保理想的实验现象,又建立化学知识与生活实际的连接点,可供课堂教学演示和学生分组实验参考。
关键词: 硫氰化钾; 鉴别Fe(Ⅲ)和Fe(Ⅱ); 实验改进; 实验探究
文章编号: 10056629(2020)06006103 中图分类号: G633.8 文献标识码: B
1 问题的提出
人教版[1]新教材《化学(必修)第一册》第三章第一节“铁及其化合物”中Fe3+和Fe2+的鉴别采用以下实验方案: 在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。实验现象为含有Fe3+的盐溶液遇到KSCN溶液时变成红色,而含有Fe2+的盐溶液遇到KSCN溶液时无明显变化。
该方案虽操作简单、现象明显、灵敏度高,是高中化学中Fe3+定性检验的经典方案,然而该方法存在以下不足。
(1) 实验试剂准备繁琐。FeCl2溶液并不是高中化学实验室常备试剂,其溶质FeCl2固体也难觅踪迹。如果一定要用FeCl2溶液,唯一的办法就是利用铁单质(铁粉或铁丝)与盐酸或FeCl3溶液反应制备,试剂配制过程操作繁琐,且无法确定溶液的物质的量浓度。
(2) 实验现象出现异常。按照教材提供的方法进行操作,实验现象常与预期不同: 不仅含有Fe3+的盐溶液遇到KSCN溶液时变成红色,而且含有Fe2+的盐溶液遇到KSCN溶液时也变成红色。虽然两支试管中溶液颜色(红色)深浅不同,但已无法作为定性判断有无Fe3+的充分证据,难以支撑硫氰化钾溶液可以鉴别Fe3+和Fe2+的结论。
基于上述原因,本文对硫氰化钾鉴别Fe(Ⅲ)和Fe(Ⅱ)实验作如下改进。
2 实验原理
Fe(Ⅲ)与KSCN溶液的显色反应之所以能够发生,可以从H2O和NCS-(KSCN提供的配体,高中一般写作SCN-)的分裂能大小得到解释[2]。在晶体场光谱化学序列中,分裂能Δ值NCS->H2O,所以NCS-与Fe3+形成的配离子较稳定。实际上,Fe3+在水溶液中以[Fe(H2O)6]3+形式存在,与NCS-发生的是配位体取代反应[3]:
[Fe(H2O)6]3++SCN-[Fe(H2O)5NCS]2++H2O
配离子通式为Fe(NCS)(3-n)n, n=1~6,都显红色[4];而Fe2+与NCS-生成的配离子无色。由此,可以利用KSCN溶液作为显色剂鉴别Fe(Ⅲ)与Fe(Ⅱ)。
Fe(Ⅲ)和Fe(Ⅱ)是铁元素的中等氧化态,但水溶液中Fe2+不如Fe3+稳定,易被水中溶解氧氧化为Fe3+。所以Fe2+的水溶液中常含有Fe3+,遇KSCN溶液会显红色。Fe2+的不稳定性对Fe(Ⅲ)和Fe(Ⅱ)的鉴别造成干扰。
基于上述分析,成功進行课堂演示实验的关键是消除溶液中Fe2+氧化产生的Fe3+或阻止Fe2+被氧化为Fe3+。本改进实验利用生活中常见的维生素C药片将氧化产生的Fe3+还原为Fe2+,以完善该实验方案。
3 实验药品和仪器
硫氰化钾(KSCN)溶液(约0.1mol?L-1)、 FeSO4?7H2O(化学纯)、FeCl3溶液、维生素C(片剂,0.1g/片);小试管、胶头滴管、托盘天平 、量筒(100mL)
4 改进实验方案
4.1 实验步骤
(1) 将2.8g FeSO4?7H2O溶于水,稀释成100mL,配成物质的量浓度约为0.1mol?L-1的FeSO4溶液。
(2) 在小试管1#中加入上述配好的0.1mol?L-1 FeSO4溶液2滴管(约2mL),再加入一粒维生素C药片。振荡,约15s后(如果是放置7天后的0.1mol?L-1 FeSO4溶液,需要60s),使用倾析法将溶液转移到小试管2#中。
(3) 在小试管3#中加入2滴管(约2mL)FeCl3溶液。
(4) 分别向小试管2#、 3#中加入1~2滴KSCN溶液。
4.2 实验现象
FeSO4溶液一般因含有氧化产生的Fe3+而呈浅棕黄色,加入维生素C振荡后上层清液变为浅(灰)绿色,倾析法分离,取上层清液,加入KSCN溶液后无明显变化。棕黄色的FeCl3溶液中加入KSCN溶液,变为红色溶液。
5 实验结果分析与解释
含有Fe2+的盐溶液遇到KSCN溶液时仍然为无色,含有Fe3+的盐溶液遇到KSCN溶液时变成红色。通过对比实验得出结论: Fe3+遇KSCN溶液变红色、Fe2+遇KSCN溶液不变色,可以利用KSCN溶液鉴别Fe3+与Fe2+。
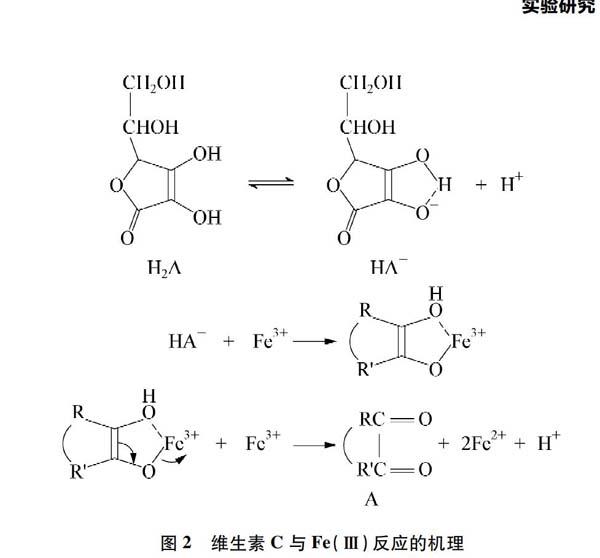
多次实验证明,使用维生素C能够有效消除亚铁盐溶液中的Fe3+,使鉴别实验达到理想效果。维生素C(C6H8O6)又称烯醇式己糖酸内酯,其结构如图1所示。维生素C的氧化还原(Cox/C)电对的标准电极电势是-0.39V[5], Fe(Ⅲ)/Fe(Ⅱ)电对的标准电极电势是0.771V[6]。由此,维生素C能将Fe(Ⅲ)还原为Fe(Ⅱ),反应机理如图2所示[7]。
维生素C可溶于水,在盐溶液中也有一定的溶解性。由此,用维生素C处理亚铁盐溶液,不仅可以将溶液中的Fe3+还原为Fe2+,而且在溶液中提供还原性氛围,可以确保Fe2+不被水中的溶解氧或溶液表面空气中的氧气氧化。在试剂配制后的7天内使用本改进方案进行实验,都可以取得良好的效果。
6 教学反思
硫氰化钾法检验铁离子属于显色法,因符合学生的认知发展水平,被高中教材普遍采纳,人教版、苏教版、鲁科版教材均利用KSCN溶液对Fe3+和Fe2+进行鉴别。该实验方案的顺利开展,将有助于学生掌握离子定性检验的一般方法、建立对比实验的良好的学科思想。
6.1 改进实验试剂准备简便
改进实验采用高中化学实验室常备的FeSO4?7H2O配制亚铁盐溶液,也可以使用实验室储存的FeSO4溶液,且不需要随用随配,使实验可行性大大增加。
6.2 改进实验现象清楚明确
在防止Fe2+被氧化或消除Fe2+氧化产生的Fe3+方面,本研究也曾尝试铁粉法、煮沸法、有机物隔离法等方法。铁粉法会使溶液带有黑色浑浊,不符合学生的认知规律;煮沸法需要临时新配溶液,并对溶剂进行煮沸,操作较为复杂;有机物隔离法引起有机物附着,仪器清洗麻烦,且水中的溶解氧还是会引起Fe2+的部分氧化,效果不佳。
维生素C在水果、蔬菜中广泛存在,维生素C药片是生活常用药品,可以在药店购买,价格低、无毒副作用。把维生素C引入化学实验,使化学实验回归生活。清晰的实验现象有助于学生通过颜色对比,正确理解Fe3+的定性检验方法和原理。
6.3 改进实验能够更好地发展学生的学科核心素养
对某些典型实验运用生活化元素进行改进创新,符合新课程标准的要求。不仅可以让学生在生活中发现和解决化学问题,而且能激发学生学习化学的兴趣,促进学生学习方式的转变,培养学生的科学探究与创新意识。
当学生用KSCN溶液鉴别Fe3+和Fe2+的知识基本形成后,可以进一步引导学生将KSCN溶液直接滴入FeSO4溶液中,异常的实验现象一定能激发其极大的好奇心: 溶液居然出现了淡淡的红色?!从而引发学生的深度思考: FeSO4溶液中的Fe3+从何而来?Fe2+的稳定性如何?之前实验中维生素C起到了什么作用?为什么去皮的苹果在空气中会慢慢变为褐色,但泡在维生素C溶液中却可以长久不变色?维生素C在生活中还可能有哪些妙用?
孔子曰:“不愤不启,不悱不发。”用带着浓浓生活味的维生素C改进化学实验,可以激发学生内心的求知欲,使其在“愤、悱”的状态下积极开展深度学习。
本次对于用硫氰化物鉴别Fe(Ⅲ)和Fe(Ⅱ)的实验改进,符合化学实验设计的简便性、探究性和趣味性原则,从实验原理和排除干扰两方面证明了KSCN溶液鉴别Fe3+和Fe2+方法的可靠性。实验操作简单、现象明显,可作为演示实验或学生分组实验进行推广。
参考文献:
[1] 人民教育出版社化学室. 普通高中课程标准实验教科书?化学(必修)第一册[M]. 北京: 人民教育出版社, 2019: 68.
[2] 朱文祥, 劉鲁美主编. 中级无机化学理论[M]. 北京: 北京师范大学出版社, 2002: 117.
[3][4][6] 武汉大学, 吉林大学. 无机化学(第3版)[M]. 北京: 高等教育出版社, 1994: 1022, 1022, 501.
[5] Matthew D. Lovander, Jacob D. Lyon, Daniel L. Parr IV, Junnan Wang, Brenna Parke, and Johna Leddy. Review —— Electrochemical Properties of 13 Vitamins: A Critical Review and Assessment [J]. Journal of The Electrochemical Society, 2018, 165(2): 18~49.
[7] 白令君, 王建英, 崔乃杰, 张奕. 抗坏血酸与铁离子反应的ESR及UVVIS研究[J]. 生物化学与生物物理学报, 1997, (6): 3~8.