基于项目式学习的“水溶液中的离子平衡”专题复习
2020-08-12牛彩霞邹映波
牛彩霞 邹映波


摘要: 以“人体代谢性酸中毒治疗方案的设计”为项目进行专题复习,在复习梳理基础知识的同时,学生自主构建复杂溶液体系中离子平衡及反应的基本认知模型,并将其应用于透析液配制中异常现象的分析与解决,学生的高阶思维得到培养。
关键词: 项目式学习; 人体酸碱平衡; 离子平衡; 专题复习
文章编号: 10056629(2020)06005306 中图分类号: G633.8 文献标识码: B
1 项目设计思路
项目式学习是指在课程标准指导下,学生以小组合作的方式,在真实情境中通过问题驱动进行探究,解决实际问题,并展示分享研究成果[1]。其中,成果形式包括一个产品、一份报告或实作的设计和发展过程等。它帮助学生获得学科知识的核心概念和原理,发展学科核心素养和能力,助力学生科学精神和人文精神的养成[2]。项目式学习流程分为选定项目、拆解项目、活动探究、交流成果和评价反思五个阶段,如图1所示。内环中由虚线所划分的5个区域中的内容为学生在相应的各个阶段所开展的活动;外环各方框内的内容是教师在对应各个阶段所从事的各项活动。
教师在整个教学活动中起着指导者、组织者、监督者、资源提供者和合作者的作用。
化学反应原理帮助学生建立认识世界的角度,揭示化学本质,发展化学学科核心素养。其中,水溶液中的离子平衡及反应主题是化学平衡理论的延续,在化学反应原理模块中占有非常重要的地位[3]。通过前面的学习,学生已基本掌握本章节的相关知识,但尚未形成系统的多平衡体系的分析思路,分析与解决复杂的实际问题的能力有待提高。
“人体酸碱平衡”是水溶液中的离子平衡及反应的一个应用实例。人体有一整套调节酸碱平衡的机制,使得血液pH恒定在7.35~7.45之间,当体内血液和组织液中酸性物质堆积,则会导致血液中HCO-3与H2CO3浓度及其比值的变化超出正常范围,引起酸碱平衡紊乱,如酸中毒。此时,治疗方案的设计仍需利用化学反应原理相关知识。从知识层面,HCO-3自身存在电离和水解两个平衡,此外在一定浓度时还能与Ca2+相互作用产生沉淀,能够将水溶液中的离子平衡(电离平衡、水解平衡、沉淀溶解平衡)很好地进行整合;从实际应用层面,HCO-3参与维持人体血液pH,与Ca2+的相互作用直接影响透析液的配制和使用。因此,本案例具有丰富的教学价值(见图2)。学生若以此为项目,以项目式学习的五个环节展开活动,以“为病人分析酸中毒原因、设计治疗方案、配制透析液、优化配制方案”为活动主线,把“水溶液中的离子平衡与反应的基础知识和基本分析思路”贯穿于整个项目的完成过程中,学生的微粒观、平衡观和守恒观等化学思想将得到进一步应用和发展,模型认知、证据推理、变化观念、平衡思想等核心素养也将得到落实。
2 项目学习目标
(1) 能利用“水溶液中的离子平衡”专题基础知识,结合微粒观、平衡观和守恒观思想,解释缓冲溶液缓冲失效的原因,并应用于人体代谢性酸中毒的原因分析,自主构建水溶液中的离子平衡问题的分析思路和模型。
(2) 能应用构建的思路模型分析透析液配制过程中出现异常现象(出现沉淀、气泡)的原因,进一步提出合理的解决方案。
(3) 梳理关于离子平衡的知识体系,形成解决实际问题的科学思维,体会化学知识在实际生活中的重要性,进一步发展和落实模型认知、证据推理、变化观念、平衡思想等学科核心素养[4]。
3 项目实施过程
3.1 选定项目
[创设情境]播放视频(该视频由本班学生提前录制),病人不舒服,到医院就诊,医生开出化验单。经检查后,血气分析报告结果显示“代谢性酸中毒”。
[驱动性问题]如果你是一名医生,你会怎么做?
[学生]选定项目为“人体代谢性酸中毒治疗方案的设计”。
设计意图: 采用角色扮演的方式,提出相关驱动性问题,引导学生主动选定研究项目为“人体代谢性酸中毒治疗方案的设计”,激发学生兴趣,使学生初步了解和体会化学在人体健康方面的应用价值。
3.2 拆解项目
[学生]依据驱动性问题,主动对研究项目进行拆解,确定子项目——(1)病因诊断: 人体代谢性酸中毒的原因;(2)对症下药: 治疗方案的设计。
[教师]提供资料:
(1) 正常人体血液中各物质浓度;
(2) 透析液及透析原理介绍。
[学生]分组活动,结合资料,利用水溶液中的离子平衡及反应的基础知识,确立完成该项目的整体方案,并规划方案完成的流程。
[教师]组织学生分组完成规划方案的汇报,对方案进行点评和优化,最终确立方案(见图3)。
3.3 活动探究
3.3.1 病因诊断——人体酸中毒的原因
[学生]依据病人血氣分析部分检查结果(见表1),逐步分析正常人体血液呈碱性、pH稳定在7.35~7.45及病人代谢性酸中毒时血液pH小于7.35的原因。
[教师]观察和倾听,在学生需要时提供必要的支持。
[学生]构建分析思路: 从关注单一粒子的单一行为(HCO-3的水解),到关注多粒子间行为(HCO-3的水解和H2CO3的电离)的相互作用,最后关注其相互作用的程度: 当H+过多时,溶液中的OH-不能充分结合H+,使得溶液中c(H+)增大,c(CO2)也增大,引起溶液酸性的增强(见图4)。
[教师]引导学生总结水溶液中的离子平衡及反应问题的分析思路。
[学生]根据上述分析过程,提炼总结思路和方法(见图5)。
设计意图: 通过分析人体代谢性酸中毒的原因,学生从只能孤立分析单一粒子HCO-3的水解行为,到最后能够关注多粒子之间的相互作用(H2CO3电离及HCO-3水解)和作用程度大小,自主形成水溶液中的离子平衡及反应问题研究思路,为后续实际问题的分析和解决奠定基础。
3.3.2 对症下药——治疗方案的设计
(1) 确定治疗方案。
[学生]结合资料和病人病情进行讨论交流,确定对病人采用透析的方式进行治疗,并确定下一步任务为透析液的配制。
(2) 透析液的配制。
[教师]发布任务,模拟100 mL 5倍血液成分浓度透析液的配制。
[学生]小组活动,依据人体血液中主要无机离子含量(见表2),根据电荷守恒的思想,筛选出配制透析液所需的溶质——NaCl、 KCl、 CaCl2和NaHCO3,计算各物质质量,并制定实验方案。
[教师]组织学生汇报实验方案,并对方案进行点评和优化,最终确立方案(见表3)。
[学生]小组活动,完成实验。在溶液配制过程中发现产生了白色沉淀和气体。
[学生]分析异常现象,根据实验中所用原料,认为白色沉淀可能是CaCl2、 NaHCO3和CaCO3,气体是CO2,需要教师提供室温下各物质的溶解度。
[教师]提供室温时以上四种物质的溶解度,确定白色沉淀为CaCO3,气体是CO2,引导学生分析CaCO3和CO2产生的原因。
[学生]应用水溶液中的离子平衡及反应的分析思路,确定了CaCO3和CO2产生的原因(见图6)。反应Ca2++CO2-3CaCO3↓的发生促进HCO-3的电离,c(H+)增大,引起CO2+H2OH2CO3HCO -3+ H+逆移及HCO -3+H2OH2CO3+OH-正移,从而产生CO2。
[学生]提出问题,透析液是根据人体血液成分配制的,为什么人体血液中没有CaCO3呢?
[学生]小组讨论,主动将血液与透析液进行对比,发现透析液浓度为血液成分浓度的5倍,在血液中c(CO2-3)?c(Ca2+)Ksp(CaCO3),从而产生CaCO3和CO2。
(3) 透析液的使用。
[学生]提出解决方案: 找寻NaHCO3的替代物质,如CH3COONa。因为CH3COO-能结合H+,降低人体血液中H+含量,纠正酸中毒。
[教师]提供资料:
(1) 醋酸通常在肌肉中代谢为乙酰辅酶A(乙酰CoA)。乙酰CoA进入三羧酸循环,每一个CH3COO-可以通过该循环代谢成为HCO-3,同时还产生CO2和H2O。
(2) 临床结果显示,由透析液进入体内的CH3COO-转化为HCO-3需要一定的时间,并受到肝功能的影响,故纠正酸中毒较慢且不充分。此过程还增加了耗氧量,抑制病人的呼吸中枢,带来低血压、消化道问题等一系列并发症。在透析液的发展史中,仅存在了20年[5]。
[学生]放弃寻找替代物的方案,提出新方案: 配制过程中,避免Ca2+和HCO-3直接接触。小组经讨论具体方案,汇报交流,确立方案如表4所示。
[学生]针对溶液配制和使用方案产生的分歧进行讨论。结合方程式2HCO -3+Ca2+CaCO3↓+H2O+CO2↑可知,若先混合会有CO2离开溶液体系,依据物料守恒可知,混合后再稀释,溶液也不能完全恢复,因此,应先稀释再混合。通过查阅资料,学生发现人体血液中还有Mg2+,因此真正医疗过程中使用的透析液中还包含MgCl2,在高浓度溶液中,会发生反应2HCO-3+Mg2+MgCO3↓+H2O+CO2↑,因此浓缩溶液B中溶质应为NaHCO3。最终确定方案3为最佳方案。
设计意图: 利用形成的思路分析实际问题。学生通过亲自动手实验,发现并关注到了实验过程中的“异常现象”——白色沉淀和气体。这与学生原有的认知Ca2+和HCO-3能够在水中共存产生了冲突。在分析白色沉淀是什么物质这一过程中,学生利用元素守恒思想分析白色沉淀可能是哪些物质,最后通过这些物质的溶解度确定该白色沉淀是CaCO3。学生利用上一环节中形成的分析问题的方法,能够顺利解释CaCO3和CO2产生的原因。在血液与透析液情况对比的环节,引发学生进一步思考,充分体会到沉淀产生的原因是相应离子的浓度积大于沉淀物的Ksp,进一步感受到沉淀溶解平衡在实际问题解决过程中的应用。
最后,学生在思路形成、分析问题的基础上,完成了对实际问题的解决,是前两个环节的进一步深入与提升。此外,学生提出解决方案——寻找替代物,避免Ca2+和HCO-3直接接触的过程,既符合透析液由“碳酸氢盐透析液→醋酸盐透析液→碳酸氢盐透析液”的发展历程,又能让学生充分体会到化学与医学技术的密切关系。
3.4 交流成果
[学生]按照方案3,重新进行透析液配制,并模拟实际使用情况,观察到稀释混合后无CaCO3沉淀和CO2气体的产生,并测定溶液的pH,与正常人体血液的pH相近。
[学生]各组交流汇报,互相点评。
3.5 评价反思
[教师]组织各组进行交流反思。
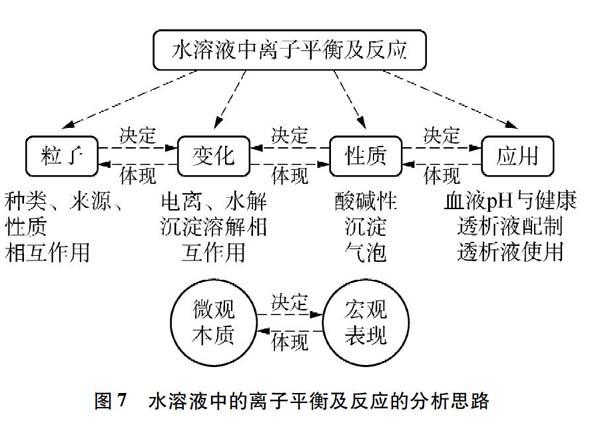
[学生]反思该项目完成的过程,梳理基础知识,总结水溶液中的离子平衡及反应的分析思路(见图7)。
4 教学反思
基于项目式学习思路,选取“人体代谢性酸中毒治疗方案的设计”进行高二水溶液中的离子平衡及反应的单元复习,在解决实际问题过程中,关注学生基础知识的落实、研究思路的形成、解决问题能力的提升以及化学核心素养的发展。在此过程中,学生作为项目完成的主体,自己选定、拆解、完成项目,利用已学知识,逐渐形成系统分析思路,并将其用于实际问题解决过程中产生的认知冲突的分析和解决。整个过程中,学生兴趣浓厚,参与度高,许多平时上课不太活跃的学生也积极参与到项目中来,生生之间的交流、辩论及合作非常自然。学生充分感受到化学在实际生活中的魅力,课后有不少学生表示通过该项目的学习,对水溶液中的离子平衡及反应的分析思路更加清晰流畅。以题目“1.写出MnSO4溶液和NH4HCO3溶液混合制备MnCO3固体的离子方程式 ;2.已知: H2PO-4HPO2-4+H+; HPO2-4PO3-4+H+。寫出FeCl3溶液和Na2HPO4溶液混合制备FePO4固体的离子方程式 。”进行课后测试,正确率达85%左右,说明学生对于复杂溶液体系中的离子平衡及反应的分析能力得到较大的提高,学科核心素养得到一定的发展。
参考文献:
[1] 申燕, 陈尚宝, 邹志谱, 姚毅锋. 基于STEM理念下的项目式学习课例设计——以“探秘人体的呼吸”为例[J]. 化学教学, 2019, (9): 50~55.
[2] 侯肖, 胡久华. 在常规课堂教学中实施项目式学习——以化学教学为例[J]. 教育学报, 2016, 12(4): 39~44.
[3] 宋心琦主编. 普通高中课程标准实验教科书?化学反应原理(选修4)(第3版)[M]. 北京: 人民教育出版社, 2004: 39~61.
[4] 杨玉琴, 倪娟. 学科核心素养视域下的教学目标: 科学研制与准确表达[J]. 化学教学, 2019, (3): 3~7.
[5] 薛军. 碳酸氢盐和醋酸盐血液透析结果比较[J]. 九江医学, 1998, (1): 31~33.