负载盐酸阿霉素的羟基磷灰石玉米醇溶蛋白pH敏感性纳米载体的体内药效学研究*
2020-08-11查丽琼王蓓蕾陈卫东张彩云安徽省中医药科学院药物制剂研究所合肥230012安徽中医药大学药学院合肥230012
★ 查丽琼 王蓓蕾 陈卫东 张彩云***(1.安徽省中医药科学院药物制剂研究所 合肥 230012;2.安徽中医药大学药学院 合肥 230012)
目前,抗癌药物的一般问题是对肿瘤细胞的选择性弱和对正常组织的严重副作用。纳米药物递送系统已用于增加肿瘤靶向,如聚合物胶束、脂质体纳米颗粒(NPs)等[1-4]。由于其较小的尺寸范围和较大的表面,纳米粒可以通过增强渗透性和保留效应(EPR)进入肿瘤细胞[5-6]。
盐酸多柔比星(DOX)是一种治疗乳腺癌、恶性淋巴瘤、肺癌、卵巢癌、肝癌等的水溶性抗癌药物[7-9]。然而DOX引起的心脏毒性、食欲不振和脱发等副作用严重限制了其临床应用[10-13]。因此,研究开发有效的DOX药物递送系统以提高其抗肿瘤效果并降低副作用尤为重要。
具有良好的生物相容性和生物降解性的玉米醇溶蛋白已被广泛用于装载药物以提高药物的生物利用度和缓慢释放行为[14-16]。例如,Penalva等[17]已经制备了玉米醇溶蛋白纳米粒来改善槲皮素在细菌脂多糖诱导的败血症小鼠模型中的口服吸收,生物利用度和抗炎作用。但是玉米醇溶蛋白纳米粒作为抗肿瘤药物载体的稳定性和靶向性有待提高[18-20]。纳米羟基磷灰石(HA)作为人体骨骼和牙齿的主要无机成分,因其具有良好的生物安全性、生物相容性和生物可降解性而被广泛应用于药物缓释载体领域[21-22]。本课题组研究利用HA的pH敏感性与Zein纳米粒结合制备了羟基磷灰石/玉米醇溶蛋白pH敏感的纳米药物载体,通过负载DOX以增强其抗肿瘤疗效[23-25]。
本课题组为提高DOX的抗肿瘤效果,降低毒副作用,已成功制备了负载盐酸阿霉素的羟基磷灰石/玉米醇溶蛋白纳米给药体系(HA /Zein-DOX NPs),其粒径大小在200 nm左右,多分散系数为0.150,包封率为(44.75±0.27)%,符合药用规定,体外释放研究表明具有一定的pH敏感性和缓释效果[26]。故本实验在课题组前期基础上继续相关研究,以乳腺癌移植瘤小鼠为研究对象,探索HA /Zein-DOX NPs对肿瘤生长抑制作用及对主要器官(心、肝、脾、肺、肾)的影响情况。
1 仪器、试剂及实验材料
1.1 材料 DOX由阿拉丁试剂公司提供(HPLC,纯度≥99%);HA/Zein-DOX NPs 冻干粉(实验室自制,200 nm);PBS购自碧云天生物科技公司(pH 7.2~7.4);DMEM 高糖培养基由美国 Gibco 公司提供;胰蛋白酶由美国 Sigma 公司提供;其他试剂为分析纯。
1.2 仪器 ELX800uv酶标仪(Bio-TEK公司);ES-315高压灭菌锅(日本Tomy KOQYO公司);干燥箱(SHANGHAI BOXUN);371型CO2培养箱(Germany);BHC-1300IIA/B2超净工作台(苏净集团安泰公司);光学倒置显微镜(上海长方光学仪器有限公司);AB135-S电子分析天平(德国METTLER TOLEDO 公司);TDL-5离心机(德 国EPPENDO RF公司);75 cm2培养瓶(美国Corning公司);KQ-300B 型超声波清洗器(昆山市超声仪器有限公司);Cascada 超纯水仪(美国PALL公司);XW-80A 微型涡旋混合器(上海沪西分析仪器有限公司);移液枪(德国Eppendorf)。
1.3 细胞 小鼠乳腺癌细胞4T1细胞株来自中国科学院上海细胞库。
1.4 试验动物 体内抗肿瘤试验选用SPF级Balb/c小鼠,4~6周龄,体重18~20 g,雌性,由安徽医科大学试验动物中心提供(批号:2011-002)。
2 方法和结果
2.1 4T1细胞的培养 将4T1细胞培养于含有10%胎牛血清、100 U·mL-1青霉素、100 U·mL-1链霉素的DMEM高糖培养基的75 cm2的细胞培养瓶中,在5% CO2、37 ℃、恒湿的无菌细胞培养箱中进行细胞培养。定期更换培养液,待细胞生长密度达到80%左右时对细胞进行传代,传代后的细胞继续常规培养。细胞从复苏后传3代左右可进行试验,试验所用细胞必须在对数生长范围内。
2.2 动物肿瘤模型的建立 动物实验遵循动物保护和使用委员会准则。选用19~20 g的SPF级Balb/c小鼠,适应性饲养3 d后,取生长至指数生长期4T1细胞,采用0.25%的胰酶消化后1 000 rpm离心5 min,细胞沉淀用PBS洗涤2次去除培养基,然后将细胞重悬于PBS中,将细胞浓度调整为2.5×107个每毫升,每只小鼠接种200 μL于左侧肋骨接近腋窝部位的脂肪垫。造模后观察肿瘤生长情况,并根据以下公式测量并计算肿瘤体积:
V=(L×W2)/2
其中:V表示肿瘤体积;L表示肿瘤长径(mm);W表示肿瘤宽径(mm)。
2.3 动物分组及给药方案 待肿瘤长到一定体积(约造模10 d后),选取造模成功的小鼠,随机分为3组,每组6只,即生理盐水(Saline)组、DOX原料药组合 HA/Zein-DOX NPs复合物组。生理盐水组每只给生理盐水0.2mL,通过预实验结果及查阅文献,确定DOX原料组和HA/Zein-DOX NPs组的给药剂量为5mg·kg-1(剂量以DOX计)。各组尾静脉给予相应的受试药物,隔3 d给药1次,共给药7次。
本次实验共取42只动物。6只作为正常组,36只进行造模, 模型成功的有34只。取18只进行瘤体重量及体积分析,15只分3组进行生存期实验。
2.4 结果及讨论
2.4.1 体重变化曲线及生存时间 在给药期间,每隔3d记录小鼠体重并观察小鼠的精神状态,活动状况,对外界的刺激反应,以及进食、饮水等生活情况,绘制体重变化图(图1)。记录各组小鼠的生存时间,并加以记录,数据如表1所示。
通过对各组小鼠的生存质量的观察可以发现,各组小鼠在肿瘤接种后的前10 d一般情况良好,约从第10 d开始,部分动物出现行为异常现象。在试验的观察后期,生理盐水组由于无肿瘤抑制作用,小鼠因肿瘤生长过大而出现行动限制、精神萎靡、状态不活跃现象;DOX游离药物组小鼠出现精神萎靡、趴卧不动等现象,说明DOX副作用明显;HA/Zein-DOX NPs组在给药后没有发生。明显的行为异常现象,仅有少数小鼠精神低迷,表明与DOX游离药物相比,HA/Zein-DOX NPs注射给药不良反应较少。
由于抗肿瘤药物严重的毒副作用通常会导致体重减轻,各组小鼠的体重变化曲线如图1所示,正常组小鼠没有接种肿瘤,其体重呈逐渐上升的趋势,上升速度平稳,为小鼠的自然生长过程;生理盐水组和DOX游离药物组均出现体重减轻现象,表明DOX游离药物具有一定的毒副作用;而HA/Zein-DOX NPs组小鼠的体重无减轻现象,呈轻微上升趋势,表明HA/Zein-DOX NPs可显著降低其毒副作用,提高小鼠的生存质量。
各组小鼠的生存时间如表1所示,由数据可以看出,与Saline组相比,DOX游离药物组各小鼠的生存时间有所延长,但无统计学差异;HA/Zein-DOX NPs组各小鼠的生存时间明显延长,且与Saline组和DOX游离药物组对比均具有显著性差异。

图1 给药期间各组小鼠的体重变化曲线(n=6)

表1 各组小鼠的生存时间 d
2.4.2 肿瘤体积、重量变化 在试验期间记录各组小鼠的肿瘤体积,在试验最后一天处死小鼠,剥离肿瘤并精密称重, 按照以下公式计算抑瘤率(%):
IR%=(MG-AG)/AG×100%
其中:IR%为抑瘤率;MG为空白组瘤重;AG为给药组瘤重。
肿瘤体积变化曲线如图2所示,由结果可以看出,Saline组小鼠由于无肿瘤抑制作用,肿瘤体积随着时间的延长逐渐增大,DOX游离药物和HA/Zein-DOX NPs均可以抑制肿瘤体积的增长,以HA/Zein-DOX NPs的抑制肿瘤生长效果最为明显。根据图3中各组肿瘤重量计算抑瘤率,DOX游离药物组具有一定的抑制肿瘤作用,其抑瘤率为50.28%,但是与Saline 组对比并无显著性差异;HA/Zein-DOX NPs复合物组的抑瘤效果较为明显,其抑瘤率为83.24%,其抑制肿瘤的效果为DOX游离药物的1.66倍。
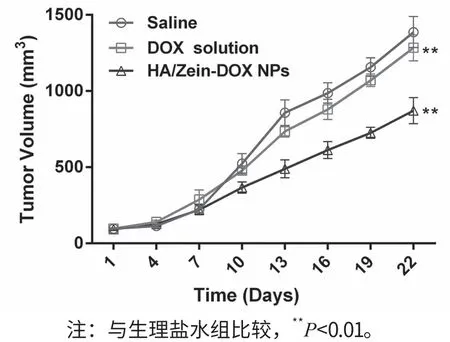
图2 给药后各组小鼠肿瘤体积变化曲线(n=6)
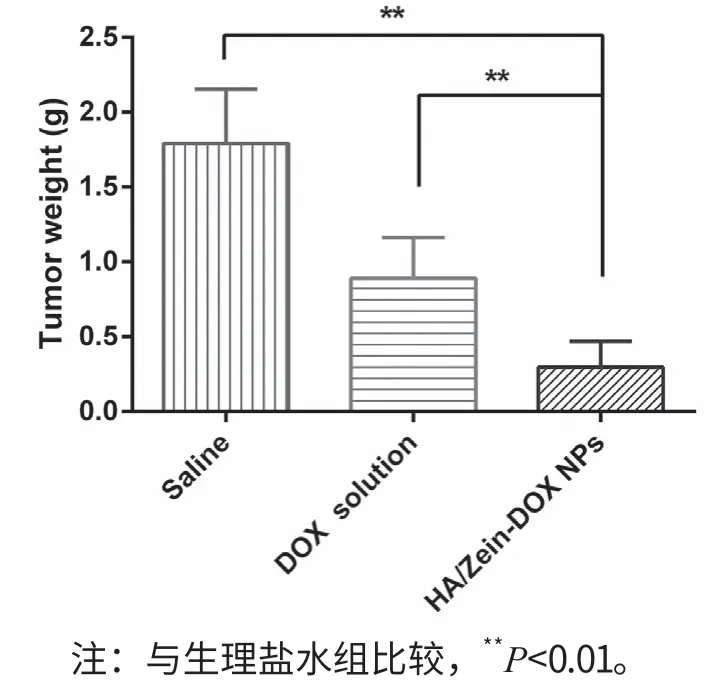
图3 各组小鼠的平均瘤重(n=6)
2.4.3 小鼠肿瘤形态图 试验结束后处死小鼠,小心剥离肿瘤并进行拍照,结果见图4。由图可知,Saline组由于无肿瘤抑制作用,因此肿瘤体积较大,DOX游离药物组和HA/Zein-DOX NPs复合物组的肿瘤体积变小,表明两种受试药物均具有一定的抗肿瘤效果。然而,与DOX相比,HA/Zein-DOX NPs组的肿瘤体积减小明显,表明该纳米粒增强了DOX的抗肿瘤效果。

图4 给药结束后各组肿瘤形态图提供清晰图
2.4.4 重要器官的H&E染色 试验结束后腹主动脉取血,小心剥离小鼠的心、肝、脾、肺、肾组织,通过苏木精-伊红(HE)染色检查各组的小鼠的主要器官的组织学结构。
各组心肝脾肺肾的H&E染色切片如图5所示,生理盐水组心脏细胞形状规则,细胞核大,深染。DOX组心脏组织出现不同程度的破坏,表现为心脏细胞排列改变,变性,坏死,细胞破裂。而HA/Zein-DOX NPs组,心脏细胞没有明显的改变。通过显微观察可知,HA/Zein-DOX NPs组与Saline组相比没有明显的毒副作用,说明HA/Zein-DOX NPs降低了DOX的心脏毒性。同时其他器官对比Saline组没有明显差异。

图5 治疗后22 d肿瘤切片的离体组织学分析(H&E染色,放大倍数:400×)
3 结论
本试验初步考察了HA/Zein-DOX NPs对小鼠乳腺癌移植瘤的抑制作用。通过给Balb/c小鼠注射4T1细胞形成移植瘤模型,给药结果表明HA/Zein-DOX NPs组体重无明显减轻,小鼠存活期延长,体内抗肿瘤活性较DOX游离药物相比更强,且心脏毒副作用降低。HA/Zein-DOX NPs纳米给药体系能有效增强DOX进入肿瘤细胞以发挥抗肿瘤效果,同时HA/Zein载体能减缓DOX的释放使DOX的心脏毒性大大降低。实验室后期将对DOX、HA/Zein-DOX NPs抗肿瘤的作用机制等进一步研究。
