大鼠慢性肝损伤的线粒体功能障碍及其影响
2020-08-11张靓睿王诗琪王红昀董若瑶孟胜男
张靓睿,王诗琪,王红昀,董若瑶,孟胜男
(中国医科大学药学院药剂学教研室,沈阳 110122)
近年来,肝病的发病率逐年增高,肝损伤已经成为临床上威胁人类健康的常见杀手之一。造成肝损伤的原因主要有药物性肝损伤、酒精性肝损伤和化学性肝损伤[1]。慢性肝损伤病程长,过程反复,可发展为肝纤维化、肝硬化,甚至肝癌[2],因此,慢性肝损伤的病因机制亟待研究。肝脏受损实质是肝细胞损伤,肝细胞内有多种细胞器,其中线粒体是肝脏中物质代谢和能量代谢的中心[3],与肝脏的代谢功能相辅相成。研究[4]发现,大鼠肝纤维化模型中观察到肝细胞线粒体肿胀变形,结构模糊,嵴减少、扭曲。肝细胞坏死在很大程度上还涉及细胞信号传导途径的激活。然而,在坏死细胞裂解期间细胞内组分的释放导致离子失衡,线粒体功能障碍,三磷酸腺苷 (adenosine triphosphate,ATP) 消耗并引发炎症反应[5]。本研究通过成功建立四氯化碳诱导大鼠慢性肝损伤模型,从线粒体功能、形态、电子传递等方面阐述了线粒体与肝损伤疾病的紧密联系,为临床探究慢性肝损伤疾病提供理论依据。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠,体质量180~200 g,中国医科大学动物实验中心提供,许可证号SCXK[京]2011-0011。
1.2 药品与试剂
50%四氯化碳大豆油溶液:四氯化碳 (分析纯)购自北京化学试剂有限公司,大豆油购自山东鲁花集团有限公司。线粒体提取试剂盒 (批号SM0020),线粒体膜电位检测试剂盒 (JC-10) (批号CA1310) 均购自北京索莱宝科技有限公司,ATP检测试剂盒 (批号S0026) 购自碧云天生物技术研究所,辅酶ⅠNAD(H) 试剂盒 (批号A114-1-1) 购自南京建成生物工程研究所。
1.3 实验仪器
DY89-9电动玻璃匀浆器 (宁波新芝生物科技有限公司),3k15高速冷冻离心机 (德国Sigma公司),BioSpectrometer紫外分光光度计 (德国艾本德Eppendorf公司),imark酶标仪 (美国Bio-Rad公司),SynergyTMHT多功能酶标仪 (LB-940,美国Bio-tek公司),C2激光共聚焦显微镜 (日本尼康公司),超低温冰箱 (美国Thermo Fisher公司)。
1.4 实验方法
1.4.1 实验动物造模、分组:选取雄性SD大鼠40只,体质量180~200 g,按照体质量随机分为空白对照组和四氯化碳慢性肝损伤模型组2组,每组20只。四氯化碳慢性肝损伤模型组大鼠皮下注射50%四氯化碳大豆油溶液,每次给予0.2 mL/100 g,每周2次,连续10周。于造模第4周,第6周,第8周,第10周末次给药后,各组随机选取5只大鼠,禁食不禁水20 h,给予10%水合氯醛,按0.3 mL/kg腹腔注射麻醉,分离大鼠肝脏组织,选取肝脏大叶组织用于线粒体提取,其余置于-80 ℃ 保存待用。
1.4.2 大鼠肝脏组织线粒体提取与分离:应用线粒体提取试剂盒分离大鼠肝脏组织胞质与线粒体,按照试剂盒说明书操作。分离后得到的线粒体用于线粒体膜电位检测与线粒体膜肿胀度检测,具体提取分离方法为取200 mg肝组织,PBS冲洗后剪碎,放入玻璃匀浆器,加入1 mL Lysis Buffer,于冰浴研磨,将组织匀浆物4 ℃,1 000g,离心5 min,取上清,4 ℃,1 000g再次离心5 min。取上清,4 ℃,12 000g离心10 min,取上清,该上清含胞浆成分,置-80 ℃ 备用。向沉淀中加入0.5 mL Wash Buffer重悬线粒体,4 ℃,1 000g离心5 min。取上清,4 ℃,12 000g离心10 min,弃上清,加入50~100 μL Store Buffer重悬线粒体沉淀,-80 ℃保存备用。
1.4.3 肝组织线粒体膜电位检测:按照线粒体膜电位检测试剂盒 (JC-10) 说明书操作。取适量JC-10(200×) 染色液,按照每50 μL JC-10 (200×) 加入8 mL超纯水的比例稀释JC-10,充分溶解并混匀,再加入2 mL JC-10染色缓冲液 (5×),混匀,即为JC-10染色工作液。将工作液稀释5倍,再加入0.1 mL总蛋白量为100 μg线粒体,应用激光共聚焦显微镜观测荧光。
1.4.4 肝组织线粒体膜肿胀度检测[6]:配制反应缓冲液 (蔗糖250 mmol/L,磷酸二氢钾5 mmol/L,氯化钙0.3 mmol/L,琥珀酸钠3 mmol/L,pH7.4),调节线粒体浓度至0.5 mg/mL,应用参比杯调零,于25 ℃ 在10 min内连续测定520 nm处的吸光度值,以吸光度的下降值反应线粒体的肿胀程度。
1.4.5 ATP含量检测:采用ATP检测试剂盒测定对照组与模型组肝脏ATP含量,按照说明书操作。每20 mg组织加入约200 μL裂解液,充分匀浆确保组织被完全裂解。裂解后4 ℃,12 000g离心5 min,取上清。配制ATP检测工作液,采用ATP检测工作液于多功能酶标仪测定相对光单位(relative light unit,RLU)值,根据标准曲线计算肝脏组织中线粒体ATP浓度。
1.4.6 辅酶ⅠNAD (H) 含量检测:按照辅酶ⅠNAD(H) 含量检测试剂盒说明书操作。每100 mg组织加入1 mL酸/碱性提取液,冰浴研磨,煮沸5 min,冷却后4 ℃,10 000g离心10 min,取上清液,加入等体积酸/碱性提取液使之中和,混匀,4 ℃,10 000g离心10 min,取上清。加入检测试剂,混匀,应用蒸馏水调零,于紫外分光光度计测定570 nm处吸光度值。
1.5 统计学分析
数据采用GraphPad Prism 5统计学软件进行分析,结果以表示,组间均数比较采用Student’st检验,P< 0.05为差异有统计学意义。
2 结果
2.1 四氯化碳致大鼠慢性肝损伤对肝脏线粒体膜电位的影响
使用激光共聚焦显微镜分别观察对照组与模型组线粒体膜电位水平,红色荧光表示线粒体膜电位较高,提示线粒体膜电位正常,绿色荧光表示线粒体膜电位较低,提示线粒体膜电位受损,与对照组相比,模型组大鼠肝脏线粒体膜电位红绿荧光比值显著降低,且随造模时间延长,红色荧光强度呈下降趋势,绿色荧光强度呈上升趋势,红绿荧光强度比值亦有所下降。可见红绿色荧光比值具有时间依赖性。结果提示,模型组大鼠肝脏线粒体受损,且随造模时间延长,肝脏线粒体受损程度增加。见图1。
2.2 四氯化碳致大鼠慢性肝损伤对肝脏线粒体膜肿胀度的影响
如图2所示,加入线粒体膜肿胀度检测液后,在520 nm处各组吸光度值均下降,模型组吸光度值的下降幅度显著低于对照组 (P< 0.01)。且随造模时间的延长,模型组吸光度值下降幅度逐渐减弱。造模4周、6周后,模型组吸光度值有下降趋势,但与对照组相比,无统计学差异。造模8周、10周后,模型组吸光度值与对照组相比,下降幅度减弱,有统计学差异 (P< 0.05),结果提示,模型组大鼠肝脏线粒体膜敏感性降低,造成线粒体损伤。
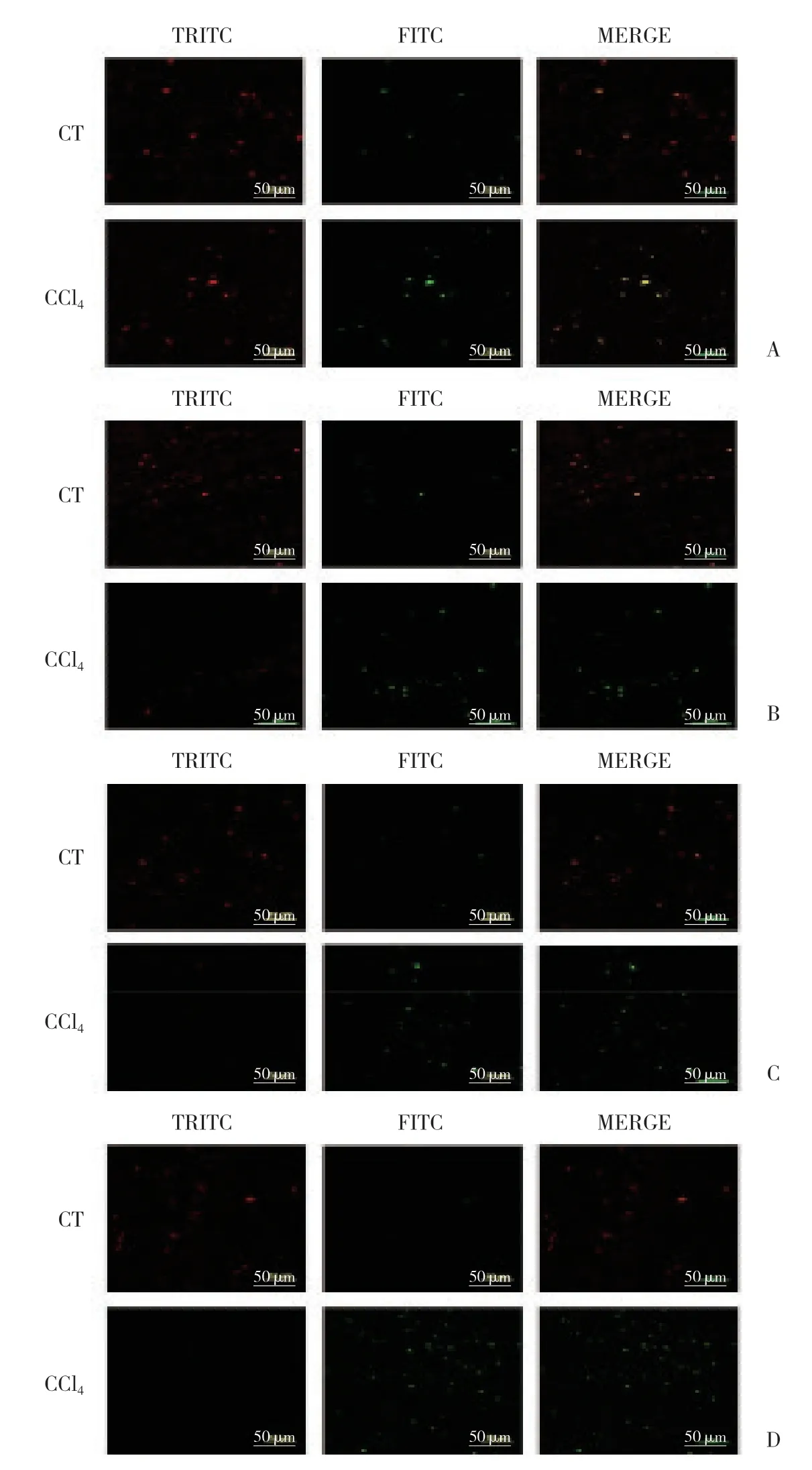
图1 线粒体膜电位荧光图Fig.1 Mitochondrial membrane potential fluorescence

图2 线粒体肿胀程度Fig.2 Degree of mitochondrial swelling
2.3 四氯化碳致大鼠慢性肝损伤对肝脏线粒体ATP合成的影响
在四氯化碳致大鼠慢性肝损伤制备4周、6周、8周、10周后,模型组ATP含量分别为 (6.08±0.53)nmol/L,(3.97±1.04) nmol/L,(3.71±0.59) nmol/L,(4.39±0.75) nmol/L,对照组ATP含量分别为 (23.58±3.41) nmol/L,(26.78±3.06) nmol/L,(30.17±1.41)nmol/L,(26.75±3.45) nmol/L,比较2组ATP含量差异发现模型组ATP水平显著低于对照组 (P< 0.001),且差异均有统计学意义 (P< 0.001)。结果提示,四氯化碳致大鼠慢性肝损伤导致线粒体ATP合成受损,表示线粒体功能损伤。
2.4 四氯化碳致大鼠慢性肝损伤对肝脏线粒体NADH/NAD+比值的影响
NADH/NAD+比值代表肝细胞线粒体内三羧酸循环的功能,比值升高,提示三羧酸循环受损,表明肝细胞线粒体损伤。造模4周后,模型组与对照组NADH/NAD+比值分别为0.58±0.06与0.41±0.06,差异无统计学意义。造模6周、8周、10周后,模型组与对照组NADH/NAD+比值分别为1.86±0.22,3.86±0.17,5.27±0.27与0.38±0.09,0.78±0.06,0.49±0.06,相比于对照组,模型组线粒体NADH/NAD+比值均显著升高,差异有统计学意义 (P<0.001)。结果提示,四氯化碳致大鼠慢性肝损伤模型组肝细胞线粒体三羧酸循环受损,肝细胞线粒体功能障碍。
3 讨论
肝脏是人体中的重要器官,在物质代谢,解毒和排泄中起决定性作用[7]。四氯化碳诱导慢性肝损伤作为经典模型,已被广泛应用[8],该模型涉及四氯化碳可经肝脏细胞色素酶代谢产生自由基[9],共价结合细胞内或细胞膜的大分子,使细胞内酶功能丧失,线粒体损伤及细胞凋亡[10]。在本研究中,应用此经典模型探讨肝脏疾病与线粒体功能障碍的关联及其所致影响。
线粒体是生物体能量中心,是细胞进行有氧呼吸的重要场所[11]。其参与真核生物的氧化代谢,能量转化,三羧酸循坏,氧化磷酸化,主导合成ATP。主要功能包括调节细胞膜电位,控制细胞程序性死亡,调控细胞增殖与代谢[12]。大量研究[13-15]表明,线粒体膜电位水平是评判线粒体生物功能的标志物,线粒体膜电位水平下降,提示线粒体生物功能障碍[15]。本研究应用激光共聚焦显微镜观察线粒体膜电位水平,发现模型组线粒体膜电位水平显著低于对照组,表明模型组线粒体膜电位受损,提示四氯化碳诱导慢性肝损伤时,线粒体功能下降及活性降低,与研究[16]结果一致。本研究通过高钙浓度引发线粒体肿胀,当线粒体膜受损时,它对高钙敏感度降低,表现为吸光度下降幅度减小[6]。本研究结果表明,模型组吸光度下降幅度较对照组有所减小,且随造模时间延长,吸光度下降幅度差异增加,提示随肝损伤程度增加,线粒体膜受损程度增加。有研究[17]表明当线粒体膜电位紊乱时,细胞内ATP合成受损,氧化磷酸化水平降低。本研究发现,肝损伤模型组ATP水平显著低于对照组,表明模型组肝脏线粒体产生ATP减少,提示慢性肝损伤模型下,ATP合成受损,能量代谢受损,可致线粒体氧化应激发生,促进炎性细胞因子的释放与激活[18]。辅酶ⅠNAD (H) 广泛存在于生物体内,主要参与生物体内线粒体呼吸链电子传递[19]。NAD (H) 含量及NADH/NAD+比值的高低可用于评价线粒体内三羧酸循环功能的强弱,较高的NAD (H) 及NADH/NAD+比值表明细胞呼吸链电子传递被抑制,损害线粒体功能[16]。本研究结果显示,慢性肝损伤模型组NADH/NAD+比值显著高于对照组,且随造模时间延长,NADH/NAD+比值显著提高,提示线粒体呼吸链功能受损,延长造模时间,则线粒体呼吸链损伤程度加重。
综上所述,四氯化碳诱导大鼠慢性肝损伤模型中,线粒体生物功能受损,膜稳定性降低,能量代谢及氧化磷酸化被抑制,表明线粒体损伤是四氯化碳引起慢性肝损伤的必要环节。线粒体损伤致肝脏能量代谢异常,表明肝损伤疾病与能量代谢密切相关,因此,研究线粒体生物功能及能量代谢情况在研究肝脏疾病的发生发展中具有重要作用。
