响应面法优化超声波辅助提取辣木叶多糖工艺
2020-08-11张世奇杨娟惠永海孙劲毅
张世奇,杨娟,惠永海,孙劲毅,*
(1.岭南师范学院化学化工学院,广东湛江524048;2.广东省辣木资源开发与利用工程技术研究中心,广东湛江524048)
辣木(Moringa oleifera),又称鼓槌树,为辣木科辣木属多年生植物,是印度北部喜马拉雅山南麓的速生树种,其根、茎、叶、种子既可作为蔬菜食用,又极具药用价值,有“奇迹树”之称[1-2]。辣木各部位中,尤以辣木叶的应用最为广泛[3]。在食用价值方面,辣木叶富含蛋白质、矿物质、氨基酸等多种营养成分,其中钙和蛋白质的含量分别是牛奶的4倍和2倍,维生素C的含量是柳橙的7倍,叶酸的含量是猪肝的4.7倍,因此许多地区用辣木叶来改善儿童营养不良的问题或将辣木叶作为补品为孕妇及哺乳期母亲增加母乳[4-6];在药用价值方面,辣木叶中含有丰富的多糖、酚类、黄酮和植物甾醇等多种生物活性成分,因此在降血脂[7]、抗癌[8]、抗氧化[9]、抗菌消炎[10]等方面均有显著效果。
辣木叶多糖是优质植物源多糖之一,其含量在8.61%~33.61%[11-13]。研究表明,辣木叶多糖具有促进肠胃吸收[14]、增强免疫力[15]、调节血糖[16]等功效。植物多糖常用的提取方法主要有水提法[17]、酸碱提法[18]和酶提法[19]等。但上述提取方法存在提取效率低、大量酸碱对环境造成污染和多糖提取后涉及溶剂残留等问题。因此本研究采用超声辅助水热法提取辣木叶多糖,利用超声波产生的机械效应和空化效应等物理作用破坏植物细胞壁,加快多糖溶出并增加多糖溶出率;同时以水作为提取溶剂又兼具环境友好和多糖无溶剂残留等优点,最后采用响应面法优化辣木叶多糖提取工艺,以期为辣木叶多糖的后续研究提供相应的试验基础和理论依据。
1 材料与方法
1.1 材料与试剂
辣木叶:湛江市佳池塘辣木种植基地;无水乙醇、葡萄糖、苯酚(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
数显恒温水浴锅(SHA-CD-1000):金坛市顺华仪器有限公司;电子分析天平(AUY120):日本岛津公司;高速冷冻医用离心机(JW-3021HR):安徽嘉文仪器装备有限公司;电热鼓风干燥箱(DHG-9035A):上海齐欣科学仪器有限公司;超声波清洗机(DL-360E):上海之信仪器有限公司;旋转蒸发器(RE-2000B):上海亚荣生化仪器厂;循环水式真空泵(SHZ-D3):巩义市英峪仪器厂。
1.3 方法
1.3.1 辣木叶多糖提取工艺
将新采摘的辣木叶洗净后自然晾干,粉碎过100目筛,准确称取5.000 g辣木叶干粉,按照试验设计条件进行超声提取,将提取液以6 000 r/min离心15 min,取上清液在60℃下减压浓缩至50 mL,向浓缩液中加入250 mL无水乙醇,待沉淀完全后,6 000 r/min离心15 min,收集沉淀并将其35℃干燥3 h,得到辣木叶多糖成品。
1.3.2 标准曲线的绘制
以葡萄糖为标准品,采用苯酚-硫酸法绘制标准曲线[20]。吸取0.1mg/mL的标准葡萄糖溶液0.1、0.2、0.4、0.6、0.8、1.0 mL分别置于10 mL比色管中,加水至1 mL,加入1 mL 5%苯酚和5 mL浓硫酸,摇匀后沸水浴反应15 min,以蒸馏水为空白对照,在490 nm处测定溶液吸光度值,以吸光度值为纵坐标,葡萄糖浓度为横坐标绘制标准曲线,得到的回归方程为y=3.512x+0.061,R2=0.995 4,表明在 0.01 mg/mL~0.1 mg/mL 的浓度范围内,吸光度和葡萄糖浓度的线性关系良好。
1.3.3 辣木叶多糖得率计算
将辣木叶多糖成品配制成一定浓度的溶液,按照1.3.2的方法测定溶液的吸光度,并计算出溶液中多糖的浓度,按照如下公式计算辣木叶多糖得率:
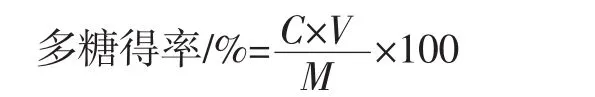
式中:C为辣木叶多糖的溶液浓度,mg/mL;V为辣木叶多糖溶液的体积,mL;M为辣木叶干粉的质量,g。
1.3.4 单因素试验
按照1.3.1的提取工艺,每个样品提取两次,研究料液比[1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL)]、提取时间(20、30、40、50、60 min)、提取温度(50、60、70、80、90 ℃)、超声功率(40、60、80、100、120 W)对辣木叶多糖得率的影响。
1.3.5 响应面优化试验
在单因素试验结果的基础上,根据Box-Behnken试验设计原理,以辣木叶多糖得率为响应值,设计响应面优化试验,试验方案见表1。
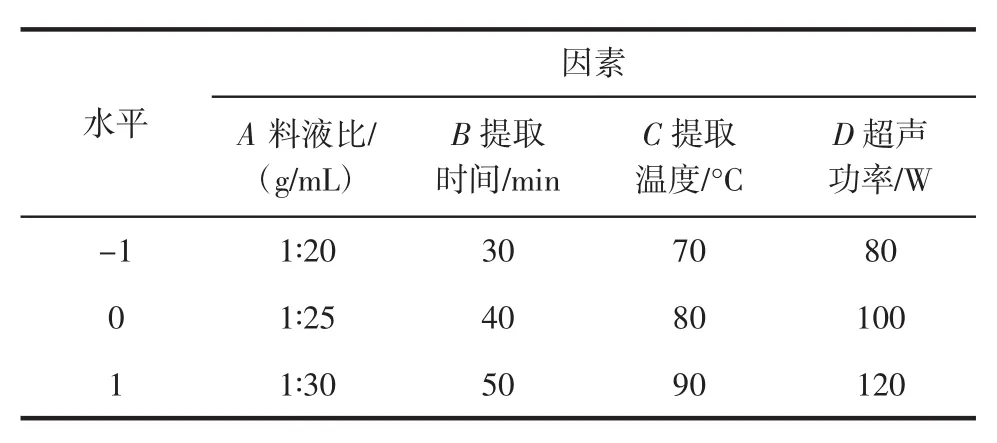
表1 响应面试验因素和水平Table 1 Factors and levels of response test
1.4 数据处理
每组试验重复3次,试验数据均为平均值±标准差,其中单因素试验结果使用SPSS 25.0进行分析,并用Origin 9.0绘制曲线图;响应面试验数据运用Design-Expert8.05分析并绘制响应面图。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对辣木叶多糖得率的影响
利用SPSS统计分析,以5个料液比每组3个平行试验作因子,多糖得率为评价指标进行单因素方差分析,结果见表2。

表2 料液比方差分析结果Table 2 Variance analysis of material-liquid ratio
由表2可知,P=0.000<0.05,说明当其余条件固定时,料液比对辣木叶多糖得率的影响显著;多重比较检验结果如图1所示。
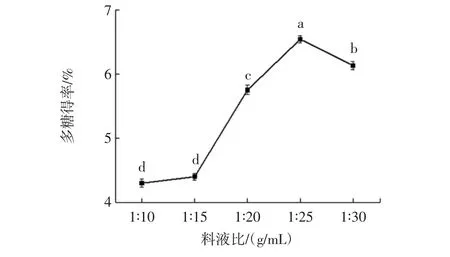
图1 料液比对辣木叶多糖得率的影响Fig.1 Effect of material-liquid ratio on the polysaccharide yield in Moringa oleifera leaf
由图1可知,随着提取溶剂的增加,辣木叶多糖得率呈先增大后减小的趋势。提取溶剂较少时,多糖不能充分溶解,因此提取率较低;料液比为1∶25(g/mL)多糖得率最大,此时多糖的得率为6.54%;提取溶剂用量继续增加时,多糖得率下降,这可能是由于提取溶剂较多时杂质溶出干扰了多糖溶出[21]。
2.1.2 提取时间对辣木叶多糖得率的影响
利用SPSS统计分析,以5个提取时间每组3个平行试验作因子,多糖得率为评价指标进行单因素方差分析,结果见表3。
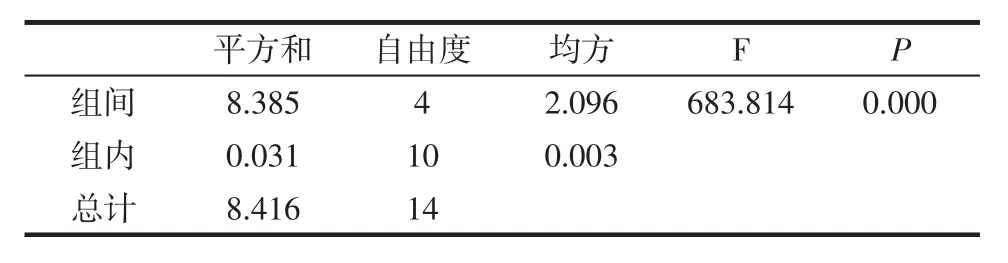
表3 提取时间方差分析结果Table 3 Variance analysis of extraction time
由表3可知,P=0.000<0.05,说明当其余条件固定时,提取时间对辣木叶多糖得率的影响显著;多重比较检验结果如图2所示。

图2 提取时间对辣木叶多糖得率的影响Fig.2 Effect of extraction time on the polysaccharide yield in Moringa oleifera leaf
如图2所示,当提取时间为40 min,辣木叶多糖的得率最大为6.51%。随着提取时间的增加,多糖得率先上升后下降。这是因为随着时间增加,细胞壁的破碎度和破碎机率增加,多糖更容易析出。但当提取时间继续增加时,多糖的得率下降,这可能是由于提取时间过长时,多糖在超声波的作用下降解速度加快,导致多糖得率快速降低[22]。
2.1.3 提取温度对辣木叶多糖得率的影响
利用SPSS统计分析,以5个提取温度每组3个平行试验作因子,多糖得率为评价指标进行单因素方差分析,结果见表4,多重比较检验结果见图3。
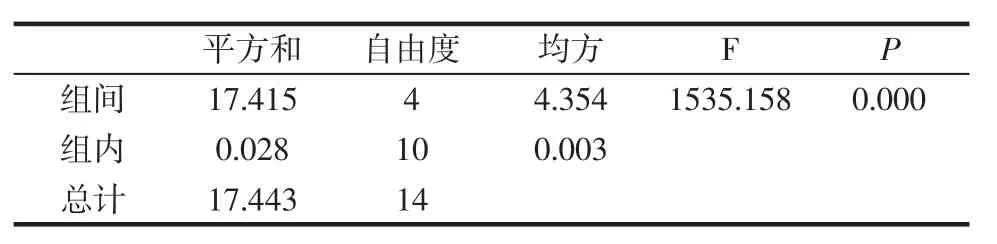
表4 提取温度方差分析结果Table 4 Variance analysis of extraction temperature
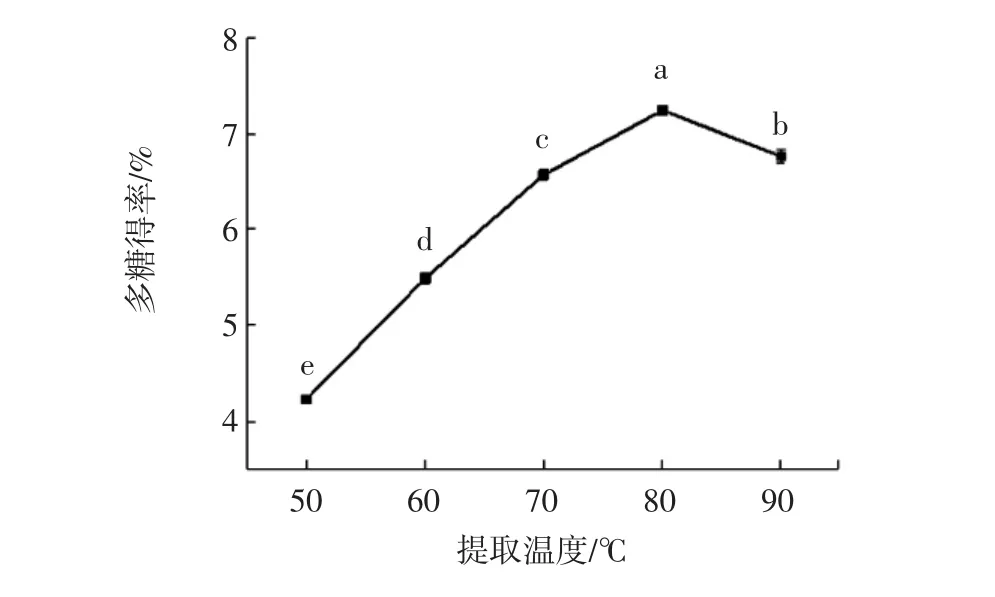
图3 提取温度对辣木叶多糖得率的影响Fig.3 Effect of extraction temperature on the polysaccharide yield in Moringa oleifera leaf
由表4可知,P=0.000<0.05,说明当其余条件固定时,提取温度对辣木叶多糖得率的影响显著;多重比较检验结果如图3。
如图3所示,当提取温度小于80℃时,多糖得率随温度增加而增加,当提取温度为80℃时,多糖得率达到最大,此时多糖得率为7.24%。当提取温度达到90℃时,多糖得率下降,这是因为当提取温度过高时,杂质的溶出率增加同时多糖分子结构被高温破坏,最终导致多糖得率下降[23]。
2.1.4 超声功率对辣木多糖得率的影响
利用SPSS统计分析软件,以5个超声功率每组3个平行试验作因子,多糖得率为评价指标进行单因素方差分析,结果见表5。

表5 超声功率方差分析结果Table 5 Variance analysis of ultrasound power
由表5可知,P=0.000<0.05,说明当其余条件固定时,超声功率对辣木叶多糖得率的影响显著;多重比较检验结果如图4。
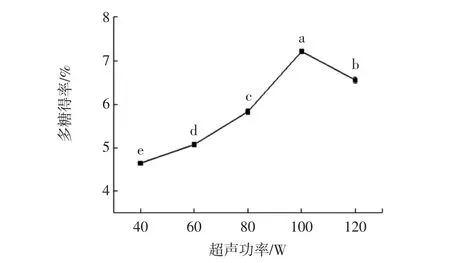
图4 超声功率对辣木叶多糖得率的影响Fig.4 Effect of ultrasound power on the polysaccharide yield in Moringa oleifera leaf
由图4可知,辣木叶多糖得率随超声功率的增加呈现先递增后减小的趋势,当超声功率为100 W时,多糖的得率为7.22%,此时多糖的得率最大。但当超声功率继续增加时,多糖的得率反而降低,这是由于当超声功率较大时,超声波的空化作用加剧了分子之间的摩擦,导致多糖分子中的化学键断裂而引起多糖降解,使多糖得率降低[24]。
2.2 辣木叶多糖提取工艺的优化
2.2.1 回归方程的建立与显著性分析
响应面试验设计与结果如表6所示。以料液比(A)、提取时间(B)、提取温度(C)、超声功率(D)为自变量,辣木叶多糖得率(Y)为响应值,运用Design-Expert8.05进行拟合得到二次多项回归方程:Y=7.30+0.12A+0.081B+0.20C+0.54D-5.000×10-3AB-0.025AC-0.23AD+0.018BC-0.045BD+0.19CD-0.92A2-0.15B2-0.42C2-1.19D2。
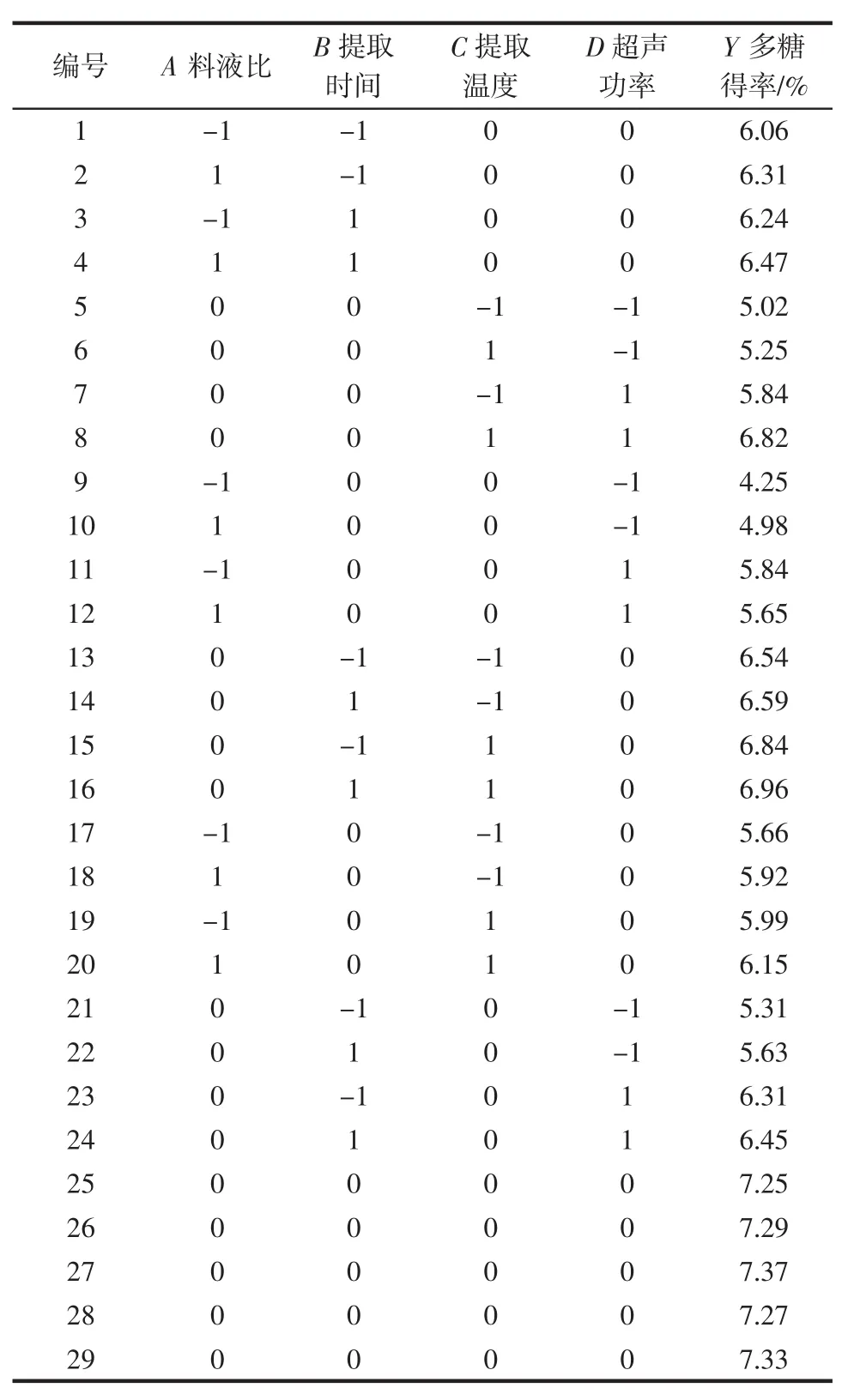
表6 响应面试验设计与结果Table 6 Experimental arrangement and results of response surface methodology
回归模型的方差分析见表7。
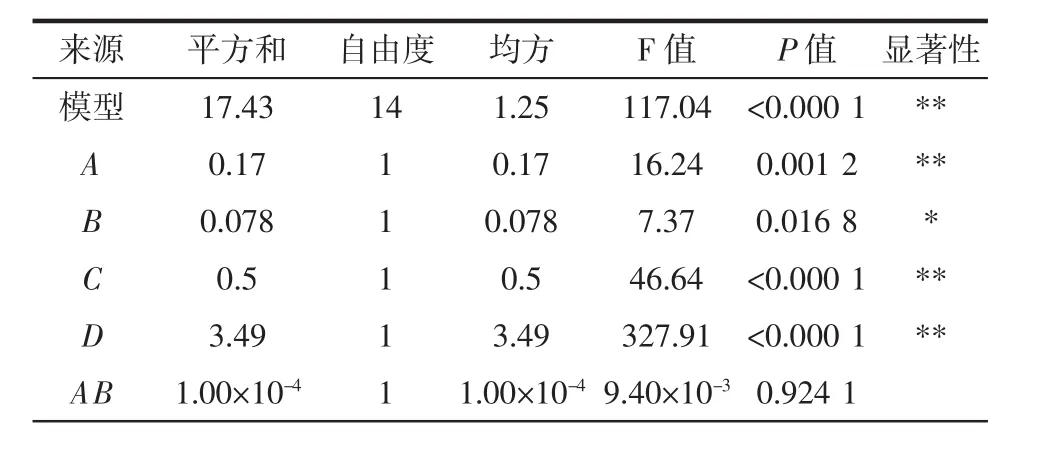
表7 回归模型的方差分析Table 7 The variance analysis of regression model
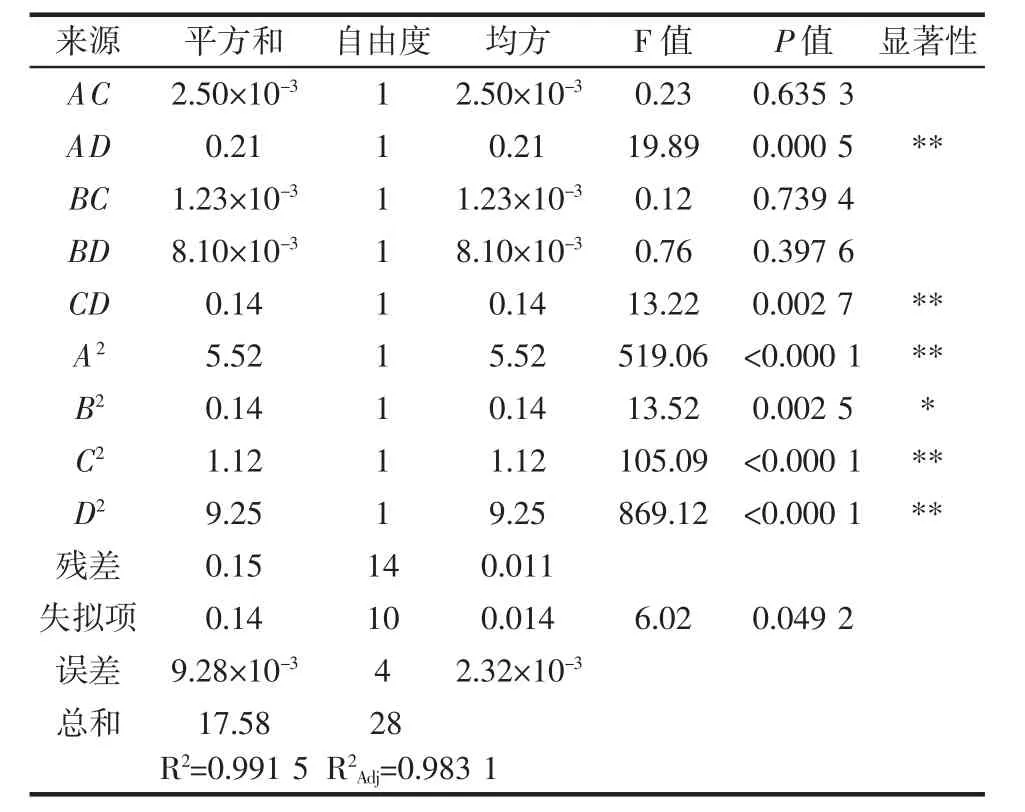
续表7 回归模型的方差分析Continue table 7 The variance analysis of regression model
由表7可知,模型P<0.000 1,表明该回归模型差异极显著;失拟项P>0.05,不显著;R2=0.991 5,RAdj2=0.983 1,说明该试验的结果与预测值接近,因此试验的可信度和精密度较高,该模型的拟合程度较高。就单因素而言,超声功率、提取温度及料液比的P<0.01,影响极显著,而提取时间的P<0.05,影响显著。由F值可知,在试验范围内各因素对辣木叶多糖得率的影响依次是D(超声功率)>C(提取温度)>A(料液比)>B(提取时间)。
2.2.2 各因素的交互作用分析
各因素之间交互作用的响应面图见图5。
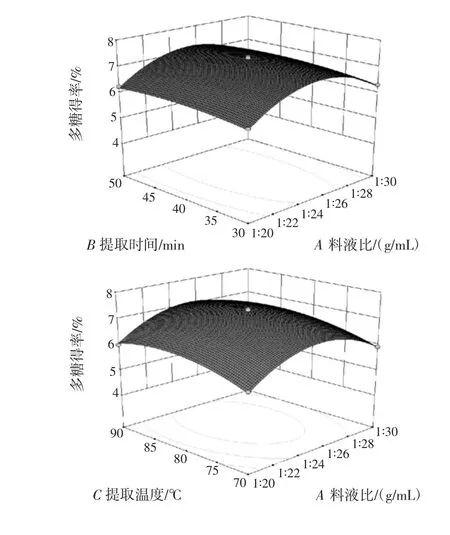
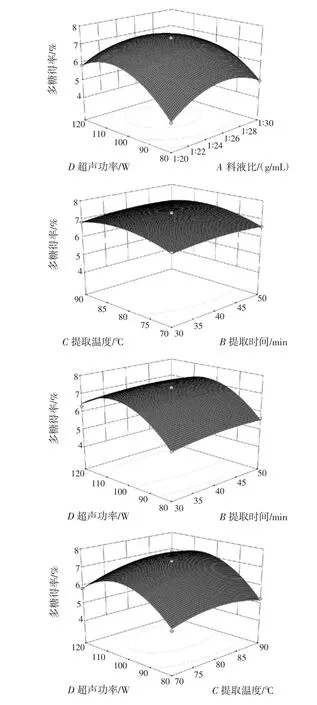
图5 各因素之间交互作用的响应面图Fig.5 Response surface for the effects of experimental factors
图5表明,料液比、提取温度和超声功率的交互作用较显著,其余各因素之间的交互作用不显著。其中料液比和超声功率交互的响应面最陡峭,因此二者的交互作用最显著,多糖得率的最大值在料液比1∶25(g/mL)、超声功率100 W附近。提取温度与超声功率的交互的响应面较陡峭,二者存在明显的交互作用,在超声功率100 W、提取温度79.97℃附近,多糖得率有最大值。结合显著性分析结果可知,在提取辣木叶多糖的过程中,应更加精确的控制超声功率、提取温度及料液比,以确保工艺的稳定性。
根据回归模型和响应面结果进行分析,辣木叶多糖最佳提取工艺为:料液比1∶25.12(g/mL)、提取时间42.52 min、提取温度83.05℃、超声功率104.86 W,在此条件下,预测辣木叶多糖的得率为7.41%。
2.3 提取工艺的验证
考虑实际操作,将条件优化为:料液比1∶25(g/mL)、提取时间43 min、提取温度83℃、超声功率105 W,在最优条件下,根据回归模型计算得到的辣木叶多糖得率为7.39%,实际得率为7.36%,二者仅相差0.03%,因此利用响应面分析法优化辣木叶多糖的提取工艺准确可靠。
3 结论
通过响应面分析可知,各因素对辣木叶多糖得率的影响依次为超声功率>提取温度>料液比>提取时间,且当各因素交互作用时,料液比和超声功率、提取温度和超声功率影响显著。经过响应面法优化后得到辣木叶多糖的最佳提取工艺为料液比1∶25(g/mL)、提取时间43 min、提取温度83℃、超声功率105 W,辣木叶多糖实际得率为7.36%。超声波辅助技术应用于辣木叶多糖的提取,既能够高效获得多糖,又能避免酸碱类提取剂的使用,同时也为后续多糖的分离纯化、结构鉴定及生理活性等研究提供良好的试验基础。
