百草枯诱导下星形胶质细胞对SH-SY5Y细胞热休克蛋白表达的影响
2020-08-10何晓燕崔宝龙李鹏飞姚鲁清赵芳周畅
何晓燕 崔宝龙 李鹏飞 姚鲁清 赵芳 周畅
(青岛大学附属医院神经内科,山东 青岛 266003)
肌萎缩侧索硬化症(ALS)是一种选择性作用于运动神经元的致命性神经退行性疾病,患者的发病年龄、发病部位、疾病进展情况以及存活时间等方面差异很大[1]。ALS的特征性病理表现是运动神经元内某些蛋白聚集,常见的有超氧化物歧化酶1(SOD1)、TAR DNA/RNA 结合蛋白43(TDP43)、肉瘤融合基因蛋白等[2]。ALS发病原因尚不清楚,但有研究显示ALS中运动神经元的死亡可能是非细胞自主性的,提示ALS的发病可能与非运动神经元细胞有关[3-5]。星形胶质细胞是神经系统内含量最多的非神经元细胞,对神经元起着营养支持作用[1]。研究显示非神经元细胞中的星形胶质细胞在病理状态下,如转染SOD1质粒的星形胶质细胞和正常神经元在体外共培养时,能够促进神经元的死亡[6]。同时研究发现,星形胶质细胞可能与散发性ALS(sALS)有关[7]。更应引起注意的是,来源于家族性ALS(fALS)和sALS患者的星形胶质细胞或星形胶质细胞条件培养基与神经元共培养后,均能够对神经元产生同样的毒性作用[8]。目前的研究已经表明,ALS运动神经元的选择性神经退行性变性与星形胶质细胞有关,但关于星形胶质细胞介导的神经毒性的潜在机制仍不是很清楚[9]。热休克反应(HSR)是在应激状态下诱导一组热休克蛋白基因发生转录的一种内源性细胞保护机制[10]。HSR异常可能是ALS潜在的病理机制之一,但关于星形胶质细胞对神经元HSR的影响及其机制还有待深入研究。神经元在应激状态下的HSR能够保护细胞避免产生错误折叠蛋白,从而避免产生蛋白沉淀,并能够促进错误折叠蛋白如TDP43的清除[11]。百草枯(PQ)是一种农药,能够引起神经细胞内TDP43蛋白聚集,常用来制作ALS疾病模型[12]。本实验旨在探讨PQ诱导下星形胶质细胞对神经细胞内热休克蛋白表达以及神经细胞存活率的影响。
1 材料与方法
1.1 材料
人神经母细胞瘤细胞SH-SY5Y细胞系和人星形胶质瘤细胞U87细胞系均购自中国科学院上海细胞库。胎牛血清购于美国BI公司;DMEM培养基购于美国 Gibco公司;PQ购于美国Sigma公司;CCK8试剂购于美国MCE公司;Anti-HSF1、Anti-HSPB8、Anti-HSP70抗体购于美国Cell Signaling Technology公司;内参GAPDH和二抗均购于中国Elabscience公司。
1.2 建立细胞共培养体系
SH-SY5Y细胞以4.5×104/cm2的密度接种于6孔板上(下室),U87细胞以4.5×104/cm2的密度接种于上室的聚碳酸酯膜上(孔径0.4 μm,直径30 mm),上下两室分别加入DMEM完全培养基分开培养,待细胞贴壁后,将上室U87细胞插入下室SH-SY5Y细胞中,置于含体积分数0.1胎牛血清和10 U/L青链霉素的DMEM中,于37 ℃、含体积分数0.05 CO2的培养箱中培养,模拟神经系统内环境,建立Trans-well系统共培养体系。
1.3 CCK8法检测U87细胞和SH-SY5Y细胞存活率
U87细胞和SH-SY5Y细胞分为未经PQ处理组(对照组)及经100、200、300、400、500 μmol/L PQ处理组(实验组),以只含培养基组为空白组。各组培养在24 h后,按照1∶10的体积比加入CCK8,37 ℃孵育1 h后,酶标仪测560 nm波长处的吸光度值(A值)。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。实验重复3次,取均值。
1.4 细胞免疫荧光化学染色法检测SH-SY5Y细胞中TDP43蛋白的定位表达情况
实验分为空白对照组(SH-SY5Y细胞无PQ处理)、模型对照组(SH-SY5Y细胞经300 μmol/L PQ处理24 h)。各组细胞用多聚甲醛室温下固定15 min, 以体积分数0.005 Triton X-100室温下通透20 min,后以体积分数0.1的山羊血清室温下封闭30 min,然后以TDP43一抗4 ℃下孵育过夜,再以绿色荧光二抗37 ℃孵育1 h,DAPI复染核,含抗荧光淬灭剂的封片剂封片,于倒置荧光显微镜下观察并采集图像。实验重复3次,取均值。
1.5 CCK8法检测各组SH-SY5Y细胞存活率
实验分为空白对照组(SH-SY5Y细胞无PQ处理)、模型对照组(SH-SY5Y细胞经300 μmol/L PQ处理24 h)及共培养组(U87细胞和SH-SY5Y细胞共培养体系经300 μmol/L PQ处理24 h)。CCK8法检测各组SH-SY5Y细胞存活情况,并计算存活率。
1.6 蛋白免疫印迹法(Western blotting)检测SH-SY5Y细胞中热休克蛋白和TDP43蛋白表达
提取空白对照组、模型对照组、共培养组SH-SY5Y细胞总蛋白,每孔20 μg蛋白等质量上样,经SDS-丙烯酰胺凝胶电泳分离后,转移到PVDF膜上。用质量分数0.05的脱脂牛奶封闭1 h后,一抗HSF1(1∶ 1 000)、HSPB8(1∶1 000)、HSP70(1∶1 000)、TDP43(1∶1 000)、GADPH(1∶1 000)孵育过夜;二抗(1∶5 000)室温孵育1 h后,ECL发光剂显色发光,成像分析仪检测分析,Image J软件分析灰度值后计算蛋白含量。实验重复3次,取均值。
1.7 统计学方法
用SPSS 17.0软件对数据进行统计分析。采用单因素方差分析(AN0VA)以及LSD法进行组间比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 PQ对U87细胞和SH-SY5Y细胞存活率影响
实验结果显示,随着PQ浓度的增加,U87细胞以及SH-SY5Y细胞的存活率均呈逐渐降低(F=9.14、37.52,P<0.01);与对照组相比较,当PQ浓度为200 μmol/L时,SH-SY5Y细胞存活率明显降低,差异有显著统计学意义(P<0.05),PQ浓度为300 μmol/L 时,U87细胞的存活率明显降低(P<0.05)。见表1。

表1 不同浓度的PQ对SH-SY5Y和U87细胞存活率的影响
2.2 各组细胞内TDP43蛋白的表达情况
细胞免疫荧光化学染色结果显示,空白对照组SH-SY5Y细胞中的TDP43蛋白在细胞核内表达,模型对照组SH-SY5Y细胞中的TDP43蛋白在细胞质中表达(图 1)。

箭头所示为TDP43蛋白,免疫化学染色,100 μm
2.3 各组SH-SY5Y细胞存活率比较
空白对照组、模型对照组和共培养组之间的SH-SY5Y细胞存活率具有显著性差异(F=22.69,P<0.01);与空白对照组相比较,模型对照组SH-SY5Y细胞存活率明显降低(P<0.01);与模型对照组相比,共培养组SH-SY5Y细胞存活率也明显降低(P<0.05)。见表2。
2.4 各组SH-SY5Y细胞内热休克蛋白和TDP43蛋白表达水平比较
空白对照组、模型对照组和共培养组间细胞内HSF1、HSP70、HSPB8和TDP43蛋白表达差异有显著性(F=6.42~28.19,P<0.05);与空白对照组相比较,模型对照组SH-SY5Y细胞内的HSP70、HSPB8以及TDP43表达明显升高(P<0.05)。与模型对照组相比较,共培养组SH-SY5Y细胞内的HSF1、HSPB8表达均降低(P<0.05)。见表2。
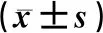
表2 PQ对各组SH-SY5Y细胞的存活率、热休克蛋白及TDP43蛋白表达的影响
3 讨 论
研究显示神经元的存活会受到非神经元细胞的影响[5]。在突变的超氧化物歧化酶1(mSOD1)转基因嵌合体小鼠模型内,表达mSOD1的非神经元细胞与野生型运动神经元共培养后,野生型运动神经元内出现ALS的典型病理特征——泛素阳性的蛋白质聚集体[13],提示表达mSOD1的非神经元细胞可导致运动神经元的损伤。
星形胶质细胞是最常见的非神经元细胞,广泛存在于中枢神经系统内[1]。体外研究结果显示,表达mSOD1的星形胶质细胞和运动神经元共培养时,能够使运动神经元的存活明显减少[6]。并且表达mSOD1的星形胶质细胞对运动神经元具有选择性毒性,但对背根神经节神经元等来源的中间神经元没有毒性[14]。动物实验显示,表达mSOD1的星形胶质细胞在大鼠体内对运动神经元具有毒性作用,能够引起运动神经元死亡,导致大鼠前肢运动功能和呼吸功能障碍[15]。来源于7例sALS患者和1例fALS患者的星形胶质细胞与运动神经元共培养后,均产生了同样的运动神经元毒性效应,提示星形胶质细胞在ALS发病中发挥了重要作用[8]。
但BHATIA等[16]的研究结果表明,PQ处理后的星形胶质细胞仍然能对神经细胞产生保护作用。实验中,原代神经元经PQ处理后与星形胶质细胞共培养,并再次用PQ处理共培养后的2种细胞,结果显示,PQ诱导后的星形胶质细胞仍能促进神经元的存活,不会失去对神经元的保护作用。
本研究结果显示,经PQ处理后的星形胶质细胞和神经细胞共培养后,神经细胞的存活率明显降低,提示PQ诱导后的星形胶质细胞会促进神经细胞的死亡,与 CLEMENT等[13]的研究结果一致,但与BHATIA等[16]的研究结果截然相反,可能与选择的细胞类型不同、PQ处理的浓度不同或者实验方法存在差异等有关,因此还需要更深入的实验研究进行验证。
HSR是在应激状态下诱导热休克蛋白表达,以维持细胞内蛋白质正常折叠的一种内源性细胞保护机制[10]。应激状态下的HSR能够减少神经元细胞内错误折叠蛋白的产生,以及促进异常聚集蛋白的清除[17]。现有研究显示,脊髓原代细胞培养中,诱导HSR后,星形胶质细胞内的HSP70明显上调,但运动神经元中HSP70的表达并没有增加,提示应激状态下的运动神经元缺乏HSR[18]。本研究中神经细胞经PQ处理后热休克蛋白表达增加,提示神经细胞在应激状态下能够提高自身HSR;但将PQ诱导的神经细胞与PQ诱导的星形胶质细胞共培养后,神经细胞内HSF1、HSPB8的表达减少,提示PQ诱导后星形胶质细胞会抑制神经细胞内热休克蛋白的表达,对神经细胞产生毒性作用。但PQ诱导的星形胶质细胞抑制热休克蛋白表达的同时,并未促进神经细胞内TDP43蛋白聚集增加。提示神经细胞内HSR异常,可能不是导致TDP43蛋白聚集的病理机制。
综上所述,PQ诱导的星形胶质细胞能抑制神经细胞内热休克蛋白的表达,并促进细胞死亡,但对神经细胞内TDP43的表达无影响,提示HSR异常可能不是 ALS的病理机制,仍需要进一步的实验进行探究。
